Синтез мочевины — это главный путь обезвреживания аммиака в оранизме. Мочевина — конечный азотистый продукт, выделяющийся с мочой у человека и млекопитающих. Образование ее происходит в печени. В 1932 г. возникла теория синтеза мочевины, известная под названием цикла Кребса, согласно которой в синтезе мочевины принимают участие 3 аминокислоты — аргинин, орнитин и цитрулин. Причем образование мочевины по циклу Кребса происходит в срезах печени в аэробных условиях. Схематически образование мочевины по циклу Кребса можно представить следующим образом:
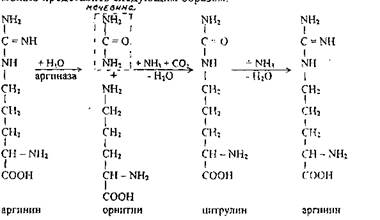
Суммирование реакций цикла образования мочевины приводит к следующему уравнению:
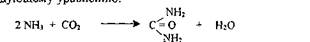
Образование мочевины по указанному циклу получило свое подтверждение и является общепринятым.
нако в последствии цикл Кребса подвергся существенной детализации. Из приведенных выше реакций можно видеть, что в образовании мочевины участвуют свободный аммиак и углекислый газ. Между тем известно, что аммиак, по мере своего образования в тканях, устраняется с образованием глутамина. Далее известно, что реакции переаминирования, которые активно происходят в различных тканях, приводят к тому, что аминогруппы подвергающихся распаду аминокислот не освобождаются в виде аммиака, а переносятся на кетокислоты. Естественно возникает вопрос, откуда же в печени берется аммиак, необходимый для синтеза мочевины? Ответ на этот вопрос дают проведенные Ратнер с сотр. исследования, показывающие, что в синтезе мочевины помимо свободного аммиака участвуют аминогруппы, входящие в состав аминокислот, в частности аспарагиновой, без предварительного отщепления их в виде аммиака. Таким образом, последовательность синтеза мочевины можно представить следующими реакциями:
1) Аммиак взаимодействует с углекислым газом под действием
фермента карбамоилфосфатсинтетазы, образуется карбамоилфосфат

2) Карбамоилфосфат взаимодействует с орнитином, образуется
цитруллин и фосфат (катализатор — орнитин — карбамоилфосфат-
трансфераза)

3) Цитруллин взаимодействует с аспарагиновой кислотой с
образованием аргининсукцината:

Катализирует реакцию аргининсукцинатсинтетаза.
4) Аргининсукцинат расщепляется аргининсукцинатлиазой на фумарат
и аргинин:

5) Аргинин под действием аргиназы расщепляется гидролитически на
мочевину и орнитин:

 |
Из приведенных реакций можно заключить, что одна группа NH2 молекулы мочевины образуется из аммиака, а другая из аминогруппы аспарагиновой кислоты. Отсюда следует вывод, что аминогруппы 50% аминокислот, подвергающихся в организме превращению путем переаминироваиия (через глутаминовую кислоту), включаются в шавелевоуксусную кислоту с образованием аспарагиновой кислоты. Аминогруппа аспарагиновой кислоты, как мы видели, непосредственно используется для синтеза мочевины. Использование азота аминокислот (аминогрупп) для синтеза мочевины видно из схемы, показывающей связь между синтезом мочевины и циклом трикарбоновых кислот.
Обезвреживание аммиака в тканях может происходить и путем синтеза глутамина и аспарагина. Однако большая часть NH3 утилизируется за счет синтеза мочевины.
Обмен сложных белков
ОБМЕН НУКЛЕОПРОТЕИДОВ
В ЖКТ под действием соляной кислоты, пепсина, трипсина и др. ферментов от нуклеопротендов отщепляется белковая часть и гидролизуется до аминокислот. Простетическая группа — нуклеиновые кислоты — разрушаются до мононуклеотидов под действием нуклеаз. Мононуклеотнды частично всасываются, а большей частью под действием фосфатаз и нуклеотидаз расщепляются на составные компоненты: азотистые основания, пентозы и фосфорную кислоту, которые, как водорастворимые вещества, активно всасываются. Фосфорная кислота пополняет запасы фосфора в организме, пентозы принимают участие в процессах окисления и синтеза новых НК, а азотистые основания
подвергаются различным превращениям. Так пуриновые азотистые основания после дезаминирования превращаются в ксантин, а затем под действием ксантиноксидазы — в мочевую кислоту, которая выводится из организма почками.
Конечными продуктами распада пиримидиновых азотистых
оснований являются аммиак, CO2 и простые азотистые соединения. Так
урацил распадается на NH3, СО2 и b- аланин. Пути превращения NH3 и CО2
мы же рассматривали, а b-аланин участвует в синтезе КоА.
Одновременно с распадом в клетках осуществляется постоянный синтез нуклеиновых кислот. Это сложный процесс, в котором участвует большое число исходных соединений: пентозы, глицин, глутамин, аспарагиновая кислота, активная форма СО2, АТФ и соответствующие ферменты. В ходе синтеза образуются сначала мононуклеотиды: АМФ, ГМФ, УМФ, последнее соединение служит стартовым веществом для образования ТМФ и ЦМФ.
Для синтеза самих НК необходимы все типы нуклеотидтрифосфатов, набор ферментов и ДНК, на матрице которой строятся новые дочерние молекулы ДНК и молекулы РНК.
ОБМЕН ХРОМОПРОТЕИДОВ.
Из многих представителей хромопротеидов для человека наибольшее значение имеет гемоглобин, обмен которого мы и рассмотрим.

Поступающий с пищей гемоглобин (НЬ) в ЖКТ распадается на свои составные части — гем и глобин. Глобин гидролизуется до аминокислот, которые всасываются в кровь, а гем окисляется до гематина и выводится с калом, т.е. экзогенный гем не используется.
Обмен эндогенного Hb протекает весьма интенсивно и связан с периодом существования эритроцитов, в которых содержится весь НЬ. Этот период составляет 110 -120 дней, после чего эритроциты распадаются, процесс активно протекает в печени, селезенке, костном мозге и др. тканях РЭС. Часть же эритроцитов распадаегся в кровеносном русле, освободившийся при этом НЬ адсорбируется в крови гаптоглобином и транспортируется в печень, где распадается по вышеуказанной схеме.
В клетках РЭС НЬ вначале окисляется под действием гем-оксигеназы до вердоглобина (зеленого цвета). Последний спонтанно (самопроизвольно) распадается на свои составные части: глобин, Fe3+ и оставшуюся часть гема-биливердин (пигмент зеленого цвета). Глобин гидролизуется до аминокислот. Fe3+ захватывается трансферрином и кровью доставляется в печень, где освобождается от белка-переносчика и откладывается про запас в виде ферритина (соединение Fe с особым белком). Этот комплекс по мере надобности распадается, Fe вновь адсорбируется трансферрином, доставляется в клетки, где участвует в синтезе НЬ, цитохромов и пр.
Биливердин восстанавливается в билирубин— пигмент желто-красного цвета, который является водонерастворимым и весьма токсичным веществом. Поэтому он быстро выводится из клеток РЭС, поступает в кровь, где адсорбируется альбумином, образуя растворимый в воде и нетоксичный комплекс, называемый свободным билирубином (непрямым). Он транспортируется в печень, где распадается и билирубин попадает в гепатоциты.
есь он взаимодействует с активной формой глюкуроновой кислоты (УДФКГ) с образованием моно- и диглюкуронидбилирубина, являющегося нетоксичным иводорастворимым соединением, называемым связанным билирубином(прямым). Связанный билирубин поступает в желчный пузырь, входит в состав желчных пигментов, выделяется с желчью в кишечник, где от него отщепляется глюкуроновая кислота. Освободившийся билирубин подвергается воздействию ферментов микроорганизмов с образованием мезобилиногена, азатем – стсркобилиногена,который окисляетсякислородом воздухадо стеркобилинаи выводится с калом.Небольшая часть мезобилиногена всасывается в кровь и по воротной вене доставляется в печень, где расщепляется до диперролов (2 пиррольных кольца), которые задерживаются печенью ине поступают в общий кровоток. Большая же часть мезобилиногена, превратившаяся в стеркобилиноген, в нижних отделах толстой кишки всасывается в кровь и через геморроидальные вены попадает в систему большого круга кровообращения, а затем выводится с мочой в виде уробилиногена,окисляющегося на воздухе в уробилин.
Таков в обших чертах основной путь распада НЬ.
Но для нормальной жизнедеятельности организма постоянно требуется определенное количество НЬ, синтез которого осуществляется по следующей схеме.

Источник: megaobuchalka.ru
Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выводится избыток азота. Экскреция мочевины в норме около 25 г/сут.. Синтезируется только в печени. Катаболизм аминокислот и образование аммиака происходят во многих тканях. Для транспорта азота из тканей в печень используются 3 соединения: глутамин, аланин и аммиак.
Орнитиновый цикл (цикл Кребса-Гензелейта)в печени выполняет 2 функции:
— превращение азота аминокислот в мочевину ( которая экскретируется и предотвращает накопление токсичных продуктов — аммиака)
— синтез аргинина и пополнение его фонда в организме
Полный набор ферментов орнитинового цикла есть только в гепатоцитах.
В образовании 1 моля мочевины участвуют 1 моль NH4+, 1 моль СО2 (активируемой Mg2+ и ATP) и 1моль α-аминного азота аспартата. В ходе синтеза потребляются 3 моля ATP (2 из них превращаются в ADP и Pi, а третий – в AMP и PPi), в нем последовательно участвуют 5 ферментов. Аминокислоты аспартат, аргинин, орнитин, циртуллин и аргининосукцинат служат переносчиками атомов, которые в итоге образуют молекулу мочевины. В синтез мочевины также вовлекается аминокислота N-ацетилглутамат, она служит активатором одного из ферментов и в химических превращениях не участвует.
Образование мочевины является частично циклическим процессом. Орнитин (участвующий во 2й реакций) регенерируется в ходе 5й реакции. Т.о. ни потерь, ни накопления орнитина, цитруллина, аргиниосукцината и аргинина в ходе синтеза не происходит – потребляются только ион аммония, СО2, ATP и аспартат.

Реакция 1: синтез карбомоилфосфата. Конденсация аммония, СО2 и фосфата (поступает от ATP), приводящая к образованию карбамоилфосфата. Фермент карбамоилфосфатсинтаза находится в митохондриях печени. В ходе реакции осуществляется гидролиз 2ATP, обеспечивающий энергией образование 2х ковалентных связей (амидной и ангидридной при образовании карбамоилфосфата из карбоновой и фосфорной кислот). Для данной реакции требуются ионы Mg2+ и дикарбоновая кислота (предпочтительно N-ацетилглутамат). В присутствии этих соединений происходят конформационные изменения карбамоилфосфатсинтазы и увеличивается сродство фермента к ATP. 
Реакция 2: синтез цитруллина. Перенос карбамоильной группы с карбамоилфосфата на орнитин с образованием цитруллина и Pi. Фермент орнитин-карбамоил-трансфераза находится
в митохондриях печени.

Реакция 3: синтез аргининосукцината. К цитруллину присоединяется аминогруппа аспартат. Фермент аргинино-сукцинат-синтаза. Для реакции требуется ATP. Реакция идет в цитозоле.

Реакция 4: расщепление аргининосукцината на аргинин и фумарат. Фермент аргининосукцинат-лиаза. Реакция транс-элиминирования. Образовавшийся фумарат может превратиться в оксалоацетат (малат-дегидрогеназа), оксалоацетат при переаминировании превращается в аспартат.
Реакция 5: расщепление аргинина на орнитин и мочевину. Эта реакция завершает цикл мочевины и регенерирует орнитин (субстрат 2й реакции). Фермент аргиназа катализирует гидролитическое отщепление гуанидиновой группы аргинина. Аргиназа из печени активируется ионами Са2+ или Mn2+. Сильными ингибиторами фермента являются орнитин и лизин, конкурирующие в аргинином.

Суммарное уравнение синтеза мочевины:
СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + H4P2O7.
Источник: biohimist.ru
Срок исполнения
Один рабочий день.
Что может повлиять на результаты
Большое количество принимаемых лекарств влияет на уровень мочевины (особенно его повышают цефалоспорины, цисплатин, аспирин, тетрациклины, тиазидные диуретики).
На концентрацию мочевины может влиять количество белков, потребляемых человеком. В среднем, за сутки в организме образуется до 30 грамм мочевины из каждых 100 граммов белка.
В норме у детей и женщин уровень мочевины несколько ниже из-за меньшей мышечной массы, чем у мужчин. Снижение уровня данного показателя происходит во время беременности из-за увеличения объема крови. У детей раннего возраста в связи с повышенным синтезом белка уровень мочевины несколько снижен.
У пожилых людей уровень мочевины в крови может повышаться из-за неспособности почек адекватно поддерживать плотность мочи.
Повышение показателей мочевины может наблюдаться на фоне голодания и чрезмерных физических нагрузок.
Мочевина в крови (Диамид угольной кислоты, карбамид, Urea nitrogen, Urea, Blood Urea Nitrogen (BUN), Urea, Plasma Urea)
Кровь для исследования берется из вены.
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Нормальные показатели
Единицы измерения: ммоль/л.
Референсные значения:
| Возраст | Уровень мочевины, ммоль/л |
| 1 день — 30 дней | 1,4-4,3 |
| 1 мес. – 18 лет | 1,8-6,4 |
| 18 лет – 60 лет | 2,1-7,1 |
| > 60 лет | 2,9-8,2 |
Расшифровка показателей
Норма активности фермента в результатах анализа зависит от многих факторов, в особенности от пола и возраста человека.
Что значат повышенные показатели
- Среди причин повышения содержания мочевины в крови выделяют накопление (ретенцию) продуктов метаболизма в организме вследствие нарушения работы выделительной системы.
- Внепочечная ретенционная азотемия — нарушение почечной гемодинамики, снижение объема циркулирующей крови и, как результат, недостаточное кровоснабжение почек.
- Продукционная азотемия — усиленный распад тканей (гиперкатаболизм белков). Высокое содержание мочевины в крови является результатом патологических процессов, связанных с увеличением скорости и избыточным количеством распада белков в организме.
Основные клинические причины повышенных уровня мочевины в крови:
- хронические заболевания почек и состояния, связанные с задержкой выведения мочи (пиелонефрит, гломерулонефрит, амилоидоз, мочекаменная болезнь, опухоли почек и острая почечная недостаточность любого происхождения, аденома простаты);
- заболевания других органов (сахарный диабет, острая или хроническая сердечная недостаточность, кардиомиопатии, артериальная гипертония, туберкулез, ревматоидный артрит и др.);
- различные воспалительные и септические процессы, сопровождающиеся усиленным распадом белков, травматическое повреждение скелетных мышц, стресс, обширные ожоги, длительная диарея и рвота;
- кровотечение из верхних отделов ЖКТ (язвенная болезнь желудка, двенадцатиперстной кишки, рак желудка, двенадцатиперстной кишки и др.);
- гематологические болезни (лейкозы, лейкемия, злокачественная форма анемии, гемолитическая желтуха);
- тяжелые инфекции, в том числе, кишечные (дизентерия, брюшной тиф, холера);
- прием нефротоксичных препаратов, глюкокортикоидов, андрогенов.
Что значат пониженные показатели
Уровень мочевины в крови снижается при многих заболеваниях печени. Это происходит из-за неспособности поврежденных клеток печени синтезировать мочевину, что, в свою очередь, ведет к повышению концентрации аммиака в крови и развитию печеночной энцефалопатии.
Пониженные показатели могут свидетельствовать о следующих заболеваниях и состояниях:
- печеночная недостаточность, гепатит, цирроз, острая гепатодистрофия, опухоли печени, печеночная кома, отравления гепатотоксичными ядами (фосфором, мышьяком), передозировки лекарственных средств;
- акромегалия (гормональное заболевание, характеризующееся повышенной выработкой соматотропного гормона);
- голодание, вегетарианская низкобелковая диета;
- нарушение кишечного всасывания (мальабсорбция), например, при целиакии;
- нефротический синдром (повышенное выделение белка с мочой, гиперлипидемия, снижение уровня белка в крови);
- повышенная выработка антидиуретического гормона и, как следствие, патологическая гиперволемия (увеличение объема циркулирующей крови);
- состояние после диализа;
- гипергидратация.
Источник: www.invitro.ru
Исторические сведения
Впервые была обнаружена в моче. Особое значение мочевине в истории органической химии придал факт её синтеза из неорганических веществ Фридрихом Вёлером в 1828 году:
Это превращение является первым синтезом органического соединения из неорганического. Вёлер получил мочевину нагревом цианата аммония, полученного реакцией взаимодействия цианата калия с сульфатом аммония. Это событие нанесло первый удар по витализму — учению о жизненной силе.
Свойства и реакционная способность
Физические свойства
Бесцветные кристаллы без запаха, кристаллическая решётка тетрагональная сингония (а = 0,566 нм, b = 0,4712 нм, c = 2); претерпевает полиморфные превращения кристаллов.
Мочевина хорошо растворима в полярных растворителях (воде, жидком аммиаке и сернистом ангидриде), при снижении полярности растворителя растворимость падает. Мочевина нерастворима в неполярных растворителях (алканах, хлороформе).
Растворимость (г в 100 г растворителя):
- в воде — 108 (20 °C)
- в жидком аммиаке — 49,2 (20 °C, 709 кПа), 90 (100 °C, 1267 кПа);
- в метаноле — 22 (20 °C);
- в этаноле — 5,4 (20 °C);
- в изопропаноле — 2,6 (20 °C);
- в изобутаноле — 6,2 (20 °C);
- в этилацетате — 0,08 (25 °C);
- в хлороформе — ~0 (не растворяется).
Нуклеофильность
Реакционная способность мочевины типична для амидов: оба атома азота являются нуклеофилами, то есть мочевина образует соли с сильными кислотами, нитрование с образованием N-нитромочевины, галогенируется с образованием N-галогенпроизводных. Мочевина алкилируется, образуя соответствующие N-алкилмочевины RNHCONH2, взаимодействует с альдегидами, образуя производные 1-аминоспиртов RC(OH)NHCONH2.
В жёстких условиях мочевина ацилируется хлорангидридами карбоновых кислот с образованием уреидов (N-ацилмочевин):
-
- RCOCl + H2NCONH2 ⟶ RCONHCONH2 + HCl.
Взаимодействие мочевины с дикарбоновыми кислотами и их производными (сложными эфирами и т. п.) ведёт к образованию циклических уреидов и широко используется в синтезе гетероциклических соединений; так, взаимодействие с щавелевой кислотой ведёт к парабановой кислоте, а реакция с эфирами замещённых малоновых кислот — к 1,3,5-триоксипиримидинам — производным барбитурата, широко применявшимся в качестве снотворных препаратов:
В водном растворе мочевина гидролизуется с образованием аммиака и углекислого газа, что обуславливает её применения в качестве минерального удобрения.
Электрофильность
Карбонильный атом углерода в мочевине слабоэлектрофилен, однако спирты способны вытеснять из мочевины аммиак, образуя уретаны:
-
- H2NCONH2 + ROH ⟶ H2NCOOR + NH3.
К этому же классу реакций относится взаимодействие мочевины с аминами, ведущее к образованию алкилмочевин:
-
- RNH2 + H2NCONH2 ⟶ RNHCONH2 + NH3.
и реакция с гидразином с образованием семикарбазида:
-
- H2NNH2 + H2NCONH2 ⟶ H2NNHCONH2 + NH3
образование при нагревании биурета H2NCONHCONH2.
Комплексообразование
Мочевина образует комплексы — включения (клатраты) со многими соединениями, например с перекисью водорода CO(NH2)2 ⋅ H2O2, используемой как удобная и безопасная форма «сухого» пероксида водорода (гидроперит). Способность мочевины образовывать комплексы включения с алканами используется для депарафинизации нефти. Причём мочевина образует комплексы только с Н-алканами, ибо разветвлённые углеводородные цепи не могут пройти в цилиндрические каналы кристаллов мочевины.
Недавно обнаружена способность мочевины образовывать глубокоэвтектические растворы при смешении с хлоридом холина, хлоридом цинка и некоторыми другими веществами. Такие смеси имеют температуру плавления заметно ниже по сравнению с исходными веществами (часто даже ниже комнатной температуры).
Источник: chem.ru
Мочевина
Мочевина является главным конечным продуктом обмена аминокислот. Синтезируется мочевина из аммиака, который постоянно образуется в организме при окислительном и неокислительном дезаминировании аминокислот, при гидролизе амидов глутаминовой и аспарагиновой кислот, а также при распаде пуриновых и пиримидиновых нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего — на центральную нервную систему. Несмотря на то, что аммиак постоянно продуцируется в тканях, он содержится в периферической крови лишь в следовых количествах, так как быстро удаляется из кровеносной системы печенью, где входит в состав глутамата, глутамина и мочевины. Биосинтез мочевины является основным механизмом обезвреживания аммиака в организме.
Биосинтез мочевины
Синтез мочевины происходит в печени в цикле Кребса-Гензелейта (другое название — орнитиновый цикл мочевинообразования Кребса) в несколько этапов с участием ряда ферментных систем. Синтез сопровождается поглощением энергии, источником которой является АТФ.
Весь цикл мочевинообразования можно представить следующим образом:
На первом этапе синтезируется карбамоилфосфат в результате конденсации ионов аммония, двуокиси углерода и фосфата (поступающего из АТФ) под действием фермента карбамоилсинтетазы. Карбамоилфосфат — это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза ряда других азотистых соединений.
На втором этапе мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитинкарбамоилтрансфераза.
На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозависимая, сводится к конденсации цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинатсинтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента — аргининосукцинатлиазы.
На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменении количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.) также сопровождаются активацией орнитинового цикла.
Источник: online.zakon.kz

