Топография дуги аорты. Синтопия дуги аорты. Ветви дуги аорты.
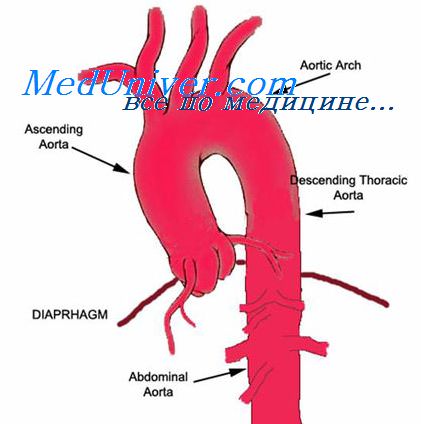
Дуга аорты, arcus aortae, является продолжением расположенной внутриперикардиально восходящей аорты, aorta ascendens. Дуга аорты начинается на уровне прикрепления хряща II ребра к левому краю грудины. Высшая точка дуги аорты проецируется на центр рукоятки грудины. От верхней полуокружности дуги аорты позади левой плечеголовной вены кверху отходят крупные ветви: плечеголовной ствол, левая общая сонная и левая подключичная артерии.
Начальный (правый) и конечный (левый) отделы дуги аорты прикрыты спереди средостенными частями париетальной плевры и плевральными реберно-средостенными синусами. Сверху и частично спереди от дуги аорты проходит левая плечеголовная вена. Справа от начальной части дуги аорты располагается верхняя полая вена. Средний отдел дуги аорты спереди прикрыт остатками тимуса и жировой клетчаткой с плечеголовными лимфатическими узлами. Переднюю поверхность дуги слева косо пересекает левый блуждающий нерв, от которого на уровне нижнего края дуги отходит левый возвратный гортанный нерв, n. laryngeus recurrens, огибающий дугу аорты снизу и сзади. Кнаружи от блуждающего нерва на переднелевой поверхности дуги аорты расположены левый диафрагмальный нерв и сопровождающие его vasa pericardiacophrenica (перикардиально-диафрагмальные сосуды).
На передненижней поверхности дуги аорты напротив отхождения от ее верхней поверхности левой подключичной артерии находится место прикрепления артериальной связки, lig. arteriosum, представляющей облитерированный (заращение) артериальный (боталлов [Botallo]*) проток. У плода он связывает легочный ствол с аортой.
*К моменту рождения ребенка проток обычно зарастает, замещаясь артериальной связкой. У части детей такого заращения не происходит, и возникает порок сердца — незаращенный боталлов проток. Ориентиром при доступе к незаращенному протоку с целью его перевязки является левый диафрагмальный нерв, который проходит на 1—2 см кпереди от артериальной связки. Здесь же располагается боталлов лимфатический узел артериальной связки.
Задняя поверхность дуги аорты соприкасается с передней поверхностью трахеи, образуя на ней небольшое вдавление. Немного левее, на уровне перехода дуги аорты в нисходящую аорту, позади нее расположен пищевод. Между трахеей и пищеводом позади дуги аорты лежит возвратный гортанный нерв, а у левого края пищевода — ductus thoracicus.
Снизу и позади дуги аорты справа проходит правая легочная артерия по направлению к воротам правого легкого. Участок аорты от места отхождения левой подключичной артерии до перехода в нисходящую аорту называется перешейком аорты*.
*В этом месте может происходить сужение аорты, называемое коарктацией. Чаще всего коарктация является врожденной. При этом пороке нижняя половина тела кровоснабжается недостаточно, а ветви дуги аорты расширяются. Через систему подключичных артерий возникает коллатеральный кровоток. Главную роль при этом играют a. thoracica interna и отходящие от нее передние межреберные артерии, а также a. thoracica lateralis. Коарктация аорты в настоящее время успешно устраняется хирургическим путем.
Место перехода дуги аорты в нисходящий ее отдел проецируется слева на уровне IV грудного позвонка. В этом месте дуга аорты огибает начальную часть левого бронха спереди назад и справа налево. В окружности дуги аорты и ниже нее расположены аортально-сердечные нервные сплетения, образованные ветвями обоих блуждающих нервов и обоих стволов симпатического нерва.
Различаются следующие типы деформации дуги аорты: I. По топографоанатомическому типу
1) Правосторонняя дуга аорты;
— Правосторонняя дуга аорты с левосторонней нисходящей аортой;
— Правосторонняя дуга аорты с правосторонней нисходящей аортой и с дивертикулом аорты;
2) Двойная дуга аорты. II. По виду деформации: 1) удлинение (шейная дуга аорты); 2) извитость (кинкинг) аорты; — петле- и кольцеобразование; — перегиб;
3)Гипоплазия дуги аорты: суженная аорта (aorta angusta);
4)Отсутствие дуги аорты.
III. Варианты ветвления аорты.
1) Плечеголовной ствол отсутствует;
2) Левый плечеголовной ствол, с отсутствием правого;
3) Правый и левый плечеголовной ствол.
4) Правая и левая общие сонные артерии отходят одним стволом.
I. 1)Правосторонняя дуга аорты.
Правосторонняя дуга аорты — аномалия, при которой она перекидывается через правый главный бронх; грудная аорта при этом располагается справа от позвоночника.
Дуга аорты поворачивается вправо, а над правым главным бронхом поворачивается обратно за сердце. Или же она до конца проходит по правой стороне позвоночника и только на уровне диафрагмы переходит на левую сторону или же у более высокого грудного сегмента перекрещивает позвоночник.
Эта аномалия развития возникает таким образом, что артерия левой IV-ой жаберной дуги, из которой при нормальном развитии возникает дуга аорты, атрофируется, и вместо нее дуга аорты образуется артерией правой IV-ой жаберной дуги.
ходящие от нее сосуды берут начало в обратном порядке по сравнению с нормой. Приблизительно в 25% случаев эта аномалия развития присоединяется к тетралогии Фаллота. Сама по себе она не влияет на кровообращение, не вызывает клинических симптомов. Диагноз имеет значение с точки зрения операции при комбинированных аномалиях развития. В младенческом возрасте рентгенологическим исследованием эта аномалия развития более трудно определяется, а в детском возрасте легко. При помощи ангиокардиографии положение дуги аорты и нисходящей аорты может быть хорошо выявлено.
Есть также:
Правосторонняя дуга аорты с левосторонней нисходящей аортой.
Дуга аорты образуется от артерии правой IV-ой жаберной дуги, но образующийся из артерии левой VI-ой жаберной дуги Боталлов проток или подключичная артерия, отходящая от нисходящей аорты, перед позвоночником между пищеводом и трахеей резким перегибом перетягивает сосуд на левую сторону. Дуга аорты перегибается за пищеводом на левую сторону, расширяет срединную тень и образует сзади на пищеводе глубокое вдавление, хорошо видимое в обоих косых положениях.
Правосторонняя дуга аорты с правосторонней нисходящей аортой и с дивертикулом аорты.
Наряду с правосторонней дугой аорты и с нисходящей аортой, сохраняется рудиментарный левосторонний корень аорты, от которого отходит подключичная артерия. Дивертикул находится за пищеводом и образует на его задней поверхности глубокое вдавление. Если он выходит за пищевод, то при сагиттальном исследовании проявляется в форме медиастинальной тени с границей, выпуклой вправо.
Источник: studfile.net
Аномалии хода и разветвлений аорты [ править | править код ]
| Врожденные аномалии аорты | |
|---|---|
| МКБ-10 | Q 25.4 25.4 |
В процессе эмбриогенеза у плода развиваются вентральная и дорсальная аорты, соединенные между собой сосудистыми дугами, которые в процессе формирования сосудов образуют артерии или исчезают. Аномалии развития могут включать в себя нарушение положения, размера, формы, хода, соотношения и непрерывности артериальных сосудов. Выделяют пять типов: двойная дуга аорты, правосторонняя дуга аорты, правосторонняя дуга аорты с дополнительной ветвью, левосторонняя дуга аорты с абнормальной ветвью и шейный тип анатомического расположения дуги аорты. Частота встречаемости таких аномалий составляет от 1 до 3,8 % от всех врожденных пороков сердечно-сосудистой системы [1] .
Когда артерия образуется из правой IV жаберной дуги, а левая артерия IV жаберной дуги атрофируется, то дуга аорты поворачивает вправо, а затем поворачивает обратно за сердце над правым главным бронхом или на уровне диафрагмы. При таком положении выходящие сосуды начинаются в обратном (зеркальном) порядке по сравнению с нормой. Часто данный порок связан тетрадой Фалло.
Существует несколько классификаций данной аномалии, которые учитывают расположение сосудов (обычное или зеркальное), расположение абберантной подключичной артерии (правое или левое), изоляцию подключичной артерии, наличие и расположение артериальных протоков [3] .
В случае, когда в эмбриогенезе сохраняются артерии правой и левой IV жаберных дуг, образовавшиеся из них два сосуда кольцеобразно обхватывают пищевод и трахею и за ними соединяются в нисходящую аорту. Как правило, в таком случае одна дуга тоньше другой или же сохраняется частично.
- Левостороннее отхождение правой подключичной артерии
Правая подключичная артерия может отходить слева от аорты или от её дивертикула, поворачивает направо между VI шейным и IV грудным позвонками над аортой и за пищеводом, располагаясь между пищеводом и трахеей.
Возможны такие деформации как: удлинение, извитость, кольцеобразование, петлеобразование, перегиб аорты. Редкая аномалия дуги аорты, связанная с патологическим строением стенки аорты. В литературе встречается как: кинкинг дуги аорты, псевдокоарктация аорты, атипичная коарктация, субклиническая коарктация, баклинг дуги аорты, мегааорта [6] .
- Перерыв дуги аорты (атрезия дуги аорты, атипичная коарктация) [7]
Один из сегментов дуги аорты отсутствует, нарушается непрерывность, отсутствует сообщение между восходящей и нисходящей отделами аорты, артериальный проток сохраняется и связывает ствол легочной артерии с отдельной нисходящей аортой.
Различаются следующие типы деформации дуги аорты: I. По топографоанатомическому типу
1) Правосторонняя дуга аорты;
— Правосторонняя дуга аорты с левосторонней нисходящей аортой;
— Правосторонняя дуга аорты с правосторонней нисходящей аортой и с дивертикулом аорты;
2) Двойная дуга аорты. II. По виду деформации: 1) удлинение (шейная дуга аорты); 2) извитость (кинкинг) аорты; — петле- и кольцеобразование; — перегиб;
3)Гипоплазия дуги аорты: суженная аорта (aorta angusta);
4)Отсутствие дуги аорты.
III. Варианты ветвления аорты.
1) Плечеголовной ствол отсутствует;
2) Левый плечеголовной ствол, с отсутствием правого;
3) Правый и левый плечеголовной ствол.
4) Правая и левая общие сонные артерии отходят одним стволом.
Правосторонняя дуга аорты — аномалия, при которой она перекидывается через правый главный бронх; грудная аорта при этом располагается справа от позвоночника.
Дуга аорты поворачивается вправо, а над правым главным бронхом поворачивается обратно за сердце. Или же она до конца проходит по правой стороне позвоночника и только на уровне диафрагмы переходит на левую сторону или же у более высокого грудного сегмента перекрещивает позвоночник.
Эта аномалия развития возникает таким образом, что артерия левой IV-ой жаберной дуги, из которой при нормальном развитии возникает дуга аорты, атрофируется, и вместо нее дуга аорты образуется артерией правой IV-ой жаберной дуги. Отходящие от нее сосуды берут начало в обратном порядке по сравнению с нормой. Приблизительно в 25% случаев эта аномалия развития присоединяется к тетралогии Фаллота. Сама по себе она не влияет на кровообращение, не вызывает клинических симптомов. Диагноз имеет значение с точки зрения операции при комбинированных аномалиях развития. В младенческом возрасте рентгенологическим исследованием эта аномалия развития более трудно определяется, а в детском возрасте легко. При помощи ангиокардиографии положение дуги аорты и нисходящей аорты может быть хорошо выявлено.
Правосторонняя дуга аорты с левосторонней нисходящей аортой.
Дуга аорты образуется от артерии правой IV-ой жаберной дуги, но образующийся из артерии левой VI-ой жаберной дуги Боталлов проток или подключичная артерия, отходящая от нисходящей аорты, перед позвоночником между пищеводом и трахеей резким перегибом перетягивает сосуд на левую сторону. Дуга аорты перегибается за пищеводом на левую сторону, расширяет срединную тень и образует сзади на пищеводе глубокое вдавление, хорошо видимое в обоих косых положениях.
Правосторонняя дуга аорты с правосторонней нисходящей аортой и с дивертикулом аорты.
Наряду с правосторонней дугой аорты и с нисходящей аортой, сохраняется рудиментарный левосторонний корень аорты, от которого отходит подключичная артерия. Дивертикул находится за пищеводом и образует на его задней поверхности глубокое вдавление. Если он выходит за пищевод, то при сагиттальном исследовании проявляется в форме медиастинальной тени с границей, выпуклой вправо.
Теперь мы можем рассмотреть наиболее важные аномалии, захватывающие дериваты дуг аорты. При сохранении правой и левой четвертых дуг и корней дорзальной аорты возникает дефект, обычно называемый аортальным кольцом. С укорочением верхних сегментов аорты это кольцо охватывает трахею и пищевод настолько тесно, что приводит к нарушению глотания и часто требует хирургического вмешательства, направленного на прекращение давления, оказываемого кольцом.
Обычно при этом производится перевязывание одной из дуг. Если, как это нередко бывает, одна из дуг оказывается значительно меньше другой, операция не представляет затруднений.
Одним из наиболее частых клинически важных уклонений в строении дуги аорты является аномалия, при которой правая подключичная артерия отходит от дуги аорты. При этом сохраняется сегмент правого корня дорзальной аорты, расположенного каудальнее места отхождения подключичной артерии, а не четвертой дуги аорты и части корня дорзальной аорты, находящейся краниальнее места отхождения этой артерии.
После смещения мест отхождения подключичных артерий в краниальном направлении, происходящего в результате каудального движения сердца и корней аорты, такая неправильно сформировавшаяся правая подключичная артерия в конце концов начинает отходить от дуги аорты. Так как ее проксимальная часть образуется из корня дорзальной аорты, то она должна пересечь среднюю линию дорзальнее пищевода. При этом она также может оказывать давление на пищевод, мешающее осуществлению акта глотания, хотя обычно эта аномалия приводит к менее тяжелым последствиям, чем в случае аортального кольца.
У лиц с отходящей таким образом от дуги аорты правой подключичной артерией возвратный нерв гортани проходит почти поперек от блуждающего нерва к области гортани. Он не имеет обычной петли, так как вместе с частью правой шестой дуги аорты, расположенной дистальнее места отхождения легочной артерии, правая четвертая дуга также исчезает, после того как подключичная артерия использует каудальный сегмент корня дорзальной аорты в качестве своей проксимальной части.
Другой серьезной аномалией в области дуги аорты является сохранение в качестве главного сосуда, проходящего к дорзальной аорте, правой четвертой дуги аорты и правого корня дорзальной аорты вместо левых. Само по себе такое расположение сосудов не создает функциональных осложнений, подобных тем, которые имеют место в вышеописанных случаях. Тем не менее возможность такого состояния следует учитывать при уточнении рентгенологических данных и при хирургических операциях в этой области.
Источник: 1poserdcu.ru
Аномалии дуги аорты являются редкими врожденными пороками сердца, они составляют 1–3% от всех сердечно-сосудистых патологий. При правосторонней аномалии дуги аорта берет свое начало от левого желудочка и поворачивается вправо перед спуском через средостение. Двусторонние аномалии дуги аорты являются комбинацией правосторонней и левосторонней дуг аорты. Такое дублирование часто образует сосудистое кольцо вокруг трахеи и/или пищевода, сжимающее их. Точно так же правосторонняя дуга аорты вместе с артериальной связкой (остатком артериального Боталлова протока) может вызывать сжатие структур средостения путем сжимания аорты. Таким образом, обе аномалии могут привести к стридору, кашлю, одышке, дисфагии и рецидивирующим инфекциям нижних дыхательных путей. Согласно литературным данным, 94% случаев симптоматической аномалии дуги аорты успешно лечатся при помощи хирургической коррекции, но хирургическое лечение необходимо проводить на ранних этапах выявления аномалии, т. е. в младенческом возрасте.
Аномалия дуги аорты у плода может быть обнаружена с помощью ультразвука уже на 12-й неделе гестационного возраста. Послеродовой диагноз может быть определен с помощью эхокардиографии (ЭхоКГ), магнитно-резонансной томографии (МРТ) или компьютерной томографии (КТ). ЭхоКГ позволяет визуализировать крупные сосуды, при этом косвенными методами визуализации (глотание с бариевой взвесью) выявляется обструкция дыхательных путей. КТ или МРТ связаны с высокими дозами облучения, поэтому исследователи предлагают применять такой вид диагностики, как тестирование функции легких (ТФЛ), который является неинвазивным, нерадиационным тестом для диагностики и мониторинга прогрессирования обструкции дыхательных путей у пациентов с аномалией дуги аорты. Тем не менее, возможно, из-за отсутствия систематических исследований, данных об использовании с помощью ТФЛ у детей с аномалией дуги аорты недостаточно. В связи с этим было проведено исследование эффективности применения ТФЛ с участием новорожденных с аномалией дуги аорты.
Проведение ТФЛ в неонатальном периоде было одобрено Комитетом по этике больницы Шарите г. Берлина. Это ретроспективное исследование было проведено в специализированном Медицинском центре врожденных аномалий. В исследование были включены выжившие новорожденные с пренатально диагностированной аномалией дуги аорты, рожденные в 2005–2011 гг. После рождения детей помещали в отделение интенсивной терапии для наблюдения сердечных или респираторных симптомов и дальнейшей диагностики путем ЭхоКГ и ТФЛ в лаборатории. Пациенты, имевшие симптомы активной инфекции дыхательных путей или перенесшие ее в течение 2 недель до запланированного ТФЛ, не обследовались. Перед тестированием измерялись масса тела ребенка по стандартной цифровой шкале и длина тела от макушки до пятки. До исследования младенцы получали хлоралгидрат в дозе 50 мг/кг перорально за 30–60 мин до ТФЛ. Спящие младенцы были измерены в положении лежа на спине с шеей в нейтральном положении, при поддержке специального ролика. Три независимых ТФЛ были проведены для определения наличия препятствия в дыхательных путях: форма потока воздуха измерялась при вдохе и выдохе, также измерялись функциональная остаточная емкость при принудительном выдохе. Форма потока и объем воздуха во время вдохов измерялись по проточной методике, с помощью надетой на ребенка маски, которая во время исследования тщательно промывалась непрерывным фоновым потоком для исключения образования мертвого пространства, позволяя тем самым увеличивать длительность измерения объема потока воздуха. В зависимости от вариабельности графика дыхания были измерены 20–60 последовательных вдохов и рассчитан средний цикл дыхания (см. рис.).

Сопротивление дыхательных путей измерялось с помощью детской бодиплетизмографии. Было отмечено, что препятствия в верхних дыхательных путях вызывают увеличение сопротивления прохождения воздуха. Также была измерена функциональная остаточная емкость легких с помощью техники брюшного/грудного сжатия, которая была выражена стандартными показателями отклонений (Z-баллов), основанных на возрасте и поле. Во время исследования функции легких с помощью пульсоксиметрии непрерывно проводился мониторинг частоты сердечных сокращений и насыщения кислородом.
Характеристика пациентов и результаты ТФЛ были описаны медианами и диапазонами. Для сравнения младенцев с двусторонней и правосторонней аномалией дуги аорты был использован точный тест Фишера или тест Манна Уитни.
Таким образом, были проанализированы результаты обследования 17 пациентов (10 – с правосторонней аномалией дуги аорты, 7 – с двусторонней). Медиана у младенцев поствнутриутробного возраста в тесте была 40,3 (36,6–44,1) недель, средний вес тела составлял 3400 (2320–4665) г. При этом статистически значимой разницы между детьми с правосторонней и двусторонней аномалией дуги аорты не отмечалось при рождении или во время ТФЛ (см. табл).

ТФЛ проводилось на 40-й постконцептуальной неделе. Измерение объема воздуха при вдохе и выдохе показало более значительное ограничение воздуха у детей с двусторонней аномалией дуги аорты. Исследование показало, что большинство детей с аномалией дуги аорты имеют нормальные показатели теста ТФЛ в перспективе. Однако дети с двусторонней аномалией, так же как с правосторонней, относятся к группе повышенного риска обструкции дыхательных путей, что позволяет выявить раннее ТФЛ. Риск обструкции дыхательных путей выше у детей с двусторонней аномалией дуги аорты. Ограничение потока воздуха при вдохе и выдохе в сочетании наблюдалось только у детей с двусторонней аномалией, у большинства из которых также было выявлено увеличение сопротивления дыхательных путей.
К настоящему времени проведено небольшое количество исследований достоверности ТФЛ, но есть все основания полагать, что данная процедура станет неотъемлемым этапом перед хирургическим лечением новорожденных. Ранее Томсон и др. сравнивали пред- и постоперационные результаты ТФЛ у шести детей с сосудистыми кольцами, также используя бодиплетизмографию. ТФЛ показало у всех младенцев наличие патологии и сжатие трахеи, у 4 пациентов наблюдалось снижение функциональной способности легких.
На сегодняшний день «золотым стандартом» для подтверждения диагноза аномалии дуги аорты является контрастная КТ или МРТ. Выполнение ТФЛ при аномалии дуги аорты имеет преимущество по сравнению с другими видами диагностики: метод является неинвазивным, без высокой нагрузки на организм, без излучения, менее затратный и не требует дорогостоящей аппаратуры.
Необходимость доработки ТФЛ определена тем, что у одного из пациентов с предоперационно диагностированной аномалией правой дуги аорты во время операции было обнаружено наличие двусторонней аномалии. Данный пациент имел давнюю историю более 3 клинических симптомов, связанных с аномалией дуги аорты, в том числе рецидивирующие инфекции дыхательных путей. В данном исследовании были использованы три ТФЛ, которые оценивали различные аспекты обструкции дыхательных путей. Они продемонстрировали ограничение потока воздуха, которое является предиктором обструкции дыхательных путей, позволяющим оценить механическую функцию легких.
Однако исследование с применением ТФЛ имеет ряд ограничений: аномалия дуги аорты является редкими заболеванием, и небольшое количество пациентов в данном исследовании ограничивает его статистическую значимость и увеличивает риск допущения ошибки второй степени. Отсутствие существенных различий сопротивления дыхательных путей и функциональной остаточной емкости легких между обеими группами пациентов (с правосторонней и двусторонней аномалией) может быть связана с высокой степенью изменчивости параметров функции легких. Кроме того, на сегодняшний день нет возрастного эталона допустимых значений сопротивления дыхательных путей, в основном потому, что эти значения зависят от метода измерения и от того, как развивается младенец.
Результатом исследования стало доказательство того, что обе группы пациентов, как с правосторонней, так и с двусторонней аномалией дуги аорты, имеют высокий риск обструкции дыхательных путей. ТФЛ позволяет на первых этапах, еще до проявления клинических симптомов, выявить заболевание и осуществлять мониторинг за данными пациентами, а также помочь в принятии решения относительно хирургического лечения младенцев с данным диагнозом.
www.plosone.org/article/ info%3Adoi%2F10.1371%2Fjournal. pone.0024903#pone-0024903-g001
Перевод с англ. Дарьи Никитенко
Источник: health-kz.com
Частота встречаемости, эмбриогенез и современная классификация аномалий дуги аорты
Частота аномалий дуги аорты составляет от 1 до 3,8% от всех врожденных пороков сердечно-сосудистой системы [53]. К аномалиям дуги аорты относятся: двойная дуга аорты, различные типы правой дуги аорты, а также атипичные варианты отхождения брахиоцефальных артерий при левой дуге аорты. Среди них наиболее часто встречается аберрантная правая подключичная артерия, которая регистрируется у 0,5% взрослых [75]. При этой аномалии правая подключичная артерия становится последней, четвертой ветвью дуги. Артерия идет вправо позади пищевода и создает неполное сосудистое кольцо вокруг трахеи и пищевода.
Правая дуга аорты – редкий вариант врожденной аномалии аорты, при котором дуга аорты располагается справа от трахеи. При этой ано- малии дуга аорты огибает правый главный бронх сверху и, изменяя направление вниз, проходит с правой стороны позвоночника, располагаясь справа от трахеи и пищевода (рис. 1).
У большей части пациентов изолированная правая дуга аорты и правосторонняя нисходящая грудная аорта не вызывают клинических симптомов в течение всей жизни. Поэтому истинная частота встречаемости правой дуги аорты точно установить не представляется возможным. Клинические проявления аномалий дуги аорты возникают в случае сочетания с другими врожденными пороками сердца и внутренних органов, а также при развитии осложнений со стороны трахеи и пище вода.
Согласно опубликованным данным, частота правой дуги аорты в общей популяции взрослых людей составляет около 0,1% и колеблется от 0,05% до 0,1% в рентгенологических сериях и от 0,04% до 0,1% в сериях патолоанатомических исследований [23, 55, 56].
Правая дуга аорты составляет менее 1% от всех пороков сердца и крупных сосудов, устраняемых с помощью хирургического вмешательства [64]. В Научном центре сердечно-сосудистой хирургии им. А.Н. Бакулева, где ежегодно проводятся сотни операций при врожденных пороках сердца, за 20-летний период (1991–2012 гг .) было проведено хирургическое лечение только у 60 пациентов с правой дугой аорты в возрасте от 3 до 62 лет [4].
Впервые правая дуга аорты была описана 250 лет назад G. Fioratti и F. Aglietti в 1763 г. Клинически значимую компрессию пищевода при правой дуге аорты описал D. Bayford в 1794 г. В 1818 г. Corvisartr представил описание правой дуги аорты в сочетании с тетрадой Фалло.
Первая прижизненная диагностика правой дуги аорты была проведена в 1924 г. H. Assmann. Учитывая, что правая дуга аорты может приводить к образованию сосудистых колец вокруг пищевода и трахеи, клинически в части случаев эта аномалия проявляется симптомами сдавления этих органов, т.е. дисфагией и дисфонией. Впервые объяснение этой загадочной дисфагии было дано только в 1936 г. рентгенологом B. Kommerell. B. Kommerell обратил внимание на пульсирующее образование в области дуги аорты, которое вызывало компрессию пищевода у 65-летнего мужчины, направленного на исследование с подозрением на рак желудка. Этим образованием был дивертикул аорты (остаток правой аортальной дуги, сформированной из 4-й правой аортальной дуги, подвергшейся р егрессии), от которого отходила правая аберрантная подключичная артерия. В 1945 г. R. Gross впервые предложил термин “сосудистое кольцо” и описал два классических варианта сосудистого кольца и доложил об успешном хирургическом устранении симптомов компрессии трахеи.
При двойной дуге аорты восходящая аорта переходит в две дуги – правую и левую. При этом правая дуга аорты располагается справа от трахеи и пищевода и перекидывается через правую легочную артерию и правый главный бронх. Левая дуга аорты, расположенная слева от пищевода и трахеи, проделывает аналогичный путь, перебрасываясь через левую легочную артерию и левый бронх . Правая дуга аорты обычно шире и располагается выше левой. Сосудистое кольцо , часто малого диаметра, с возрастом уменьшается и вызывает компрессию трахеи сразу после рождения. Позади пищевода обе дуги сливаются, образуя нисходящую грудную аорту, которая может располагаться как справа, так и слева от позвоночника. Двойная дуга аорты впервые была описана W. Hommel в 1773 г.
Брахиоцефальные сосуды при двойной дуге аорты отходят о т-дельными четырьмя стволами: правые общая сонная и подключичная артерия – от правой дуги, левые – от левой (рис. 2). Возможны также и другие варианты отхождения брахиоцефальных сосудов при двойной дуге аорты.
При двойной дуге аорты формируется анатомически полное сосудистое кольцо – трахея и пищевод оказываются окруженными сосудистыми структурами со всех сторон [6]. Двойная дуга аорты обычно существует как изолированная аномалия, но может сочетаться с тетрадой Фалло, правосторонней нисходящей аортой, дефектами межпред-сердной и межжелудочковой перегородок, коарктацией аорты и транспозицией магистральных сосудов.
Основными клиническими проявлениями двойной дуги аорты являются: одышка, стридорозное дыхание, кашель, приступы удушья, рецидивирующая бронхопневмония, срыгивания и рвота, дисфагия и отставание в массе тела. Стридорозное дыхание – самый частый и достоверный признак этой аномалии. Дети принимают вынужденное пол о-жение на б оку, с запрокинутой назад головой.
Возможности пренатальной эхографии в дородовой диагностике правой и двойной дуги аорты
Основную группу составили 46 пациенток, у которых в ходе пренатального ультразвукового исследования у плода была диагностирована правая (n=40) или двойная (n=6) дуга аорты.
У всех беременных проводился сбор соматического и акушерско-гинекологического анамнеза. Возраст пациенток, у которых была обнаружена правая или двойная дуга аорты у плода, варьировал от 20 до 42 лет и в среднем составил 27,4 года. У 89,1% женщин возраст был до 35 лет, у 10,9% – 35 лет и более (табл. 2).
Срок беременности определяли от первого дня последней менструации, так как у всех пациенток был регулярный менструальный цикл. Первородящих женщин было 29 (63%), повторнородящих – 17 (37%). Анализ акушерского анамнеза показал, что среди обследованных пациенток основной группы 41,3% были первобеременными, 25% – по-вторнобеременными, но первородящими; 37% – повторнородящими (табл. 3).
Срочные роды с благоприятным исходом были отмечены в 42 (91,3%) наблюдениях. Неблагоприятные исходы зафиксированы только в 4 случаях правой дуги аорты: 1) антенатальная гибель плода в 25 недель беременности с комбинированным врожденным пороком сердца и неиммунной водянкой; 2) прерывание беременности по медицинским показаниям в 24 недели беременности (комбинированный врожденный порок сердца с левопредсердной изомерией); 3) преждевременные роды в 30 недель и смерть в неонатальном периоде в случае spina bifida и ки-стозной гигромы у плода; 4) прерывание непланируемой беременности по желанию повторнородящей пациентки в 21 неделю.
Кроме этого в 2 случаях было проведено успешное оперативное лечение – мультикистозная дисплазия почки, тетрада Фалло. Случаев хромосомных аномалий в наших исследованиях зафиксировано не было.
Таким образом, неблагоприятные перинатальные исходы б ыли отмечены только в 8,7% случаев при правой и двойной дуге аорты преимущественно при наличии сочетанных пороков, что позволяет отнести эти аномалии без сочетания с другими пороками к прогностически благоприятным аномалиям.
Распределение по полу в случаях правой и двойной дуги аорты было представлено следующим образом: мальчики – 21, девочки – 25, соотношение (Ж:М) составило 1,19:1.
Масса 42 новорожденных, родившихся в доношенном сроке беременности, варьировала от 2500 до 4640 г, составив в среднем 3420,5 г, что соответствует современным популяционным данным.
В 2 случаях у плодов была зарегистрирована задержка внутриутробного роста – новорожденные в доношенном сроке родились массой 2500 и 2600 г. Однако вряд ли можно отнести правую и двойную дугу аорты к факторам риска задержки роста поскольку подавляющее большинство детей родились с нормальной массой тела и в 2 случаях зафиксирована масса новорожденных более 4 кг (табл. 5, 6). Таблица 5. Суммарные данные результатов обследования и перинатальных исходов в с лучаях пренатальной диагностики правой дуги аорты у плода.
Комплексное обследование, включающее тщательный сбор соматического и акушерско-гинекологического анамнеза, общее клиническое обследование и ультразвуковое исследование, проводилось у всех беременных. За всеми пациентками осуществлялось динамическое наблюдение. Были собраны данные об исходах родов, особенностях течения неонатального периода или патологоанатомического исследования.
Эхографические исследования проводились преимущественно на ультразвуковых аппаратах Voluson 730 Expert, Voluson Е6, Voluson E8 (GE) с использованием трансабдоминальных датчиков.
Итогом ультразвукового исследования во втором и третьем триместрах беременности являлся протокол, включающий в себя описание положения плода, его фетометрических параметров и их соответствия менструальному сроку беременности, а также оценку количества око-42 лоплодных вод, структуры, степени зрелости и расположение плаценты.
Полученные д анные фетометрии во втором триместре беременности сравнивались с нормативными значениями, разработанными под руководством М.В. Медведева [2].
Изучение ультразвуковой анатомии плода во втором триместре беременности проводилось по модифицированному протоколу [18], разработанному Российской ассоциацией врачей ультразвуковой ди агностики в перинатологии и гинекологии и утвержденному приказом МЗ и СР РФ №457 от 28.12.2000.
Согласно последним рекомендациям Российской ассоциацией врачей ультразвуковой диагностики в перинатологии и гинекологии [18] и Международного общества ультразвука в акушерстве и гинекологии (ISUOG) [35] в ходе каждого исследования проводилось ко м-плексное изучение сердца и главных сосудов, используя методику получения поперечных последовательных параллельных сечений четы-рехкамерного среза сердца, срезов через выходные тракты желудочков и среза через три сосуда и трахею (рис. 5). Получение изображения этих срезов достигалось при поперечном сканировании грудной клетки плода на разных уровнях. Заключительным, пятым срезом, который мы использовали, являлся срез через дугу аорты, который получали при сагиттальном сканировании.
Изучение четырехкамерного среза сердца плода проводили по схеме, предложенной М.В. Медведевым [15], последовательно отвечая на следующие вопросы: 1) занимает ли сердце плода нормальное расположение? 2) нормальные ли размеры сердца? 3) как располагается ось сердца? 4) одинаковые ли размеры предсердий и желудочков? 5) нет ли дефектов межжелудочковой перегородки? 6) занимают ли атри-овентрикулярные клапаны нормальное положение? 7) нет ли изменений эндокарда, миокарда и перикарда? 8) располагается ли нисходящая аор-43
Перинатальные исходы при правой и двойной дуге аорты
Для оценки диагностических возможностей технологии STIC (Spatioemporal Image Correlation) нами проведено изучение главных сосудов у 3 плодов с двойной дугой аорты и у 9 плодов с правой дугой аорты. Этот метод исследования сердца плода создан на базе объемной эхографии и позволяет синхронизировать пространственное и временное разрешение, т.е. объемное изображение движущихся структур сердца плода в забираемом объеме.
В результате сложной компьютерной обработки формируется один полный сердечный цикл. STIC представляет собой не технологию сканирования, а методику постобработки д анных, полученных в режиме объемной эхографии.
В ходе проведенных нами исследований было установлено, что преимущества этой технологии над обычным исследованием сердца плода з а-ключаются в получении серии его сечений и главных артерий в любой плоскости сканирования в пределах забранного объема в режиме реального времени, а также в режиме цветового допплеровского картирования, объемной реконструкции и inversion.
В качестве примера для более наглядного представления возможностей объемной эхографии приводим следующие клинические наблюдения сравнительного анализа технологии STIC и обычной серошкальной эхографии.
Наблюдение 1. Беременная А., 22 лет обратилась для проведения скри-нингового ультразвукового исследования в 20 недель беременности. В этом наблюдении правая дуга аорты была представлена редким вариантом расположения трахеи слева от «V»-образного слияния аорты и артериального протока, который был зарегистрирован в нашем исследовании только в 2 из 40 случаев этой аномалии. Поэтому оценка среза через три сосуда и трахею вызвала определенные затруднения как с выведением этого среза, так и с его интерпретацией. В связи с этим дополнительно была использована объемная эхография с применением технологии STIC и томографического режима, при котором четко была идентифицирована эта аномалия (рис. 34).
Томографический режим у плода с правой дугой аорты в 20 недель беременности. «У»-образное слияние аорты и артериального протока с расположением трахеи (стрелка) слева от этого слияния.
Наблюдение 2. Беременная К., 25 лет, также проходила скрининговое ультразвуковое исследование в 20 недель беременности. В этом наблюдении также была использована объемная эхография с томографическим режимом для окончательного установления пренатального диагноза правой дуги аорты с обычным «и»-образным соединением аорты и артериального протока с расположением трехеи между (рис. 35). Также в этом наблюдении для более наглядного представления выявленных изменений была применена объемная реконструкция сосудов при правой дуге аорты (рис. 36). В этой реконструкции наибольший интерес вызывает полученное изображение трахеи, проходящей между правой дугой аорты и легочной артерией, продолжающейся в артериальный проток. A -43 1 І — о mm 4 i4E НИ. ifp Ш Щ і j аИв BW виыь. J Ж3 v «Я»1″»» Рис. 35. Томографический режим у плода с правой дугой аорты в 20 недель беременности. «и»-образное слияние аорты и артериального протока с расположением трахеи (стрелка) между ними.
Объемная реконструкция сосудов у плода с правой дугой аорты в 20 недель беременности. «и»-образное слияние аорты и артериального протока с расположением трахеи (стрелка) между ними. Не менее важная диагностическая информация была получена нами при оценке сочетанных изменений сердечно-сосудистой системы плода при правой дуге аорты, чему свидетельство следующее клиническое наблюдение.
Наблюдение 3. Беременная Ш., 28 лет, обратилась для проведения скринингового ультразвукового исследования в 22–23 недели беременности. В ходе ультразвукового исследования у плода была выявлена левопредсерд-ная изомерия со сложным комбинированным врожденным пороком сердца, включая правую дугу аорты. Левопредсердная изомерия часто сопровождается перерывом нижней полой вены с продолжением в непарную вену, что удалось нам четко идентифицировать при использовании объемной реконструкции с применением режима цветового допплеровского картирования (рис. 37).
Рис. 37. Беременность 22–23 недели. Объемная реконструкция сосудов в режиме цветового допплеровского картирования у плода с комбинированным пороком сердца, левопредсердной изомерией и перерывом нижней полой вены с продолжением в непарную вену (синяя стрелка). Красной стрелкой указан грудной отдел нисходящей аорты плода. Не менее интересные данные были получены у плодов с двойной дугой аорты, особенно в случае нетипичного параллельного хода дуг аорты, когда при обычном сканировании не удалось установить окончательный диагноз.
Наблюдение 4. У пациентки М., 28 лет, при скрининговом ультразвуковом исследовании в 32 недели беременности было выявлено аномальное изображение среза через три сосуда — создавалось впечатление, что аорта имеет две дуги, идущие параллельно близко друг к другу. Для исключения двойной дуги аорты у плода было необходимо получить срез через, одновременно проходящий по продольной оси обеих дуг, но это оказалось невозможным из-за неудобного положения плода. Поперечное сечение его позвоночника располагалось на 3 часах. Поэтому была дополнительно использована объемная эхография, с помощью которой удалось получить необходимый срез (рис. 38) и осуществить построение объемной реконструкции дуг аорты плода в режиме inversion (рис. 39).
Сравнительный анализ применения объемной эхографии в сравнении с обычным серошкальным режимом показал, что из 12 случаев ее применения у плодов с аномалиями дуги аорты в 5 (41,6%) наблюдениях была получена важная дополнительная информация, позволившая установить окончательный пренатальный диагноз правой и двойной дуги аорты, а также сочетан-ных аномалий сердечно-сосудистой системы. Поэтому ее применение следует считать необходимым в случаях обнаружения у плода аномальных изображений среза через три сосуда и трахею. ГЛАВА 6.
Проведенные нами исследования убедительно продемонстрировали, что пренатальная диагностика правой и двойной дуги аорты может быть успешно осуществлена во втором и третьем триместрах беременности. В наших исследованиях пренатально было диагностировано 40 случаев правой дуги аорты и 6 наблюдений двойной дуги аорты. При этом основным срезом для установления пренатального диагноза аномалий дуги аорты является срез через три сосуда и трахею, который 10 лет назад был предложен М.В. Медведевым [16] в качестве обязательного компонента протокола скринин-гового ультразвукового исследования во втором триместре беременности для обеспечения пренатальной диагностики большинства врожденных пороков сердца. Аналогичные рекомендации в 2013 году были опубликованы ISUOG (Международное Общество Ультразвука в Акушерстве и Гинекологии) [35]. Соблюдение такого методического подхода к оценке сердца и главных артерий плода позволяет провести комплексное эхокардиографическое исследование и диагностировать до 80–90% всех клинически значимых врожденных пороков сердца.
Диагностические возможности пренатальной эхо -графии плода при двойной дуге аорты
В случаях двойной дуги аорты оценка четырехкамерного среза сердца не является действенной для идентификации плодов с двойной дугой аорты, поскольку аномальное расположения поперечного сечения грудного отдела нисходящей аорты и аномальное положение оси сердца были зарегистрированы нами только в 33,3% и 16,7% случаев соответственно.
Для оценки диагностических возможностей технологии STIC (Spatioemporal Image Correlation) нами проведено изучение главных сосудов у 3 плодов с двойной дугой аорты и у 9 плодов с правой дугой аорты.
В ходе проведенных нами исследований было установлено, что пр е-имущества этой технологии над обычным исследованием сердца плода з а-ключаются в получении серии его сечений и главных артерий в любой плоскости сканирования в пределах забранного объема в режиме реального времени, а также в режиме цветового допплеровского картирования, объемной реконструкции и inversion. При этом н е менее важная диагностическая и н-формация была получена нами при оценке сочетанных изменений сердечнососудистой системы плода при правой дуге аорты, особенно при перерыве нижней полой вены с продолжением кровотока по непарной вене.
Сравнительный анализ применения объемной эхографии в сравнении с обычным серошкальным режимом показал, что из 12 случаев ее применения у плодов с аномалиями дуги аорты в 5 (41,6%) наблюдениях была получена важная дополнительная информация, позволившая установить окончательный пренатальный диагноз правой и двойной дуги аорты, а также сочетан-ных аномалий сердечно-сосудистой системы. Поэтому ее применение следует считать необходимым в случаях обнаружения у плода аномальных изображений среза через три сосуда и трахею.
Обсуждая перинатальные исходы в случаях пренатальной ультразвуковой диагностики правой и двойной дуги аорты необходимо отметить, что в наших исследованиях они были зафиксированы только в 8,7%, что сопоставимо с ранее полученными результатами (таблица 12).
В представленных данных в таблице 12 отчетливо видна тенденция к снижению неблагоприятных исходов (прерывание беременности по медицинским показаниям в связи выявленными сочетанными пороками и хромосомными аномалиями, смерть в неонатальном периоде и в младенческом возрасте). По-видимому, это может быть обусловлено тем, что в первых исследованиях правая дуга аорты чаще диагностировалась при консультативных обследованиях после обнаружения других крупных пороков сердца и экстракардиальных аномалий, тогда как в последних исследованиях правая дуга аорты чаще выявлялась как изолированный порок при скрининговых ультразвуковых исследованиях. В наших исследованиях перинатальные потери были преимущественно обусловлены сочетанными пороками развития, а не наличием правой или двойной дуги аорты. ВЫВОДЫ
1. Пренатальная эхокардиография с использованием мультиплоскост-ного анализа является высоко информативным методом идентификации всех основных типов правой и двойной дуги аорты у плода при скрининговом ультразвуковом исследовании во втором и третьем триместрах беременности.
2. Изолированное изучение четырехкамерного среза сердца плода, преимущественно используемого при скрининговых ультразвуковых исследованиях во второй половине беременности, имеет существенные ограничения в обнаружении аномалий дуги аорты, за исключением оценки расположения поперечного сечения грудного отдела нисходящей аорты, изменение которого регистрируется в 95% случаев правой дуги аорты.
3. Наибольшими диагностическими возможностями в пренатальной ультразвуковой диагностике аномалий дуги аорты является срез через три сосуда и трахею. При этом диагностическими критериями правой дуги аорты у плода являются характерное «U»-образное слияние артериального протока и нисходящей аорты с локализацией трахеи между этими сосудами (95%) и «V»-образное слияние артериального протока и нисходящей аорты с распо ложением трахеи слева от этого соединения (5%). Диагностическими крите риями двойной дуги аорты у плода является идентификация характерного со судистого кольца (83,3%), образованного левой и правой дугами аорты с рас положением трахеи между этими сосудами, и параллельного хода дуг, между которыми визуализируется трахея (16,7%).
4. Объемная эхография с использованием технологии STIC имеет важ ное дополнительное значение у плодов с аномалиями дуги аорты и позволяет в случаях затрудненной интерпретации среза через три сосуда и трахею уста новить окончательный пренатальный диагноз как правой, так и двойной дуги аорты.
Источник: www.dslib.net
Об анатомии и топографии
Аорта – основной ствол артерий в большом круге кровообращения. Начало она берет в полости левого желудочка сердца. Состоит из 3 частей:
- восходящей;
- средней;
- нисходящей.
Дуга аорты – средняя часть. Она является производным 4-ой левой артериальной дуги. Топографически располагается между рукояткой грудины и IV грудным позвонком. Ход дуги при этом – назад и влево. Затем она перекидывается через верхушку левого бронха, где начинается уже нисходящая часть аорты.
Условно в структуре выделяют 2 части:
- вогнутую;
- выпуклую.
От вогнутой стороны дуги аорты отходят кровеносные сосуды, питающие бронхи и вилочковую железу. От выпуклой части берут начало 3 ствола, располагаясь справа налево:
- Брахиоцефальный (плечеголовной).
- Общий каротидный (сонный) левый.
- Левый подключичный.

Отходят ветви дуги аорты от ее средней части вверх. Все эти артерии питают верхнюю половину туловища, включая головной мозг.
Аномалии, дефекты и заболевания
Патология кровеносного сосуда может быть разделена на 2 большие группы:
- Врожденная.
- Приобретенная.
В первом случае происходят нарушения на этапе эмбриогенеза. Это зависит от наследственной предрасположенности, действия агрессивных факторов на ранних сроках беременности. Изменения могут быть обнаружены в других отделах аорты. Если возникла такая ситуация, то говорят о комбинированных и сочетанных пороках.
При приобретенной патологии дуга аорты изначально не имеет анатомических дефектов и отклонений. Поражение является следствием основного заболевания.
 К врожденным порокам и аномалиям относят:
К врожденным порокам и аномалиям относят:
- Гипоплазию.
- Атрезию.
- Патологическую извитость (Кинкинг-синдром).
- Коарктацию.
- Пороки системы среднего отдела, среди которых выделяют:
- полную двойную дугу аорты;
- пороки развития правой и левой дуг;
- аномалии длины, размеров, непрерывности хода;
- аномалии легочного ствола и артерий.
И з приобретенных заболеваний среднюю часть поражают:
з приобретенных заболеваний среднюю часть поражают:
- атеросклероз;
- огнестрельные и ножевые ранения;
- аортоартериит Такаясу;
- аневризмы.
Такое многообразие возможных поражений этой части кровеносной системы обеспечивает заинтересованность врачей в ранней диагностике и своевременном лечении.
Краткие характеристики отдельных видов
Гипоплазия представляет собой единообразное трубчатое сужение. Такое ограничение диаметра кровеносного сосуда препятствует полноценному оттоку крови от левого желудочка. Вовлекаться в патологический процесс при этом может не только сама дуга, но и нисходящая аорта и восходящий отдел.
 В большинстве случаев сочетается с другими пороками. Большинство таких пациентов погибает в раннем возрасте. Лечение только хирургическое.
В большинстве случаев сочетается с другими пороками. Большинство таких пациентов погибает в раннем возрасте. Лечение только хирургическое.
Атрезия или перерыв именуют аномалией Стейделя. При этом полностью отсутствует один из сегментов сосуда. Следствием этого становится то, что нисходящая часть аорты не сообщается с восходящей.
Они изолированы друг от друга. Кровоснабжение осуществляется за счет открытого артериального протока. Дети с таким пороком без оперативного вмешательства умирают в первый месяц жизни.
Патологическую извилистость называют синдромом Кинкинга. Суть его состоит в том, что дуга аорты в дистальном ее конце имеет аномальную длину, изогнутость. Жалобы больные с таким пороком не предъявляют.
При обнаружении Кинкинг-синдрома у детей врачи избирают выжидательную тактику. По мере роста ребенка порок может пройти самостоятельно.
Коарктация аорты
Данная аномалия чаще диагностируется у женщин. Представляет собой сужение любой части кровеносного сосуда. Когда поражаются ветви дуги аорты, выделяют несколько вариантов:
- Стеноз или атрезия левой подключичной артерии.
- Стеноз правой подключичной артерии.
- Аномальное отхождение правой подключичной артерии:
- дистальное;
- проксимальное.
 Коарктация в сочетании с двойной дугой аорты.
Коарктация в сочетании с двойной дугой аорты.
Сужение может быть локализованным, но обычно состоит из распространенного на несколько см патологического процесса. Часто сочетается с другими врожденными аномалиями. Входит в тетраду Фалло, синдром Турнера. Выявляется порок с рождения.
При адекватной медикаментозной поддержке и небольшой степени выраженности аномалии пациенты имеют благоприятный прогноз. Ранняя хирургическая коррекция позволяет существенно увеличить продолжительность жизни (до 35–40 лет) и ее качество.
Пороки системы дуги аорты
 К этой группе относят аномалии положения, размера, формы, хода, соотношения и непрерывности артериальных сосудов. Протекают такие пороки чаще всего бессимптомно.
К этой группе относят аномалии положения, размера, формы, хода, соотношения и непрерывности артериальных сосудов. Протекают такие пороки чаще всего бессимптомно.
Жалобы появляются при выраженных изменениях и распространении аномалии на проксимальную часть нисходящего отдела. Возможно появление дисфагии или респираторных явлений в связи с тесным патологическим контактом дуги аорты и ее ветвей с трахеей, пищеводом.
При этом необходимо оперативное вмешательство, чтобы предупредить развитие тяжелых осложнений.
Чаще всего встречается полная двойная дуга аорты. Отличительный признак такого порока – наличие обеих дуг (правой и левой), от которых также отходят ветви. Затем они все сливаются с нисходящей артерией позади пищевода.
Прогноз для жизни у таких пациентов крайне благоприятный. В большинстве случаев они не нуждаются в медикаментозной поддержке.
Приобретенные пороки
Наибольшее значение из вторичных поражений кровеносного сосуда имеют:
- атеросклероз;
- аневризма.
 В первом случае происходит сужение просвета за счет формирующихся «жировых» бляшек. Легко диагностируется за счет уплотненного подчеркнутого контура сосуда при проведении УЗИ сердца, рентгенограммы легких.
В первом случае происходит сужение просвета за счет формирующихся «жировых» бляшек. Легко диагностируется за счет уплотненного подчеркнутого контура сосуда при проведении УЗИ сердца, рентгенограммы легких.
Соблюдение принципов правильного питания и рациональная фармакотерапия помогут замедлить процесс, предотвратить осложнения.
Под аневризмой подразумевают участок расширения кровеносного сосуда. Следствием этого становится сужение просвета ее ветвей в месте их отхождения. Причиной возникновения такой ситуации чаще всего служат травмы или атеросклеротические изменения.
Длительное время патология может не выдавать себя. При вовлечении в процесс восходящего или нисходящего отделов аорты, большого размера аневризмы появляются первые симптомы.
Основной способ лечения – хирургический. В схему лечения до операции обязательно входят лекарства, снижающие артериальное давление для предотвращения расслаивания или разрыва аневризмы.
Топ основных симптомов
 Несмотря на многообразие вариантов патологии в системе дуги аорты и ее ветвей, большинство больных отмечают следующие жалобы:
Несмотря на многообразие вариантов патологии в системе дуги аорты и ее ветвей, большинство больных отмечают следующие жалобы:
- одышку;
- кашель;
- осиплость голоса;
- расстройства акта глотания;
- головные боли;
- головокружения;
- временный паралич конечностей;
- отечность лица.
 Перечисленные жалобы обусловлены вовлечением в патологический процесс основных ветвей средней части аорты. Какое именно заболевание или порок имеет место, установить может только врач.
Перечисленные жалобы обусловлены вовлечением в патологический процесс основных ветвей средней части аорты. Какое именно заболевание или порок имеет место, установить может только врач.
Для этого выполняется целый комплекс различных инструментальных обследований. Схемы терапии подбираются индивидуально с учетом вида патологии.
Дуга аорты занимает важное место в процессе кровоснабжения органов и систем. Наличие порока или заболевания её системы может приводить к тяжелым последствиям, смерти.
Поэтому важно проходить диспансеризацию, своевременно обращаться к специалисту, соблюдать все его рекомендации.
![]()
Источник: xn——6kca5bub0n.xn—-8sbarpmqd5ah2ag.xn--p1ai
