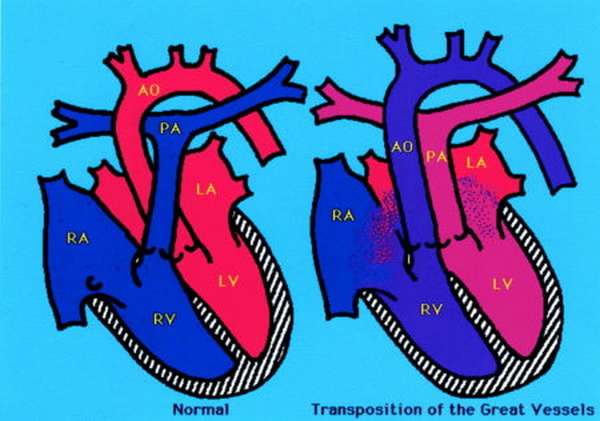
Транспозиция магистральных сосудов (ТМС) означает неправильное положение главных сосудов, отходящих от сердца, т.е. аорты и ствола легочной артерии, относительно друг друга и относительно камер сердца, от которых они отходят.
Вариантов транспозиции может быть много: полная, неполная, корригированная, в сочетании с другими пороками.
Пока мы коснемся только полной транспозиции, т.е. ситуации, когда сосуды полностью переместились, поменялись своими местами. Аорта отходит от правого желудочка, а легочная артерия — от левого. Остальные отделы сердца, т.е. предсердия с впадающими в них венами, и желудочки, нормальны и не имеют никаких других пороков (иногда применяют термин «простая ТМС»). Как не трудно себе представить, но такое бывает с сердцем, и не так уж редко. Это как если бы там, где должна быть руки – выросли ноги, а там, где ноги — руки. К счастью, это не так страшно выглядит. Дети рождаются доношенными, совершенно нормальными, но, в отличие от тетрады Фалло, сразу очень синюшными. Становится очевидным, что ребенку сразу после рождения очень трудно просто — жить.
Венозная кровь, бедная кислородом, поступает в правое предсердие, в правый желудочек, а отсюда — снова в отходящую от него аорту и в большой круг кровообращения, так и не пройдя через легкие, не насытившись кислородом и не отдав углекислый газ. А кровь из легких по легочным венам идет в левое предсердие, в левый желудочек, и снова – в легочную артерию и в легкие, что с точки зрения ее насыщения кислородом бессмысленно, т.к. она уже насыщена. Образуется два разобщенных круга кровообращения.
И, если мы ранее условно изобразили взаимоотношение кругов кровообращения в виде восьмерки, лежащей на боку, то при транспозиции — это два замкнутых кольца, не связанных между собой.
Ясно, что такое положение дела просто несовместимо с жизнью. Но природа решает по-своему: оставляет открытым овальное окно (т.е. естественный дефект) в межпредсердной перегородке, через который происходит утечка части венозной крови в левые отделы, и потом — в легкие. Оба круга между собой связаны только этим шунтом.
Понятно, что количество крови, которое пройдет через дефект с каждым сердечным циклом, и от которого зависит ее насыщение, очень мало и никак не может обеспечить потребность организма. Если дефектов два, или добавляется еще дефект межжелудочковой перегородки – то это несколько лучше, т.к. количество окисленной крови в артериальной системе становится больше. Но все равно ее крайне недостаточно.
Дети, родившиеся с полной транспозицией магистральных сосудов, быстро впадают в критическое состояние, и, если им не помочь уже в первые дни жизни, они погибнут. Приступов одышки, как при тетраде Фалло, у них не будет, но цианоз появляется уже в первые часы, и малейшее физическое усилие — движения, сосание, плач — становится трудно или совсем невыполнимым. Что же необходимо делать? В первую очередь — расширить имеющийся дефект, увеличить его размер, чтобы сделать большим объем проходящей через него венозной крови.
Это достигается так называемой процедурой Рашкинда, суть которой сводится к тому, что в открытое овальное окно проводится катетер с баллончиком, который раздувают, тем самым разрывая межпредсердную перегородку и увеличивая дефект в диаметре. Процедура выполняется в кабинете рентгенохирургии и подготовка к ней включает все моменты, которые мы описали выше, когда говорили о зондировании сердца или о закрытии открытого артериального протока.
При полной транспозиции расширение дефекта должно быть сделано экстренно. Но это расширение — и увеличение потока смешанной крови — само по себе ничего не решает. Оно только немного улучшает состояние ребенка и продлевает ему жизнь, и надо что-то делать дальше, не откладывая. Эффект процедуры будет очень недолгим — всего несколько недель, а если ждать дольше, то ребенок может погибнуть от сердечной недостаточности и постоянного кислородного голодания.
Понятно, что идеальным методом лечения транспозиции является полное устранение этой «ошибки природы» — т.е. хирургическое перемещение аорты и соединение ее со «своим» левым желудочком (тогда как она сейчас отходит от правого), а легочной артерии – с правым желудочком.
Описание операции хирургического перемещения аорты и соединения ее со «своим» левым желудочком
После обычного введения ребенка в наркоз, открытия грудной клетки, соединения с аппаратом, начинают искусственное кровообращение, с помощью которого кровь одновременно охлаждают (это всегда делается и при других операциях, которые могут потребовать достаточно длительного времени — 1,5-2 часа и больше). Дело в том, что при охлаждении замедляются все обменные процессы (как у медведя в зимней спячке), а это – защита организма от всевозможных осложнений в последующем. С помощью аппарата охлаждение происходит быстро (как и согревание в завершающей стадии операции).
Аорта и легочная артерия рассекаются пополам. Коронарные артерии отрезаются от аорты и вшиваются в начало легочной артерии, которое будет потом устьем новой аорты. К этому участку подшивают отсеченную «свою» аорту, а затем из кусочка собственного перикарда делают трубку, которая вшивается в новую легочную артерию, восстанавливая и ее.
Таким образом, достигают истинной анатомической коррекции порока. Теперь все нормально: магистральные сосуды отходят от тех желудочков, от которых и должны отходить. Эта операция, как видим, сложная и длительная. Но сегодня ее делают достаточно успешно в нескольких кардиологических клиниках страны. Однако чтобы рассчитывать на успех, ее надо делать очень рано, т.е. в первые недели жизни.
Дело в том, что при рождении оба желудочка, правый и левый, хорошо развиты, имеют одинаковую мышечную массу и толщину стенок. При нормальном развитии у правого желудочка нагрузка оказывается меньше, чем у левого: ему не надо качать кровь в большой круг, т.е. по всему телу, и он довольно быстро привыкает к этому. Пройдет немного времени — и его стенка станет тоньше, и масса мышц уменьшится: зачем работать, если можно и не работать? То же самое происходит и при транспозиции — но с левым желудочком. При транспозиции желудочки новорожденного тоже изначально одинаковы, и то, что они работают против разных сопротивлений большого и малого кругов кровообращения, в первое время их никак не касается. Но потом левый желудочек истончается и теряет массу, а ведь после операции перемещения сосудов именно ему предстоит выполнять главную работу. И вот тут важно не упустить время, т.к. если ждать несколько месяцев, то даже в случае хорошего эффекта процедуры Рашкинда, радикальная коррекция будет уже невозможна. Наилучшее время для такой коррекции — первый месяц жизни.
Надо сказать, что такое лечение полной транспозиции применяется в течение уже 25 лет, а в последние годы становится стандартным. Понятно, что для успешного выполнения этой сложной операции необходима не только хорошо отработанная методика, но и безопасные для грудного ребенка методы обеспечения наркоза, искусственного кровообращения, ведения послеоперационного периода, т.е. всего того, что и приводит к окончательному успеху. Это может быть сделано только в крупных детских кардиохирургических центрах, имеющих большой опыт лечения врожденных пороков сердца.
Чего ждать после операции? В целом, результаты очень хорошие. Сегодня сотни оперированных больных ведут нормальный образ жизни, а продолжительность жизни некоторых детей, прооперированных одними из первых, уже насчитывает 20 и более лет. Конечно, наблюдение кардиолога, а иногда и подробные обследования, являются обязательными, т.к. по мере роста ребенка и самого сердца могут возникнуть проблемы. Однако, главные из этих проблем вполне можно устранить рентгенохирургическим путем, не прибегая к повторной операции.
К сожалению, радикальную операцию сделать можно не всегда. Главная из причин — позднее обращение к специалистам, когда время уже упущено. Нередко приходится видеть детей с полной транспозицией в возрасте одного-двух лет. Они очень синие и сильно отстают в физическом развитии. Их глаза — умные, страдающие, и как будто все понимающие — невозможно забыть никогда. Этим детям тоже можно и нужно срочно помочь, и такие методы есть, их применяют давно, и они хорошо себя зарекомендовали. Задолго до того, как хирургическая наука сделала возможным раннее и анатомически радикальное лечение транспозиции, был предложен другой, менее радикальный, но достаточно эффективный метод.
Идея заключается не в исправлении анатомии (тогда это было технически невозможно), а в изменении путей потоков крови, т.е. направлении крови из вен в легкие, в малый круг, а окисленной крови — в левый желудочек и в аорту, т.е. в большой круг.
Методы, известные как «внутрипредсердная коррекция» были долгое время единственными в лечение транспозиции, но они применяются и сегодня, когда по каким-то причинам нет возможности выполнить анатомическую коррекцию.
Суть операции сводится к рассечению правого предсердия, удалению всей межпредсердной перегородки и вшиванию внутри полости заплаты из собственных тканей ребенка (перикарда, или стенки предсердия) таким образом, что кровь из полых вен направляется в левый желудочек, от которого отходит легочная артерия, и затем — в легкие, а из легочных вен — в правый желудочек, в аорту и в большой круг кровообращения. Эти операции, известные по имени их авторов – Мастарда и Сеннинга, исправляют гемодинамику, но не сам порок. Сегодня в мире накоплен большой опыт таких операций, и судьба оперированных больных прослежена в течение уже нескольких десятков лет.
половины из них нормальная, достаточно активная и длительная жизнь. У другой части могут со временем возникать осложнения в виде нарушений ритма, недостаточности предсердно-желудочковых клапанов — ведь желудочки сердца остались на месте и работают не так, как предусмотрено природой. Люди, перенесшие такую операцию, иногда немного синюшные — особенно губы и ногти на руках и ногах. Остаются ограничения в физических нагрузках. Девочкам, достигшим зрелого возраста, могут не рекомендовать рожать детей, и не из-за того, что ребенок будет с пороком – это полное заблуждение, а из-за того, что беременность и роды могут оказаться чересчур большой физической нагрузкой. Но, как бы то ни было, методы внутрипредсердной коррекции спасли жизнь сотням детей. Так что, если и упущен момент для анатомической коррекции, выход есть, и хороший выход.
Тем более что в последние годы начали осуществлять операции перемещения сосудов с удалением старых внутрипредсердных заплат. Такое — не всегда возможно и необходимо, и, кроме как «высшим пилотажем» в кардиохирургии это нельзя и назвать. Но время идет вперед, и я только хочу, чтобы вы поверили: транспозиция магистральных сосудов сегодня — вполне излечимый порок, и ни один ребенок, родившийся с ним, погибать не должен. Но при этом его будущее зависит во многом и от вас, и от вашей веры в современные возможности медицины.
Источник: bakulev.ru
Лечение полной транспозиции магистральных артерий
В предоперационном периоде проводят консервативную терапию сердечной недостаточности. Используют инфузию простагландинов группы Е для улучшения проходимости открытого артериального протока, с этой же целью проводят закрытую баллонную атриосептотомию (процедуру Рашкинда) для увеличения межпредсердного сообщения. Процедуру проводят под рентгенологическим контролем или в современных условиях в палате интенсивной терапии под контролем ультразвука. Проведение процедуры без интубации даёт возможность быстро активизировать больных.
При транспозиции магистральных артерий, сопровождаемой выраженной гипоксемией, показана оперативная коррекция. Оперативное лечение проводят, как правило, рано, в первый месяц жизни. Существует два основных варианта хирургического лечения: переключение кровотока на уровне предсердий и переключение кровотока на уровне магистральных артерий. Переключение кровотока на уровне предсердий проводят путём выкраивания из ксеноперикарда Y-образной заплаты, один конец которой подшивают так, чтобы венозная кровь из полых вен направлялась через предсердно-желудочковое сообщение в левый желудочек. Через оставшуюся часть предсердия артериальная кровь поступает из лёгочных вен через трикуспидальный клапан в правый желудочек и в аорту. При предсердном переключении системным желудочком остаётся правый. Поскольку он филогенетически не предназначен для работы в условиях высокого давления, его насосная функция и функция трикуспидального клапана постепенно ухудшаются, что не позволяет надеяться на длительный хороший результат.
Переключение кровотока на уровне магистральных артерий — полностью радикальная операция, так как аорту и лёгочную артерию подшивают к соответствующим желудочкам (к левому и правому соответственно). Сложность операции заключена в необходимости коронаропластики. Операцию проводят в условиях искусственного кровообращения и глубокой гипотермии (ректальную температуру снижают до 18 °С).
Источник: ilive.com.ua
®
ребенка
На допомогу пед1атру / To Help the Pediatrician
I» vJ
4
УДК 616.13/16-007.2-053.31-07-08-036 КАЛАШНИКОВА Е.А., НИКИТИНА H.A.
Одесский национальный медицинский университет, кафедра пропедевтики педиатрии
ПОЛНАЯ НЕКОРРИГИРОВАННАЯ ТРАНСПОЗИЦИЯ МАГИСТРАЛЬНЫХ СОСУДОВ: РАННЯЯ НЕОНАТАЛЬНАЯ И ПОСТНАТАЛЬНАЯ ДИАГНОСТИКА, КЛИНИЧЕСКАЯ МАНИФЕСТАЦИЯ, ЛЕЧЕНИЕ И ПРОГНОЗ
Резюме. В статье представлены литературные данные о частоте, основных клинических проявлениях, современных методах ранней неонатальной и постнатальной диагностики, лечении и прогнозе полной некорригированной транспозиции магистральных сосудов — врожденном пороке сердечно-сосудистой системы.
Ключевые слова: транспозиция магистральных сосудов, дети.
Транспозиция магистральных сосудов (ТМС) — группа врожденных пороков сердца (ВПС), характеризующихся аномальным положением восходящей аорты и ствола легочной артерии. Выделяют два основных типа данной аномалии: 1) транспозиция магистральных сосудов (полная, простая, истинная, некорригированная, цианотическая); 2) корригированная транспозиция магистральных сосудов (инверсионная транспозиция, ротационная аномалия, ацианотическая транспозиция, зеркальное расположение желудочков, псевдотранспозиция и др.).
Согласно международной классификации болезней 10-го пересмотра выделяют: Q20.3 Дискор-дантное желудочково-артериальное соединение (Декстротранспозиция аорты. Транспозиция магистральных сосудов (полная)). Первое описание порока принадлежит М. Baillie (1797), впервые определение пороку было дано М. Abbott (1927).
Частота. Полная транспозиция магистральных сосудов (ПТМС) относится к числу распространенных «синих» пороков, составляя среди всех врожденных пороков сердца, по клиническим данным, от 4,2 до 9,9 %, по патологоанатомическим — от 15,7 до 20,8 %. Среди «синих» пороков ПТМС занимает 2-е место после тетрады Фалло и является самым частым ВПС, характеризующимся ранним появлением тотального цианоза (с рождения).
Пренатальная диагностика. Транспозиция главных артерий обычно не диагностируется в прена-тальном периоде при проведении скринингового
обследования, поскольку исследование сердца плода ограничивается изучением только четырехка-мерного среза. Обнаружить транспозицию главных артерий можно при их визуализации с изучением расположения сосудов относительно друг друга. В норме главные артерии перекрещиваются, а при транспозиции выходят из желудочков параллельно: аорта — из правого желудочка, легочная артерия — из левого желудочка (рис. 1).
Сочетание с другими пороками. Около 8 % живорожденных с транспозицией главных артерий имеют сочетанные экстракардиальные аномалии. Среди хромосомных дефектов при транспозиции главных артерий отмечены трисомии 13, 18 и 21, триплоидия и разнообразные дупликации и деле-ции. Транспозиция описана в структуре генных нарушений с любым типом наследования (ауто-сомно-доминантный, аутосомно-рецессивный, Х-сцепленный рецессивный) и нередко наблюдается при синдроме асплении/полисплении.
Клиника. Клиническая картина обусловлена ге-модинамическими изменениями, характер которых определен количеством и размерами сопутствующих компенсирующих коммуникаций, других де-
Адрес для переписки с авторами:
Калашникова Е.А.
E-mail: kalashnikova [email protected]
© Калашникова Е.А., Никитина Н.А., 2015 © «Здоровье ребенка», 2015 © Заславский А.Ю., 2015
Рисунок 1. Срез через главные артерии. Виден параллельный ход сосудов (по М.В. Медведеву)
фектов и состоянием малого круга кровообращения. При ПТМС аорта отходит от правого желудочка (рис. 2), легочная артерия — от левого желудочка.
Аорта располагается чаще всего кпереди и вправо от легочной артерии (70 %) или справа от нее бок о бок во фронтальной плоскости (28 %). Венозная кровь из аорты проходит по тканям организма и возвращается в правый желудочек. По второму кругу артериальная кровь из левого желудочка поступает в легочную артерию, альвеолярные капилляры и через легочные вены и левое предсердие возвращается в левый желудочек. В данных условиях кровообращение проходит по двум разобщенным кругам и кровь не может оксигенировать-ся. При отсутствии сообщений между большим и малым кругом кровообращения ребенок погибнет
Рисунок 2. Схема гемодинамики при транспозиции магистральных артерий
сразу после рождения. Но у всех больных с полной транспозицией магистральных сосудов имеются дополнительные пороки (дефект межжелудочковой перегородки (ДМЖП), дефект межпредсерд-ной перегородки (ДМПП), открытый артериальный проток (ОАП) и др.), корригирующие эти нарушения гемодинамики.
Ранняя неонатальная и постнатальная диагностика. У новорожденного отмечается тотальный прогрессирующий и центральный цианоз, появляющийся в первые сутки после рождения; ау-скультативная картина не характерна; шум может отсутствовать, но чаще определяется слабый систолический шум вдоль левого края грудины, реже — грубый систолический шум, обусловленный сопутствующим дефектом межжелудочковой перегородки или стенозом легочной артерии. Недостаточность кровообращения обычно развивается рано, на второй неделе жизни; признаки застойной сердечной недостаточности: тахикардия, тахипноэ, повышение потоотделения, ребенок перестает прибавлять в весе.
На рентгенограмме у 1/3 новорожденных выраженное увеличение размеров сердца, главным образом за счет правых отделов. Часто тень сердца имеет классическую для данного порока форму — овоид-ную конфигурацию («яйцо, лежащее на боку»), с узким сосудистым пучком в прямой проекции. При ПТМС с интактной межжелудочковой перегородкой сердце может иметь нормальные размеры. На электрокардиограмме (ЭКГ) — правограмма, признаки гипертрофии правого желудочка.
Критерии постнатальной диагностики
I. Анамнестические: раннее развитие (у 50 % новорожденных) и дальнейшее быстрое прогрес-сирование гипотрофии, отставание в физическом и психическом развитии; появление тотального цианоза с первых дней жизни; ранняя недостаточность кровообращения при сочетании ПТМС с ДМЖП и ДМПП, в анамнезе частые, рецидивирующие брон-холегочные заболевания.
II. Клинические:
— признаки хронической гипоксии; изменения концевых фаланг пальцев («барабанные палочки», «часовые стекла»);
— одышка, тахикардия, общий цианоз, усиливающийся при физической и психической нагрузке;
— усиление сердечного толчка, прекардиальная пульсация;
— расширение границ сердца в поперечнике, может формироваться «сердечный горб»;
— аускультативные признаки разнообразны: первый тон на верхушке громкий, второй — акцентуирован, особенно при наличии ДМЖП, позже на фоне недостаточности кровообращения может выслушиваться трехчленный ритм продиастоличе-ского галопа. Наряду с выраженным систолическим шумом по левому краю грудины возможно и его отсутствие;
— живот атоничный, увеличенный в объеме, ге-патомегалия, периферические отеки незначительны;
— периферическая пульсация удовлетворительная, артериальное давление нормальное.
III. Параклинические:
— анализ крови клинический: полицитемия за счет увеличения содержания эритроцитов (более 5—6 Т/л), полиглобулия (концентрация гемоглобина более 180—200 г/л), высокий гематокрит, низкая скорость оседания эритроцитов (1—2 мм/ч);
— ЭКГ: отклонение электрической оси сердца вправо, к 3-4-й неделе жизни у всех больных с ПТМС появляются признаки гипертрофии правого желудочка и правого предсердия, в дальнейшем развивается комбинированная гипертрофия желудочков с преобладанием правого;
— фонокардиография: амплитуда первого и второго тонов нормальная, характерные особенности отсутствуют;
— эхокардиография: идентификация главных магистральных стволов, желудочков и их клапанного аппарата, косвенные эхо-признаки: увеличение толщины стенок и полости правого желудочка;
— рентгенологические: легочный рисунок чаще усилен по артериальному руслу, особенно при сочетании ПТМС с ДМЖП и ОАП. Характерная для данного порока форма сердца — «яйцо, лежащее на боку», размеры сердца увеличиваются во все стороны, и сердце часто приобретает шарообразную форму с узким сосудистым пучком (обнаруживаемым в сагиттальной проекции), в боковой и косых проекциях сосудистый пучок широкий.
При дифференциальной диагностике следует помнить, что у детей с атриовентрикулярной блокадой, аритмиями, шумом недостаточности митрального клапана необходимо исключать корригированную транспозицию магистральных сосудов с помощью эхокардиографии.
Лечение. У новорожденных для предупреждения закрытия артериального протока рекомендуется проведение постоянной инфузии простагланди-на Е1. Это имеет особенное значение при ПТМС с ДМЖП и обструкцией выводного тракта левого желудочка.
Коррекция метаболического ацидоза проводится бикарбонатом натрия. При развитии отека легкого и тяжелой гипоксемии показан перевод больного на искусственную вентиляцию легких.
Необходима ранняя хирургическая коррекция порока, так как большинство детей погибает в первые 3—6 месяцев жизни. В первые месяцы жизни часто выполняются паллиативные операции, позволяющие перенести сроки радикальной корригирующей операции до достижения ребенком годовалого возраста, когда оперативное вмешательство выполняется легче и уменьшается количество осложнений.
У большинства новорожденных с транспозицией главных артерий и интактной межжелудочковой
перегородкой с первых дней жизни отмечается выраженный цианоз. Смешение двух кругов кровообращения через межпредсердную коммуникацию необходимо для предотвращения гипоксии мозга и возможного летального исхода, поэтому методом выбора может быть хирургическое создание коммуникации на уровне предсердий. Хирургическую коррекцию следует проводить сразу после того, как установлено неадекватное смешивание потоков крови. До операции ребенку вводят препарат простагландина Е1, который поддерживает открытым артериальный проток, что временно обеспечивает относительно адекватный кровоток у новорожденного. В случаях адекватного смешения (при большой межпредсердной или межжелудочковой коммуникации) оперировать целесообразно после 2 нед. жизни, так как необходимо время для адекватной подготовки левого желудочка к поддержанию системного кровообращения. По данным большинства центров, смертность новорожденных при подобном виде оперативного лечения составляет менее 5—10 %. При наличии стеноза легочной артерии и дефекта межжелудочковой перегородки возможно проведение баллонной предсердной сеп-тотомии и/или системно-легочного артериального шунтирования с целью поддержания адекватной оксигенации до того момента, когда станет возможной анатомическая коррекция порока.
Прогноз. При естественном течении ПТМС прогноз неблагоприятный, так как в первые недели жизни погибает около 30 % больных, к месячному возрасту — 50 %, к 3 мес. жизни — около 70 %, к 6 месяцам — 75 %, к первому году жизни — 90 %; до 2-летнего возраста доживает около 7 % больных.
После оперативного лечения прогноз определяется анатомическим типом порока и вариантом хирургической коррекции. Данные катамнеза свидетельствуют о развитии у больных после проведенной операции предсердных брадиаритмий, три-куспидальной регургитации, правожелудочковой недостаточности.
Список литературы
1. Болезни сердца и сосудов. Руководство Европейского общества кардиологов / Под ред. А. Д. Кэмма, Т. Ф. Люшера, П.В. Серруиса; пер. с англ. подред Е.В. Шляхто. — М.: ГЭОТАР-Медиа, 2011. — 2294 с.
2. Врожденные пороки развития: доклад Секретариата: ЕВ 126/10// 126-я сессия Исполнительного комитета ВОЗ: пункт 4.7предварительной повестки дня, 3декабря 2009г., Женева. — Женева, 2009. — 9 с.
3. Врожденные пороки развития: Практ. руководство / В.Н. Запорожан, И.Л. Бабий, С.Р. Галич [и др.]. — Одесса: ОНМедУ, 2012. — 320 с.
4. Дiагностика та мотторинг вроджених вад серця у ново-народжених: Навч. поабник / О.П. Волосовець, Г.С. Сенаторо-ва, М.О. Гончарь, АД. Бойченко. — Х., 2013. — 108 с.
5. Кардиология детского возраста / Под ред. А.Д. Царего-родцева, Ю.М. Белозерова, Л.В. Брегель. — М.: ГЭОТАР-Медиа, 2014. — 784 с.
6. Клшчна доnnлерiвська ультрасонографы / За ред. П.Л. Аллана, П.А. Даббтса, М.А. Позняка, В.Н. Мак-Джена; пер. з англ. — Львiв: Медицина свту, 2007. — 374 с.
7. Мутафьян О.А. Детская кардиология/ О.А. Мутафьян. — М.: ГЭОТАР-Медиа, 2009. — 504 с.
8. Мутафьян О.А. Пороки сердца у детей и подростков / O.A. Мутафьян. — М.: ГЭОТАР-Медиа, 2009. — 560 с.
9. Неонатология: Нац. руководство / Под ред. Н.Н. Володина. — М.: Академия, 2008. — 848 с.
10. Перинатальная кардиология. Руководство для педиатров, акушеров, неонатологов/А.С. Шарыкин. — М.: Волшебный фонарь, 2007. — 264 с.
11. Прахов А.В. Неонатальная кардиология/ А.В. Прахов. — Н. Новгород: НижГМА, 2008. — 387с.
12. Сорокман Т.В. Генетичний монторинг. Частина I. Про-блеми етдемюлоги уроджених вад розвитку / Т.В. Сорокман, Л.В. Швигар// Здоровье ребенка. — 2007. — № 3(6). — С. 109-111.
13. Цыбулькин Э.К. Угрожающие состояния в педиатрии. Экстренная врачебная помощь / Э.К. Цыбулькин. — М.: ГЭО-ТАР-Медиа, 2007. — 224 с.
14. Черная Н.Л. Новорожденный ребенок. Основы оценки состояния здоровья и рекомендации по профилактике его нарушений: Рук-во для врачей / Н.Л. Черная, В.В. Шилкин. — СПб.: СпецЛит, 2009. — 352 с.
15. Шабалин А.В. Клиническая ультразвуковая диагностика у детей и подростков: атлас / А.В. Шабалин, И.В. Шаба-лин. — Н. Новгород: Изд-во Нижнегородской гос. мед. академии, 2001. — 240 с.
16. Шарыкин А.С. Врожденные пороки сердца. Руководство для педиатров, кардиологов, неонатологов/А.С. Шарыкин. — 2-е изд. — М.: Бином, 2009. — 384 с.
17. Impact of Cardiac Rehabilitation on the Exercise Function of Children with Serious Congenital Heart Disease / Jonathan Rhodes [et al.]// Pediatrics. — 2005. — Vol. 116. — P. 1339-1345.
Получено 05.01.15 U
Калашнкова K.A., Нктна Н.О.
Одеський нацюнальний медичний ун!верситет, кафедра пропедевтики пед!атрА
ПОВНА НЕКОРИГОВАНА ТРАНСПОЗИЩЯ МАГИСТРАЛЬНИХ СУДИН: РАННЯ НЕОНАТАЛЬНА i ПОСТНАТАЛЬНА ^АГНОСТИКА, КЛМЧНА МАЖФЕСТАШЯ, ЛкУВАННЯ ТА ПРОГНОЗ
Резюме. У статп наведено лггературт даш щодо частота, основних клшчних проявiв, сучасних методiв ранньо! неонатально! i постнатально! дiагностики, лшування i прогнозу повно! некориговано! транспозицп мапстраль-них судин — уродженого дефекту серцево-судинно! сис-теми.
Kro40Bi слова: некоригована транспозицiя мапстраль-них судин, дати.
Kalashnikova Ye.A., Nikitina N.A.
Odesa National Medical University, Department
of Propedeutics of Pediatrics, Odesa, Ukraine
TOTAL NONCORRECTABLE TRANSPOSITION OF THE GREAT VESSELS: EARLY NEONATAL AND POSTNATAL DIAGNOSIS, CLINICAL MANIFESTATIONS, TREATMENT AND PROGNOSIS
Summary. The article presents the published data on the prevalence, the main clinical manifestations, modern methods of early neonatal and postnatal diagnosis, treatment and prognosis for total non-correctable transposition of the great vessels — a congenital malformation of cardiovascular system.
Key words: transposition of the great vessels, children.
Источник: cyberleninka.ru
Характеристика патологии
Под транспозицией сосудов подразумевают их естественное перемещение, когда они меняются местами и становятся на физиологически не предназначенные для них места. Если строение сердца соответствует норме, ЛА идет от желудочка с правой стороны и переносит кровь в область легких, где происходит ее обогащение кислородом. Через определенный период кровь возвращается в предсердие с левой стороны и проходит в область левого желудочка, к которому прикреплена отходящая аорта.
Важно! Продолжительность жизни младенца с врожденной патологией такого типа зависит от наличия отверстия между предсердиями и желудочками, а также его размера. С течением времени у ребенка развивается сердечная недостаточность по причине повышения количества перекачиваемой крови.
С учетом корригированной или стандартной ТМС ЛА идет от левого желудочка, а аорта начинается только в области желудочка с правой стороны. Отклонение сопровождается негативными последствиями, поскольку кровь, не обогащаемая кислородом, проходит через аорту, хотя ее путь должен пролегать сквозь ткани легких. В это время кровь, протекающая по легочной вене, идет обратно в сердечные камеры с левой стороны. Порок становится причиной проблем с кровоснабжением и приводит к кислородному голоданию тканей.
Развитие порока в различном возрасте
Угроза смертельного исхода возрастает по мере развития отклонения, ее прогрессирование сопровождается серьезными проблемами и протекает достаточно тяжело. У новорожденного развивается цианоз, для которого характерно посинение рук, ног и зоны носогубного треугольника. Неправильное строение сосудов сопровождается разными симптомами с учетом периода жизни:
- Плод в утробе. Находясь в матке, малыш не ощущает дискомфорта, поскольку его кровь пока не проходит через малый, легочный круг кровообращения, который не играет важной роли в данное время.
- Новорожденный. Сразу после появления на свет малыш нуждается в том, чтобы часть его венозной крови принимала кислород в достаточном количестве. При наличии дополнительных отклонений от нормы, например, отверстия в межжелудочковой перегородке, часть бедной кислородом крови такого типа переходит в область правого желудочка и переходит в малый круг кровообращения.
- Взрослый человек. Последствия неисправленного в детстве дефекта приводят к негативным последствиям во взрослой жизни. До взрослого состояния доживают только те, у кого присутствуют дополнительные дефекты, например, отверстие в межжелудочковой перегородке, позволяющее смешиваться в сердце венозной и артериальной крови. Патология прогрессирует с каждым годом и влияет на все процессы в организме, коррекция порока дает возможность вернуться к нормальной жизни.
Классификация патологии
ТМС у плода делится на несколько типов в зависимости от очага поражения и может затрагивать сосуды с правой или левой стороны. Перечень типов нарушения включает:
- транспозиционное положение неполного характера, если сосуд отходит только от одного желудочка,
- завершенную транспозицию сосудов, при которой легочный ствол и аорта меняются местами,
- транспозицию магистралей с дополнительными пороками (ДМПП, ДМЖП, ООО, открытый артериальный проток и др.),
- корригированную форму порока, в этой ситуации основные сосуды и желудочки располагаются не так как нужно.
Причины возникновения
Поскольку причина отклонений в работе сосудистой системы у маленьких детей заключается в неправильной схеме расположения сосудов, кровь из легочной артерии поступает в область легких и после снова уходит в зону правого предсердия. За счет работы аорты кровь распределяется в организме, после поступает в левое предсердие и оказывается в левом желудочке. Этот процесс становится причиной проблем с обменом кислородом и углекислым газом, изоляции легких от организма.
Важно! Диагноз ставится на основании заключения врача в условиях клиники, но распознать проблему у новорожденных сразу удается лишь в редких случаях. Ребенок с ТМС может казаться вполне здоровым, но вскоре у него развивается цианоз, отечность и одышка.
Согласно классификации перечня МКБ, ТМС входит в перечень самых опасных отклонений. У плода с таким диагнозом крайне мало шансов на выживание, поскольку он родится с не функционирующими сосудами кровеносной системы. Проблемы с плотностью ткани легких и работой сердца можно определить на рентгенограмме, отхождение аорты видно после прохождения ангиографического сканирования. Сразу после появления на свет ребенку назначат операцию, после которой он сможет полноценно развиваться.

Основные симптомы
Чаще всего младенцы с ТМС рождаются в срок и полностью соответствуют всем показателям согласно шкале Апгар, единственным отклонением может являться небольшое превышение веса. Уже очень скоро у маленьких пациентов обнаруживают гипоксемию, тотальный цианоз, проблемы с дыханием и тахикардию. При сочетании неправильного положения сосудов с коарктацией аорты и ОАП цианоз у ребенка сильнее выражен в верхней части тела.
Если первичное обследование не проводилось в родильном доме, обнаружить основные симптомы можно на протяжении нескольких недель после выписки ребенка. У новорожденного чаще всего слабый аппетит, он отказывается брать грудь, страдает нарушением дыхания и не прибавляет в весе. По данным статистики, ТМС присутствует в основном у мальчиков, это отклонение диагностируют в 20% случаев от всех патологий, связанных с пороками сердца.
Способы диагностики
Дать четкий прогноз, касающийся развития плода, можно еще на стадии его развития в утробе, что позволяет заранее спланировать методику оказания помощи. Если диагноз не поставлен в период вынашивания плода, транспозиция магистральных сосудов выявляется на протяжении первых нескольких часов или суток после появления ребенка на свет. Об этом свидетельствует одышка и цианоз кожи. Женщинам, планирующим рожать малыша, рекомендуется делать УЗИ и проходить другие процедуры для выявления возможных отклонений.
Важно! Самым простым способом считается аускультация, представляющая собой прослушивание шумов в области сердца. Но этот вариант недостаточно информативен, поэтому для уточнения диагноза требуются дополнительные процедуры.
В ряде случаев ТМС (корригированный) диагностируется через некоторое время, поскольку клинические симптомы сначала не проявляются. Только при обращении к кардиологу выявляются шумы в сердце, пароксизмальная тахикардия, атриовентрикулярная блокада.
Иногда у ребенка развиваются дополнительные дефекты, например, отверстие между желудочками или предсердиями. Как ни странно, они частично нормализуют процесс кровообращения, поскольку часть венозной и артериальной крови смешивается в камерах сердца.
Перечень доступных способов диагностики включает:
- эхокардиографию, которая считается самым простым и информативным способом, позволяющим выявить проблемы с местоположением сосудов и ряд прочих проблем,
- рентгенографию, при помощи которой определяется форма и размеры сердца, типичные отклонения сосудов,
- катетеризацию, подразумевающую введение катетера, дающего возможность обследовать камеры сердца и определить тип их строения,
- ангиографию, в процессе которой внутрь сосудов вводятся красящие пигменты и контрастные вещества.
Варианты лечения
При наличии подтвержденного диагноза и истории болезни врач назначает оперативное вмешательство или выбирает способ лечения при помощи специальной терапии и медикаментов. Операция считается самым эффективным вариантом, позволяющим поддержать жизнедеятельность ребенка в первые месяцы после его рождения. У каждого метода есть свои особенности, которые учитываются при подборе оптимальных мер. Скорректировать ТМС возможно, несмотря на то, что она относится к разряду наиболее опасных состояний.

Хирургические методики
Первой манипуляцией хирургического характера обычно становится паллиативная процедура Парка-Рашкинда, во время которой в сердечную область вводят катетер, дополненный баллончиком. После попадания в овальное окно, он раздувается и постепенно расширяет эту зону, операцию такого типа называют закрытой.
Скорректировать дефект помогают радикальные операции, а именно операции Жатене, в процессе которой нормальное кровообращение восстанавливается искусственным способом. При этом выполняется отсечение и реплантация сосудов, закрытие ОАП. Ее назначают в первые месяцы жизни с учетом общего состояния организма ребенка.
Иногда дефект обнаруживается в более позднем возрасте – у детей старше одного года. Это происходит, когда родители по каким-либо причинам не удается обратиться к специалистам и провести тщательную диагностику. Из-за этого желудочки сердца дилатируются, подстраиваясь к имеющимся нагрузкам, и впоследствии могут не выдержать серьезной операции.
Потенциальные осложнения
При отсутствии коррекции организм ребенка постепенно подстраивается к тому, что нагрузка на левый желудочек оказывается более низкой, чем на правый, хотя у нормального человека все наоборот. Благодаря снижению давления толщина стенок желудочковой зоны уменьшается, но если оперативное вмешательство проведут позже положенного срока, левый желудочек уже не выдержит новых нагрузок на сердце. Отсутствие операции приведет к развитию кислородного голодания, появлению новых заболеваний и сокращению срока жизни.
Важно! Без оказания своевременной помощи почти 50% детей с нестандартным расположением сосудов погибает уже в первые месяцы жизни. У остальных развивается гипоксия, спустя год приводящая к смертельному исходу.
Нередко у ребенка развивается сужение легочной артерии и ряд других осложнений, когда во время операции применяются недорогие материалы или накладываются швы. Негативных последствий можно избежать, если обратиться в клинику, где применяют новые и современные методики. Хирургическая коррекция дает положительные результаты в 90% случаев простой транспозиции сосудов, но маленьким пациентам потребуется дальнейшее наблюдении и длительный период реабилитации.

Профилактика недуга
Планируя зачатие малыша, будущим родителям нужно пройти полное обследование и соблюдать все врачебные рекомендации. Конкретно беременная женщина не должна:
- посещать места с плохой экологией,
- вступать в контакт с химикатами,
- попадать под влияние ионизирующего излучения и вибрации,
- принимать любые лекарства без врачебного назначения.
Также будущей мамочке нужно оберегать себя от различных инфекционных болезней.
Прогноз
Корректирующая операция обеспечивает положительный результат в 90 процентов случаев. Прооперированные малыши должны находиться под постоянным врачебным контролем. Родители должны оберегать их от значительных физических нагрузок.
Дополнительную информацию вы можете получить из видео, представленного ниже:
Источник: dlja-pohudenija.ru
Корригированная транспозиция магистральных сосудов (КТМС) представляет собой ВПС, характеризующийся предсердно-желудочковой и желудочково-артериальной дискордант- ностью, при этом кровоток имеет физиологическое направление, т. е. в легочную артерию поступает венозная кровь, а в аорту — артериальная. Первое описание порока принадлежит С. Roki- tansky (1875).
Частота КТМС по патологоанатомическим данным [Fontana R. S., Edwards J. E., 1962] составляет 1,4 %. Однако клинические отклонения при КТМС могут быть минимальными и во многих случаях порок остается недиагностированным.
Анатомия, классификация. КТМС может встречаться при нор мальном и аномальном положении сердца (рис. 61). Полые вены, как в норме, соединяются с правым предсердием, которое через двустворчатый клапан (по структуре и распределению хордаль ного аппарата аналогичный нормальному митральному клапану) сообщается с венозным желудочком, имеющим морфологическую характеристику левого желудочка: он треугольной формы, с гладкими внутренними контурами, особенно в области перегородки. От венозного желудочка отходит ствол легочной артерии, располагающийся сзади и медиально. Фиброзное кольцо легочного ствола находится в такой же связи с септальной створкой венозного, анатомически митрального, клапана, как аортальное кольцо с септальной створкой митрального клапана в нормальном сердце. Легочные вены соединяются с нормально расположенным левым предсердием, которое сообщается посредством трехстворчатого клапана с артериальным желудоч ком. Последний по своему анатомическому строению яв ляется правым желудочком: содержит наджелудочковый гребень, подразделяющий его полость на приточный и выводной отделы, в миокарде — резко выражена трабекулярность. От артериального желудочка отходит аорта, занимающая переднелевую позицию по отношению к легочному стволу. Оба магистральных сосуда идут параллельно, не перекрещиваются, как в норме, и аортальные клапаны расположены несколько выше легочных. Дуга аорты обычно находится слева, нисходящий отдел ее имеет нормальный ход. Значительно реже аорта образует правостороннюю
Рис. 61. Варианты корригированной транспозиции магистральных сосудов при различных типах расположения сердца (схема).
а -при нормальном положении сердца; б — при правосформированном праворасположенном сердце; в — при левосформированном праворасположенном сердце; г — при левосформированном леворасположенном сердце
дугу, но аортальный клапан сохраняет левостороннюю позицию по отношению к легочному.
Топографические взаимоотношения венозного и артериального желудочков приближаются к нормальным: венозный желудочек лежит спереди и справа, выводной отдел его направлен кзади; артериальный желудочек расположен слева и несколько кзади, выводной отдел занимает переднее положение. В связи с этим выводные отделы желудочков пересекаются и это является отличительной особенностью КТМС от полной ТМС. Инверсия желудочков ведет к нарушению топографии межжелудочковой перегородки, которая подходит к предсердиям несколько левее межпредсердной перегородки (в норме — правее), так что участок левого предсердия непосредственно соприкасается с венозным. анатомически левым, желудочком. Изменения в топографии межжелудочковой перегородки оказывают влияние на распо
ложение проводящей системы сердца (ПСС). При КТМС существует пространственно перевернутое соответственно инверсии желудочков положение желудочковой части ПСС, что является причиной электрокардиографических отклонений.
Сопутствующие пороки сердца встречаются в большинстве случаев КТМС и довольно рано приводят больных в кардиохирургическую клинику. Наиболее часто выявляют ДМЖП, который может располагаться как выше, так и ниже наджелудочкового гребня, редко — в мышечной части перегородки. Диаметр дефекта колеблется от 2 до 3,5 см, так что при отсутствии легочного стеноза наблюдается легочная гипертензия. У 70 % больных наряду с ДМЖП определяется легочный стеноз; реже последний встречается в изолированном виде. Стеноз чаще подклапанный в виде фиброзной мембраны или мышечного стеноза, реже клапанный. Следующим по частоте сопутствующим ВПС является недостаточность артериального, анатомически трикуспидального, клапана, работающего в условиях системного давления; недостаточность обусловлена аномальным прикреплением, расщеплением и деформацией створок, расширением кольца, иногда по типу аномалии Эбштейна.
К другим сопутствующим ВПС относятся стеноз и атрезия артериального, анатомически трикуспидального, клапана, «верхом сидящие» над ДМЖП атриовентрикулярные клапаны, ДМПП, аномалии полых вен, ОАП, коарктация аорты, дискретный субаортальный стеноз в морфологически правом желудочке.
На основании клинико-анатомических особенностей можно выделить 3 вида КТМС: 1) при нормальном положении сердца без сопутствующих ВПС; 2) при нормальном положении с другими ВПС; 3) при аномалиях положения сердца (правосформированном праворасположенном, левосформированном праворасположенном, левосформированном леворасположенном сердце).
Гемодинамика. КТМС в изолированном виде долго не приводит к нарушению гемодинамики, выраженность и характер которой определяются сопутствующими ВПС. При ДМЖП нарушения гемодинамики такие же, как при изолированном пороке, а при сочетании ДМЖП с легочным стенозом — аналогичны тетраде Фалло. Нарушения гемодинамики при недостаточности створок артериального атриовентрикулярного клапана соответствуют митральной недостаточности при нормальном расположении магистральных сосудов.
Клиника, диагностика. Клиническое течение КТМС без сопутствующих пороков сердца обычно длительно бессимптомное, отсутствуют какие-либо жалобы, физическое развитие нормальное. Чаще всего больные обращаются к кардиологу в связи с нарушениями ритма или наличием шума в области сердца. Приступы пароксизмальной тахикардии и обнаруживаемую атриовентрикулярную блокаду нередко считают последствиями перенесенного миокардита.
При аускультации выслушивается громкий, нерасщепленный

Рис. 62. Корригированная транспозиция магистральных сосудов. ЭКГ.
- тон над легочной артерией, обусловленный передней позицией аортального клапана. Неинтенсивный систолический шум во втором и третьем межреберьях слева обычно связан с большим ударным объемом сердца при полной блокаде. Систолический шум может зависеть от турбулентного характера кровотока в выводном отделе венозного, анатомически левого, желудочка, обусловленного образованием угла между коротким выводным отделом этого желудочка и сзади идущим легочным стволом. Систолический шум на верхушке, проводящийся влево, связан с недостаточностью артериального атриовентрикулярного клапана и может появиться в любом возрасте.
При сочетании КТМС с другими ВПС клиническая картина определяется их характером, степенью гемодинамических нарушений и мало отличается от течения пороков при нормальном положении желудочков.
Заподозрить КТМС помогают данные ЭКГ, где часто отмечается отклонение электрической оси сердца влево (lt;LaAQRS от 0 до —20°) (рис. 62). Иногда на ЭКГ при КТМС имеется синдром WPW, включая случаи с деформацией артериального атриовентрикулярного клапана по типу аномалии Эбштейна. К характерным признакам по ЭКГ относится неполная или полная атриовентрикулярная блокада (АВБ), наблюдаемая у 70 % больных. В одних случаях АВБ отмечают с рождения, в других она появляется позже, носит вначале перемежающий, а затем постоянный характер. АВБ может появиться во время катетеризации сердца или в ходе хирургического вмешательства по поводу сопутствующих пороков. Возникновение полной АВБ связано с фиброзом в области пучка Гиса или перерывом между ат-

Рис. 63. Корригированная транспозиция магистральных сосудов. Рентгенограмма грудной клетки. Объяснение в тексте.
риовентрикулярным узлом и пучком Гиса, что подтверждено гистологически. Детям с идиопатическими АВБ показано эхокардиографическое обследование для исключения КТМС как причины блокады. Еще одним признаком КТМС на ЭКГ является наличие зубцов Q в отведениях II, III, aVF, V1.2 (форма QRS пика QS) и отсутствие их в I, aVL и левых грудных отведениях, а также положительный зубец Т во всех грудных отведениях. Эти изменения отражают инверсию желудочков. Из нарушений ритма бывают атриовентрикулярная диссоциация, пароксизмальная тахикардия. Наличие ВПС с нарушениями гемодинамики, аномалии положения сердца меняют структуру ЭКГ.
На рентгенограмме органов грудной клетки тень сердца имеет шаровидную форму. В связи с левосторонним расположение аорты левый контур сосудистого пучка представлен сплошной, слегка наклонной линией, первая и вторая дуги не дифференцируются (рис. 63). У больных с дефектами перегородок и увеличенным легочным кровотоком левый контур сердца также прямой или слегка вогнутый, т. е. возникает парадоксальная картина из-за несоответствия между признаками усиления легочного рисунка и отсутствием выбухания второй дуги. Это обычно указывает на аномальное положение легочного ствола и позволя ет заподозрить КТМС. Поскольку легочный ствол располагается медиально и дорсально, при резком расширении он вызывает заметное вдавление на контрастированном пищеводе, расположенное ниже выемки дуги аорты. Выпуклый характер сплошной линии на левом верхнем контуре сердца, представленный восхо
дящим отделом аорты, особенно в сочетании с обедненным легочным рисунком, свидетельствует о выраженном легочном стенозе в комбинации с ДМЖП.
При М-сканировании характерным признаком КТМС является наличие перехода заднего магистрального сосуда (легочной артерии) в переднюю створку правостороннего (митрального) атриовентрикулярного клапана; передняя и задняя створки этого клапана имеют свободную экскурсию, у них нет контакта с межжелудочковой перегородкой. Другим характерным проявлением КТМС являются 6qk о бок расположенные желудочки. Такое расположение не позволяет определить из стандартных позиций датчика типичную картину двух желудочков с разделяющей их межжелудочковой перегородкой. Передняя створка заднего (трикуспидального) клапана имеет большую экскурсию и продолжается в передний магистральный сосуд — аорту. Трикуспи- дальный клапан закрывается раньше, чем митральный.
При двухмерном сканировании определяется расположенный впереди и слева магистральный сосуд (аорта), отходящий от передней левой стенки расположенного слева желудочка и не продолжающийся в левый атриовентрикулярный клапан. В проекции короткой парастернальной оси правый желудочек определяется слева по большому числу трабекул, тогда как левый (виден справа) имеет более гладкую эндокардиальную поверхность; можно увидеть три створки трикуспидального клапана, приобретающего в диастолу форму треугольника, тогда как сечение митрального клапана похоже на рыбий рот [Feigenba- иш Н„ 1981].
При зондировании полостей сердца возникают трудности при проведении катетера в легочную артерию, обусловленные близостью правого атриовентрикулярного и легочного клапанов, возможны тяжелые нарушения ритма. При прохождении катетера в легочный ствол фиксируется необычное его положение, обусловленное соотношением приточного и выводного отделов венозного, анатомически левого, желудочка. Венозный атриовентрикулярный клапан, в противоположность нормальной анатомической картине, находится в тесном соприкосновении с легочным клапаном, а последний в свою очередь расположен медиально, ниже и кзади. Поэтому при проведении катетера в легочный ствол он отклоняется от нормального пути и круто под острым углом заворачивает медиально кверху и кзади, что фиксируется в прямой и боковой проекциях.
Ангиокардиографическое исследование имеет наибольшую диагностическую ценность. Контрастное вещество лучше вводить в полость венозного желудочка, откуда оно поступает в легочный ствол. В прямой проекции контрастированный венозный желудочек обнаруживает гладкие внутренние контуры и из-за отсутствия инфундибулярного отдела образует «хвостообразный» выступ по направлению к верхушке сердца, т. е. изменения, типичные для левого желудочка (рис. 64, а).
Рис. 64. Корригированная транспозиция магистральных сосудов с дефектом межжелудочковой перегородки. Ангиокардиограммы.
 а — правая вентрикулограмма; контрастное вещество из венозного анатомически левого желудочка
а — правая вентрикулограмма; контрастное вещество из венозного анатомически левого желудочка
(ВЖ) поступает в легочный ствол (ЛС); б — левая вентрикулограмма: контрастное вешество нз артериального анатомически правого желудочка (ЛЖ) поступает в
аорту (Ао) и через дефект межжелудочковой перегородки в венозный желудок (ВЖ) и легочный ствол
(ЛС).
Обязательным является введение контрастного вещества в артериальный желудочек (рис. 64, б) для выявления недостаточности артериального атриовентрикулярного клапана. В прямой проекции выявляется «грушеподобная» форма артериального желудочка с грубой трабекулярностью внутренней поверхности, наличие инфундибулярного отдела и наджелудочкового гребня, т. е. признаки, характеризующие правый желудочек. Из артериального желудочка контрастируется восходящая аорта, занимающая крайне левое положение. Оба магистральных сосуда идут параллельно, не перекрещиваясь. Легочный клапан находится ниже аортального.
Дифференциальный диагноз при КТМС определяется нали
чием сопутствующих ВПС. Важно, что у детей с атриовентри- кулярными блокадами, отклонением электрической оси сердца влево, аритмиями, шумом недостаточности «митрального» клапана необходимо исключить КТМС с помощью эхокардиографии.
Течение, лечение. Изолированная КТМС может длительное время оставаться асимптоматичной. Так, J. Edwards (1954) и G. Nagle и соавт. (1971) сообщили о пациентах, которые дожили соответственно до 60 и 45 лет. A. D. Lieberson и соавт. (1969) наблюдали больного, который в молодом возрасте был призван на военную службу, а умер в возрасте 73 лет; на аутопсии была обнаружена выраженная недостаточность артериального атриовентрикулярного и аортального клапанов.
J. С. Huhta и соавт. (1985) проследили естественное течение порока у 107 больных с КТМС. Средний возраст установления диагноза составил 12,7 лет (с рождения до 56 лет). Продолжительность жизни снижалась при недостаточности артериального атриовентрикулярного клапана, полной АВБ, легочной гипертензии.
Несмотря на длительное бессимптомное течение (при отсутствии ВПС), эту аномалию вряд ли следует относить к варианту нормального развития, что подтверждается частым возникновением с возрастом атриовентрикулярных блокад, аритмий, недостаточности артериального (анатомически трикуспидального) атриовентрикулярного клапана. Эти осложнения обычно являются основной причиной ухудшения состояния и смерти больных с КТМС. Полная АВБ, по-видимому, хорошо переносится в детском возрасте, особенно, если она носит врожденный характер. Внезапное ее возникновение в юношеском и более старшем возрасте может быстро приводить к сердечной недостаточности и требует операции — имплантации искусственного водителя ритма.
Стенокардические боли иногда наблюдаются у взрослых больных с КТМС и симулируют ишемическую болезнь сердца. Боли могут быть связаны с невозможностью правой коронарной артерии длительное время обеспечить адекватное кровоснабжение правого желудочка, функционирующего как системный желудочек. У больных с КТМС и сопутствующим ВПС естественное течение и прогноз, как правило, определяются характером пороков и степенью гемодинамических расстройств.
Хирургическое лечение пороков, сопутствующих КТМС, начато в 1956 г. W. Walker, который впервые успешно закрыл ДМЖП [Walker W. et al., 1958]. В нашей стране первая успешная подобная операция выполнена В. И. Бураковским в 1963 г. При изолированной КТМС необходимость в хирургическом лечении возникает только при развитии полной АВБ. Показаниями к имплантации электрокардиостимулятора являются приступы Морганьи — Адамса — Стокса и сердечная недостаточность.
Показания к хирургическому лечению сопутствующих ВПС те
же, что и у больных с нормальным сердцем. В зависимости от типа порока, тяжести исходного состояния и возраста больных выполняются паллиативные или радикальные операции. Среди паллиативных операций у детей раннего возраста практическое значение имеет сужение ствола легочной артерии при больших ДМЖП с прогрессирующей сердечной недостаточностью; наложение межартериальных анастомозов показано при сочетании ДМЖП с легочным стенозом и резкой гипоксемией, для радикальной коррекции требуется применение клапансодержащего протеза.
Показания к закрытию ДМЖП определяются формой легочной гипертензии: оперативному лечению подлежат больные, относящиеся к Ша гемодинамической группе [Бураковский В. И. и др., 1975]. У больных с ДМЖП и тяжелой недостаточностью артериального атриовентрикулярного клапана быстро прогрессирующие кардиомегалия, легочная гипертензия и сердечная недостаточность иногда требуют радикальной коррекции уже в детском возрасте. Поскольку у больных с ДМЖП и легочным стенозом радикальная операция должна включать обходное шунтирование стеноза, ее предпочтительно выполнять в возрасте старше 5—6 лет.
Для коррекции недостаточности артериального (трехстворчатого) клапана применяют протезирование и аннулопластику. В нашей стране первая операция протезирования клапана при данной патологии выполнена в 1968 г. В. А. Бухариным, а аннулопластика — Ю. И. Бондаревым в 1979 г.
Наиболее частыми’ интра- и послеоперационными осложнениями являются повреждения коронарных артерий, неадекватное устранение легочного стеноза, нарушения ритма сердца, нераспознанная и нескорригированная недостаточность артериального атриовентрикулярного клапана, ведущие к острой сердечной недостаточности
В связи с особенностями анатомических взаимоотношений хирургическое лечение ВПС при КТМС сопровождается значительно большей летальностью, чем после таких же операций при нормальном сердце. Лишь в последние годы имеется снижение послеоперационной летальности: по данным G. Westerman и соавт. (1982)—до 9%, под данным G. D*anielson (1983) — до 13 %, причем удовлетворительные результаты отмечены у 80 % выживших больных. D. D. Mair (1986) проследил отдаленные результаты (1 —18 лет) у 40 больных-с КТМС, у которых имелись ДМЖП, ДМЖП со стенозом легочной артерии, недостаточность левого атриовентрикулярного клапана изолированная и в сочетании с ДМЖП; 10 человек (25%) умерли, причинами поздней смерти были прогрессирующая миокардиальная недостаточность, обструктивное поражение легочных сосудов, аритмии. Остальные больные, за исключением 3 человек, чувствуют себя хорошо, включая лиц с имплантированным искусственным водителем ритма.
Источник: www.med24info.com
