Содержание
1.Отёки определение……………………………………………………….3
1.1. Виды отёков…………………………………………………………….3
1.2.Кассификация отёков…………………………………………………..4
2.Механизмы проявления отёков………………………………………….6
3.Заключение……………………………………………………………….10
4.Список используемой литературы…………………………………..…11
1. Отёком называется патологическое скопление жидкости в тканях и межтканевыхпространствах вследствие нарушения обмена воды между кровью и тканями. Отёк — типовой патологический процесс, встречающийся при многих заболеваниях, одна из наиболее частых форм гипергидратации.
1.1. Виды отёчной жидкости
Отёчная жидкость может иметь различный состав и консистенцию. Она может быть в виде:
* Транссудата — бедной белком (менее 2%) жидкости.
* Экссудата — богатой белком (более3%, иногда до 7—8%) жидкости, часто содержащей форменные элементы крови.
* Слизи, представляющей собой смесь из воды и коллоидов межуточной ткани, содержащих гиалуроновую и хондроитинсерную кислоты. Этот вид отёка называют слизистым, или микседемой. Микседема развивается при дефиците в организме йодсодержащих гормонов щитовидной железы.
1.2. Классификация отёков:
1. по распространенности:
· местный (локальный);
· общий (генерализованный);
2. по скорости развития:
· молниеносные (развиваются в течение нескольких секунд, например, после укуса насекомых, змей),
· острые (развиваются в течение часа, например, при острой сердечной недостаточности отек легких),
· хронические (в течение нескольких суток, недель, например, при голодании);
3. по патогенезу:
· гидростатические (застойные), обусловленные нарушением крово– и лимфооттока и повышением гидростатического давления в микрососудах;
· онкотические — вследствие уменьшения величины коллоидно-осмотического давления плазмы крови
· мембраногенные– при повышении проницаемости капиллярной стенки,
· лимфатические (лимфогенные),возникающие при застое лимфы
· осмотические,связанные с активной задержкой в тканях электролитов, преимущественно натрия, и воды;
4. по этиологии:
· сердечные,
· почечные (нефротические и нефритические),
· печеночные,
· токсические,
· нейрогенные,
· аллергические,
· воспалительные,
· кахектические,
· голодные.
5. по локализации:
· анасарка (в подкожной жировой клетчатке);
· водянка (в серозных полостях);
· гидроперикард(накопление отечной жидкости в сердечной сорочке);
· гидроторакс (в плевральной полости);
· асцит(в брюшной полости);
· гидроцеле (в полости влагалищной оболочки яичка);
· гидроцефалия (в желудочках мозга).
6.в зависимости от ведущей причины развития местные отёки можно подразделить на:
· воспалительные;
· гемодинамические;
· лимфодинамические.
В основе патогенеза любого местного отёка лежит нарушение равновесия Старлинга, которое сводится к возрастанию внутрисосудистого гидростатического давления, снижению онкотического градиента, повышению проницаемости сосудистых стенок, либо комбинации этих механизмов.
Так, воспалительный отек связан с развитием в очаге воспаления экссудации, т. е. выхода жидкой части крови из сосудистого русла в очаг воспаления.
Экссудация обусловлена:
1) повышением проницаемости сосудистой стенки под влиянием избыточных концентраций вазоактивных соединений, лизосомальных ферментов, ионов водорода, накапливающихся в зоне альтерации;
2) возрастанием гидростатического давления в сосудах микроциркуляторного русла и увеличением площади фильтрации жидкой части крови в условиях венозного застоя, снижением внутрисосудистого онкотического давления при одновременном повышении онкотического давления в тканях;
3) увеличением коллоидно-осмотического давления в тканях и увеличением гидрофильности тканей;
4) активацией процесса цитопемсиса эндотелием сосудов, т. е. захватом эндотелиальными клетками мельчайших капелек плазмы и переносом их за пределы сосуда в воспаленную ткань.
Лимфодинамический отек возникает при первичном нарушении лимфооттока, что наблюдается при врожденном дефекте развития лимфатических сосудов, удалении регионарных лимфоузлов, при закупорке, формировании лимфоэктазий и воспалительном поражении лимфатических узлов.
Механизмы проявления отёков
1. Гидростатический (гидродинамический) фактор.При возрастании гидростатического давления в сосудах увеличивается сила фильтрации, а также поверхность сосуда, через которую происходит фильтрация жидкости из сосуда в ткань. Поверхность же, через которую осуществляется обратный ток жидкости, уменьшается. При значительном повышении гидростатического давления в сосудах может возникнуть такое состояние, когда через всю поверхность сосуда осуществляется ток жидкости только в одном направлении — из сосуда в ткань. Происходит накопление и задержка жидкости в тканях.
Возрастание гидростатического давления в сосудах отмечается при:
· повышении венозного давления (из-за застоя крови при сердечной недостаточности)
· при увеличении ОЦК (из-за увеличения выработки АДГ при хронической сердечной недостаточности).
Когда ведущим патогенетическим фактором в развитии отека является повышение гидростатического давления крови, развивается так называемый застойный отек.Этот механизм играет существенную роль при возникновении сердечных отеков (застой крови при сердечной недостаточности), при развитии асцита при циррозе печени (застой крови при портальной гипертензии). По такому механизму развиваются отеки при тромбофлебитах, отеки ног у беременных, т.к. повышается местное венозное давление из-за обтурации или сдавления вен.
2. Онкотический фактор.При уменьшении величины онкотического давления крови возникают отеки, механизм развития которых связан с падением величины эффективной онкотической всасывающей силы. Белки плазмы крови, обладая высокой гидрофильностью, удерживают воду в сосудах и, кроме этого, в силу значительно более высокой концентрации их в крови по сравнению с межтканевой жидкостью стремятся перевести воду из межтканевого пространства в кровь. Помимо этого увеличивается поверхность сосудистой площади, через которую происходит процесс фильтрации жидкости при одновременном уменьшении резорбционной поверхности сосудов.
Таким образом, существенное уменьшение величины онкотического давления крови (не менее чем на 1/3) сопровождается выходом жидкости из сосудов в ткани в таких количествах, которые не успевают транспортироваться обратно в общий кровоток, даже несмотря на компенсаторное усиление лимфообращения. Происходит задержка жидкости в тканях и формирование отека.
Онкотический фактор играет важную роль в происхождении многих видов отеков: почечных (большие потери белка с мочой — протеинурия), печеночных (снижение синтеза белков-альбуминов в печени при ее заболеваниях — гипопротеинемия, уменьшение альбумино-глобулинового коэффициента), голодных, кахектических. По механизму развития отеки, в возникновении которых ведущим является снижение онкотического давления крови, называются онкотическими.
3. Проницаемость сосудистой стенки.Увеличение проницаемости сосудистой стенки способствует возникновению и развитию отеков. Такие отеки по механизму развития называются мембраногенными.Однако повышение проницаемости сосудов может привести к усилению процессов как фильтрации в артериальном конце капилляра, так и резорбции в венозном конце. При этом равновесие между фильтрацией и резорбцией воды может и не нарушаться. Поэтому здесь большое значение имеет повышение проницаемости сосудистой стенки для белков плазмы крови, вследствие чего падает эффективная онкотическая всасывающая сила — в первую очередь за счет увеличения онкотического давления тканевой жидкости. Отчетливое повышение проницаемости капиллярной стенки для белков плазмы крови отмечается, например, при остром воспалении —воспалительном отеке.Содержание белков в тканевой жидкости при этом резко нарастает в первые 15-20 мин после действия патогенного фактора, стабилизируется в течение последующих 20 мин, а с 35-40-й мин начинается вторая волна увеличения концентрации белков в ткани, связанная, по-видимому, с нарушением лимфооттока и затруднением транспорта белков из очага воспаления. Нарушение проницаемости сосудистых стенок при воспалении связано с накоплением медиаторов повреждения, а также с расстройством нервной регуляции тонуса сосудов.
Проницаемость сосудистой стенки может повышаться при действии некоторых экзогенных химических веществ (хлор, фосген, дифосген, люизит и др.), бактериальных токсинов (дифтерийный, сибиреязвенный и др.), а также ядов различных насекомых и пресмыкающихся (комары, пчелы, шершни, осы, змеи и др.). Под влиянием воздействия этих агентов, помимо повышения проницаемости сосудистой стенки, происходит нарушение тканевого обмена и образование продуктов, усиливающих набухание коллоидов и повышающих осмотическую концентрацию тканевой жидкости. Возникающие при этом отеки называются токсическими.
К мембраногенным отекам относятся также нейрогенные(вследствие нарушения нервной регуляции сосудистого тонуса, например при нейродистрофических процессах) и аллергическиеотеки (вследствие воздействия медиаторов аллергии при аллергических заболеваниях). Например, велика роль медиаторов (гистамина, комплемента и др.) в развитии различных форм отека Квинке (немецкий врач-терапевт, описавший в 1882 г. острый локальный ангионевротический отек). Различают аллергический и неаллергический (наследственный, связанный с дефицитом ингибиторов протеаз, и в частности ингибитора С1-эстеразы системы комплемента) отеки Квинке. Чаще эти отеки развиваются на лице и в глотке, но могут затрагивать и внутренние органы (пищевод, желудок, кишечник, матку и другие органы и ткани).
Повышение проницаемости сосудистой стенки отмечается также при тромбоцитопениях, ацидозах.
4. Лимфообращение (лимфатический фактор).Затруднение транспорта жидкости и белков по лимфатической системе из интерстициального пространства в общий кровоток создает благоприятные условия для задержки воды в тканях и развития отеков. Так, например, при повышении давления в системе верхней полой вены (недостаточность правого сердца, сужение устья полых вен) возникает мощный прессорный рефлекс на лимфатические сосуды организма, вследствие чего затрудняется отток лимфы из тканей. Такое нарушение лимфообращения называетсямеханической лимфатической недостаточностьюи является одним из важных механизмов развития отека при сердечной недостаточности, а также при циррозе печени. Механическая лимфатическая недостаточность развивается также при закупорке лимфатических сосудов филяриями, при сдавлении лимфатических сосудов опухолью, экссудатом, рубцом, увеличенным соседним органом и др.
При значительном понижении содержания белков в крови (ниже 40 г/л), например, при нефротическом синдроме, линейная и объемная скорости лимфооттока возрастают в несколько раз. Однако, несмотря на это, вследствие чрезвычайно интенсивной фильтрации жидкости из сосудов в ткани лимфатическая система не в состоянии возвращать в общий кровоток столь значительные объемы тканевой жидкости. В связи с перегрузкой транспортных возможностей лимфатических путей возникает так называемая динамическая лимфатическая недостаточность.Этот патогенетический фактор играет важную роль в формировании отеков при нефротическом синдроме.
Существует также резорбционная лимфатическая недостаточность,возникающая при увеличении концентрации белков в ткани, например при воспалении. Молекулы белка удерживают воду в ткани, интенсивность лимфооттока уменьшается, и развивается отек.
В некоторых случаях роль лимфатического фактора в механизме развития отеков настолько непосредственна и велика, что выделяют так называемые лимфатические отеки.Примером может служить слоновость (elephantiasis). Заболевание встречается преимущественно в тропических странах и возникает вследствие механической закупорки лимфатических сосудов круглыми паразитическими червями — филяриями. Развивающаяся при этом механическая лимфатическая недостаточность является ведущим патогенетическим механизмом формирования сильнейшей отечности конечностей (масса одной нижней конечности может достигать 50 кг и более), половых органов и других частей тела (по типу анасарки). Заболевание быстро приводит к инвалидности.
5. Активная задержка электролитов и воды (осмотический фактор).Важным звеном в развитии многих видов отеков (сердечные, почечные, печеночные и др.) является включение механизмов, активно задерживающих электролиты и воду в организме.
гуляцию постоянства электролитного состава жидкостных сред организма и их объема в норме осуществляют антидиуретическая и антинатрийуретическая системы. Раздражение осморецепторов гипоталамуса (при повышении осмотического давления крови) и волюморецепторов предсердий (при снижении объема циркулирующей крови) сопровождается увеличением секреции АДГ гипоталамусом, а также альдостерона надпочечниками. Основным регулятором выработки альдостерона является РААС.
Заключение
Последствия отеков зависят от локализации, продолжительности и выраженности. Очень опасны отек легких, гортани, скопление отечной жидкости в сердечной сорочке, плевральной полости, в полостях головного мозга. Длительное накопление жидкости в тканях нарушает кровообращение, снижается поступление питательных веществ к клеткам, вызывает их сдавливание, нарушается структура и функция поврежденного органа и рядом расположенных, понижается резистентность.
Отек легких приводит к асфиксии, водянка полости перикарда — к тампонаде сердца, асцит нарушает функцию органов брюшной полости.
Иногда отек выполняет защитную функцию. Так, при воспалительных, токсических отеках отечная жидкость уменьшает концентрацию токсических веществ в тканях.
Список используемой литературы
1. Адо А.Д., Адо М.А. и др. Патологическая физиология. Москва: Триада-Х. 2002 — 580 с.
2. Адо А.Д., Новицкий В.В. и др. Патологическая физиология. Томск: 1994 — 428 с.
3. Зайко Н.Н. Патологическая физиология. Москва: Медпрессинформ, 2002 — 646 с.
4. Литвицкий П.Ф. и др. Патофизиология. Москва: «Медицина». 1997 — 750 с.
5. Лютинский С.И. Патологическая физиология сельскохозяйственных животных. Москва: Колос, 2001 — 495 с.
Источник: studopedia.ru
Отек – это типовой патологический процесс, который характеризуется увеличением содержания воды во внесосудистом межклеточном пространстве. В основе его развития лежит нарушение обмена воды между плазмой крови и периваскулярной жидкостью. Отек наиболее часто встречающаяся форма нарушения обмена воды в организме.
Отеки различных органов и тканей получили соответствующее название: анасарка — отек подкожной клетчатки, асцит — скопление жидкости в брюшной полости, гидроторакс — скопление жидкости в плевральной полости и т.д.
Обмен жидкости между капиллярами и тканями происходит через эндотелий микроциркуляторного русла. На артериальном конце капилляра гемодинамическое давление (в норме 35-45 мм рт. ст.) выдавливает через стенку капилляра ультрафильтрат плазмы в ткань, несмотря на онкотическое давление в крови в 25 мм рт.ст. (в тканях – около 10-12 мм рт.ст.), которое препятствует выходу ультрафильтрата. На венозном конце капилляра гидростатическое давление падает до 10-15 мм рт. ст., а осмотическое остается неизменным. Поэтому тканевая жидкость поступает через стенку капилляра в его просвет. В нормальных условиях объем ультрафильтрата должен соответствовать объему реабсорбции. Но если и есть избыток жидкости сверх объема ультрафильтрата, то он возвращается в кровеносное русло через лимфатические капилляры и сосуды.
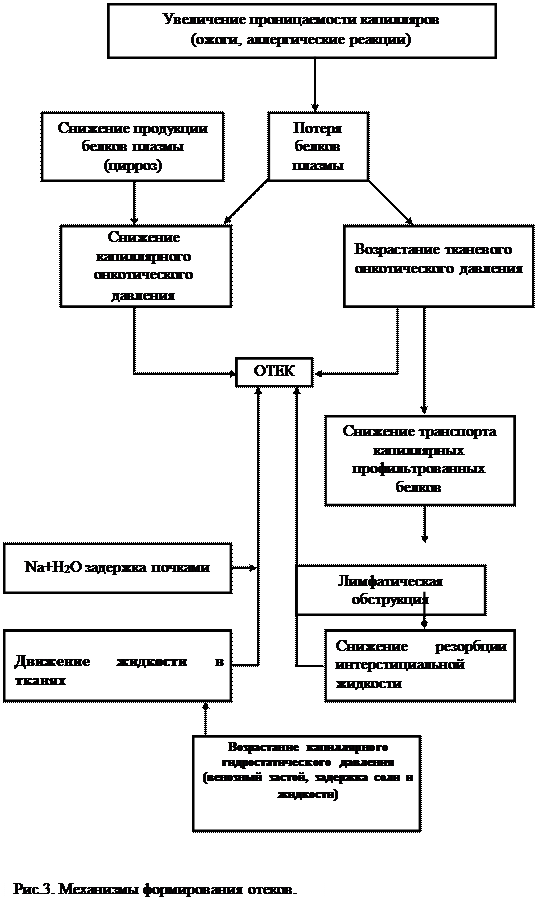
Выделяют несколько патогенетических механизмов формирования отеков, что послужило основанием для их патогенетической классификации: 1) гидростатические; 2) онкотические; 3) осмотические; 4) мембраногенные; 5) лимфогенные; 6) нейроэндокринные (Рис. 3).
 |
|||
 |
|||
1. Роль гидростатического (гемодинамического) фактора. Повышение гидростатического давления на артериальном конце капилляра сопровождается ростом давления и площади фильтрации при одновременном снижении давления и объема реабсорбции из-за роста давления на венозном конце капилляра. Наступает задержка жидкости в ткани. По такому механизму развивается отек при тромбофлебитах, беременности, сердечные отеки и другие.
2. Роль онкотического фактора. Изменения онкотического давления (уменьшение онкотического давления в крови, например, в результате гипопротеинемии или его повышения в тканях) ведут к формированию онкотических отеков. Гипопротеинемия может возникнуть в результате действия многих факторов:
1) дефицит белка в пище,
2) нарушение синтеза альбуминов печенью,
3) избыточная потеря белка почками (протеинурия), с кровью (геморрагии), лимфой (плазморея и лимфорея при ожогах и обширных раневых поверхностях и т.д.).
Гиперонкия – повышение онкотического давления в тканях может быть обусловлена диспротеинемией (нарушение соотношения альбуминов и глобулинов в крови – в норме 2:1). Альбумины могут возмещаться избытком глобулинов, а общее содержание белка остается нормальным. Следует, однако, иметь в виду, что именно альбумины определяют уровень онкотического давления. Гиперонкия межклеточной жидкости, как правило, носит локальный характер, что и определяет регионарную форму отеков. Гиперонкия может возникнуть в результате следующих патологических состояний:
1. Перемещение части белков плазмы в ткань при патологическом повышении проницаемости стенки сосудов;
2. Выход белков из цитоплазмы при альтерации клеток;
3. Повышение гидрофильности белков в межклеточных пространствах под влиянием гипер-  -ионии, гипер-
-ионии, гипер-  -ионии, гистамина, серотонина или дефицита тироксина, ионов кальция.
-ионии, гистамина, серотонина или дефицита тироксина, ионов кальция.
Описанные механизмы играют важную роль в формирования почечных, печеночных и кахектических отеков (нефроз, туберкулез, злокачественные опухоли, болезни эндокринной системы, желудочно-кишечного тракта).
3. Роль осмотического фактора. Отек может возникать вследствие понижения осмотического давления в крови или повышения его в межклеточной жидкости. В принципе, гипоосмия крови возникать может, но быстро формирующиеся при этом тяжелые расстройства гомеостаза опережают развитие отека. Гиперосмия тканей, как и их гиперонкия, носит ограниченный характер. Гиперосмия тканей может возникать в следующих случаях:
1) нарушение вымывания электролитов из тканей вследствие расстройств микроциркуляции;
2) снижение активности транспорта ионов через клеточные мембраны при тканевой гипоксии;
3) массивной утечки ионов из клеток при их альтерации;
4) увеличение степени диссоциации солей при ацидозе.
В ряде случаев возможно постепенное увеличение осмотического давления в интерстициальном пространстве. Подобное наблюдается при длительной активной задержке ионов натрия в организме с последующим накоплением его, а затем и воды в тканях. Активная задержка натрия обычно возникает вследствие расстройства нейроэндокринной регуляции обмена натрия, в частности при избытке альдостерона. Сигналом для запуска цепочки взаимосвязанных изменений – альдостерон ® задержка натрия ® гиперосмия крови ® секреция вазопрессина ® задержка воды – служит снижение объема циркулирующей крови. Наиболее частой причиной острой гиповолемии является кровопотеря, и данный механизм носит компенсаторный характер. Однако подобный сигнал возникает при острой сердечной недостаточности как реакция на снижение систолического выброса. Этот, по сути, ложный сигнал, тем не менее, заставляет срабатывать вышеуказанную цепь событий, приводящих к формированию стойкой гипернатриемии и гиперволемии.
4. Мембраногенный механизм развития отека. Этот вид отека формируется вследствие значительного повышения проницаемости сосудистой стенки. Главными факторами изменения проницаемости могут быть:
1. Перерастяжение стенок микроциркуляторного русла (например, артериальная гипе ремия);
2. Повышение порозности эндотелия под действием медиаторов воспаления и аллергии;
3. Повреждение эндотелия токсинами, гипоксией, ацидозом и т.п.;
4. Нарушение структуры базальной мембраны при активации ферментов.
Повышение проницаемости стенок сосудов облегчает выход из крови жидкости, меняет соотношение площадей фильтрации и реабсорбции в капиллярах. Кроме того, при повышении проницаемости эндотелия белки плазмы получают возможность выходить из плазмы в тканевую жидкость.
5. Лимфогенный фактор. Лимфогенные отеки возникают вследствие значительного снижения оттока жидкости по лимфатическим сосудам. Последнее носит регионарный характер и обусловлено повреждением лимфатических сосудов или лимфузлов (воспаление, тромбоз, паразиты). Частным вариантом таких отеков является слоновость — отек конечности (увеличение их до гигантских размеров), возникающий в результате поражения регионарных лимфузлов паразитами филляриями (филляриоз). В таких случаях отечная жидкость богата белками, которые в норме реабсорбируются лимфатическими капиллярами.
Обычно в формировании отека принимает участие не один, а несколько или все перечисленные факторы, включаясь последовательно по мере нарушения водно-электролитного баланса. Однако среди этих факторов выделяют такой, который выполняет центральную организующую роль. В связи с этим все отеки по их патогенезу условно делят на гемодинамические, онкотические и другие (см. выше). По причинам происхождения выделяют следующие виды отеков:
1) застойные,
2) печеночные,
3) почечные,
4) воспалительные,
5) аллергические,
6) токсические,
7) кахектические,
8) нейроэндокринные.
1. Сердечные отеки. Причиной возникновения сердечных отеков является сердечная недостаточность, которая проявляется, в первую очередь, снижением минутного объема сердца (МОС). На первом этапе вследствие нарастания центрального венозного давления (гемодинамический фактор) снижается реабсорбция жидкости в капиллярах. Клинически на этом этапе отек еще не проявляется, избыток межтканевой жидкости связывается тканевыми коллоидами. Параллельно включается последовательная цепочка нейроэндокринных реакций "волюм-рефлекс ® осмо-рефлекс", запускаемая сигналом с волюм-рецепторов (снижение сердечного выброса) и приводящая к задержке натрия и воды. Этот результат, целесообразный в случае падения объема циркулирующей крови, в данном случае становится основой дальнейшего развития отека.
Гиперволемия усиливает перегрузку пораженного миокарда, способствуя дальнейшему повышению центрального венозного давления. Избыток натрия накапливается в тканях, куда он перемещается из сосудистого русла. Это изменение означает начало второго (собственно отечного) этапа развития отека — скопления избытка свободной воды в межклеточном пространстве, выявляемого клинически. Одновременно активируется почечное звено развития отека: снижение почечного кровотока (обусловленного сердечной недостаточностью) служит сигналом для активации ренин-ангиотензин-альдостеронового механизма, усиливающего задержку воды в организме, и, следовательно, потенцирующего развитие отека.
Недостаточность кровообращения обусловливает развитие гипоксии (вначале гемического, в дальнейшем смешанного типа) и ацидоза. В результате этого усиливаются проницаемость стенок сосудов и выход из них воды в ткани вместе с белками плазмы. С повышением центрального венозного давления нарушается лимфоток, что означает подключение лимфогенного фактора развития отека. Венозный застой в печени и возникающие в ней дистрофические процессы вызывают нарушения ее белково-синтетической функции, что обуславливает гипоонкию крови. Таким образом, сердечный отек в процессе его развития превращается из первоначально гемодинамического в смешанный (Табл. 9).
Таблица 9
Патогенез сердечного отека.
| 1. Уменьшение МОС | Выброс альдостерона | Осмотический отек (нейроэндокринный механизм) |
  2. Венозный застой 2. Венозный застой |
  Повышение венозного давления Повышение венозного давления |
Гидростатический отек |
 3. Повышение давления в устьях полых вен и предсердиях 3. Повышение давления в устьях полых вен и предсердиях |
 Спазм лимфатических сосудов Спазм лимфатических сосудов |
Лимфатический отек |
 4. Нарушение кровообращения в печени и в почках 4. Нарушение кровообращения в печени и в почках |
 Снижение синтеза белков в печени и потеря их почками Снижение синтеза белков в печени и потеря их почками |
Онкотический отек |
 5. Гипоксия в сосудистой стенки и предсердиях 5. Гипоксия в сосудистой стенки и предсердиях |
 Повышение проницаемости капилляров Повышение проницаемости капилляров |
Мембраногенный отек |
2. Почечные отеки (нефритические и нефротические). Нефритический отек развивается при аллергических и воспалительных заболеваниях почек с преимущественным диффузным поражением клубочкового аппарата. Нарушения кровообращения в корковом слое почек обуславливает усиление секреции ренина юкстагломерулярными клетками. В связи с этим включается осмотический фактор развития отека, связанный с активацией системы ренин-ангиотензин-альдостерон-АДГ (антидиуретический гормон), что сопровождается задержкой в организме избытка натрия и воды. Важно иметь в виду, что для диффузного гломерулонефрита характерно повреждение мембран микрососудов и, прежде всего, капилляров во многих органах и тканях организма. Повышение их проницаемости является важным механизмом развития нефритических отеков (Табл. 10).
Таблица 10.
Патогенез нефритических отеков.
 1. Повреждение мембраны иммунными комплексами. 1. Повреждение мембраны иммунными комплексами. |
Генерализованный капиллярит | Мембраногенный механизм | |
 2. Нарушение кровообращения в почках. 2. Нарушение кровообращения в почках. |
 Активация системы «ренин– ангиотензин» Активация системы «ренин– ангиотензин» |
 Выброс альдостерона Выброс альдостерона |
Нейроэндокринный механизм (осмотический) |
  3. Повышение проницаемости для белков плазмы. 3. Повышение проницаемости для белков плазмы. |
Протеинурия; поступление белка в ткани. |   Снижение онкотического давления крови. Снижение онкотического давления крови. |
Онкотический механизм. |
 4. Высокое содержание белков и солей в тканях. 4. Высокое содержание белков и солей в тканях. |
Повышенная гидрофильность тканей. | Осмотический механизм. | |
 5. Отставание лимфооттока от транссудации. 5. Отставание лимфооттока от транссудации. |
  Динамическая лимфатическая недостаточность. Динамическая лимфатическая недостаточность. |
Лимфогенный механизм. |
Нефротический отек. Он возникает вследствие преимущественного поражения тубулярного (канальцевого) аппарата почек. Для нефроза характерна длительная массивная потеря белка с мочой (протеинурия), которая ведет к гипопротеинемии и соответственно гипоонкии и, как следствие, увеличение фильтрации и снижение реабсорбции воды в капиллярах органов и тканей. В силу этого избыток воды в тканях сочетается с увеличением клубочковой фильтрацией в почках. При значительном выходе жидкости из сосудистого русла в ткани развивается гиповолемия, что служит сигналом для включения нейроэндокринных механизмов регуляции объема жидкости (волюм-рефлекс – осмо-рефлекс) и приводит к задержке в организме натрия и воды. Однако ограничение выведения воды с мочой приводит к дальнейшему потенцированию почечного отека, поскольку гипоонкия крови сохраняется (и даже может увеличиваться в связи с гемодилюцией). "Сэкономленная" почками жидкость не удерживается в крови и переходит в ткани (Табл. 11).
Таблица 11.
Патогенез почечных отеков при нефрозе.
  1. Нарушение реабсорбции белка из-за поражения канальцев. 1. Нарушение реабсорбции белка из-за поражения канальцев. |
Альбуминурия. |  Гипопротеинемия. Гипопротеинемия. |
Онкотический механизм. |
 2. Отставание лимфооттока от транссудации. 2. Отставание лимфооттока от транссудации. |
 Динамическая лимфатическая недостаточность. Динамическая лимфатическая недостаточность. |
Лимфогенный механизм. | |
   3. Уменьшение объема циркулирующей крови за счет перехода ее в ткани и полиурии. 3. Уменьшение объема циркулирующей крови за счет перехода ее в ткани и полиурии. |
 Выброс альдостерона. Выброс альдостерона. |
Осмотический механизм. | |
| 4. Нарушение обмена белков, мукополисахаридов. | Повышение проницаемости капилляров. | Мембраногенный механизм. |
Таблица 12.
Патогенез асцита при циррозе печени.
 1. Повышение давления в системе воротной вены. 1. Повышение давления в системе воротной вены. |
Гидростатический отек. |
 2. Снижение инактивации альдостерона. 2. Снижение инактивации альдостерона. |
Осмотический отек. |
 3. Снижение выработки альбуминов. 3. Снижение выработки альбуминов. |
Онкотический отек. |
 4. Динамическая лимфатическая недостаточность. 4. Динамическая лимфатическая недостаточность. |
Лимфогенный отек. |
 5. Повышение проницаемости капилляров. 5. Повышение проницаемости капилляров. |
Мембраногенный отек. |
Таблица 13.
Значение отека для организма.
| Повреждающее. | Защитное. |
| 1. Сдавление ткани и нарушение в ней кровообращения. | 1. Уменьшение всасывания токсических веществ (воспаление, аллергия). |
| 2. Отечные ткани легче инфицируются. | 2.Разбавление токсинов, снижение их патогенного действия. |
| 3. При сердечной недостаточности – обезвоживание или водное отравление клеток. | 3. При сердечной недостаточности – разгрузка сердца за счет задержки жидкости в тканях. |
IV. НАРУШЕНИЕ ОБМЕНА ЭЛЕКТРОЛИТОВ
У человека они часто являются следствием нарушения водного баланса. Нарушения обмена катионов и анионов вызывают значительные сдвиги во внутренней среде организма. Нарушения концентрации электролитов в экстрацеллюлярных средах обусловливают изменения осмолярности, вызывают патологическое перемещение воды из одного водного пространства в другое, сопровождаются сдвигами в кислотно-основном состоянии и биоэлектрических потенциалов. Такая взаимосвязь прежде всего касается нарушения баланса натрия. Гипер- или гипогидратация неизбежно сопровождаются гипо- или гипернатриемией. Гипергидратация или дегидратация клеток ведут к нарушению баланса внутриклеточных ионов, прежде всего, калия.
Таблица 14.
Приблизительные концентрации электролитов в жидкостях организма.
| Жидкости |  (мЭкв/л) (мЭкв/л) |
 (мЭкв/л) (мЭкв/л) |
 (мЭкв/л) (мЭкв/л) |
 (мЭкв/л) (мЭкв/л) |
| Слюна | ||||
| Желудочный сок | ||||
| Желчь | ||||
| Панкреатический сок | ||||
| Тонкокишечная жидкость | ||||
| Слепая кишка | ||||
| Цереброспинальная жидкость | ||||
| Пот |
Таблица 15.
Распределение электролитов в различных векторах тела.
| Экстрацеллюлярная жидкость, (мЭкв/л) | Интрерцеллюлярная жидкость, (мЭкв/л) | |
| Катионы: Натрий Калий Кальций Магний Общее | ||
| Анионы Бикарбонаты Хлориды Фосфаты Белки Другие анионы Общее | 40 – 95 31 – 86 |
Ионный состав жидкости каждого водного сектора различный, но в любом из низ она электронейтральна из-за эквивалентной концентрации катионов и анионов.
Электролиты обеспечивают 96-94% осмолярности плазмы;  обеспечивает 50% осмотического давления во внеклеточной жидкости.
обеспечивает 50% осмотического давления во внеклеточной жидкости.
IV. 1. НАРУШЕНИЯ БАЛАНСА НАТРИЯ.
Концентрация Na+ в плазме равна 137-147 ммоль/л. Нарушение баланса Nа+ выражается в виде гипернатриемии и гипонатриемии.
Положительный баланс Na+ обычно сопровождается увеличением ОЦК, а отрицательный дисбаланс – вызывает снижение объема плазмы крови. У здорового человека основная часть поступившего за сутки в организм натрия (155 ммоль) выводится почками (150 ммоль) за счет разности между количеством фильтруемого и реабсорбируемого иона. Осмолярность мочи может колебаться в пределах 50 – 1400 мосм/л. Эта способность почек регулируется АДГ. Выброс АДГ стимулируется:
· раздражением осморецепторов (при увеличении осмотического давления крови);
· возбуждением симпатического отдела нервной системы – болевой, эмоциональный стресс;
· гипертермией;
· фармакологическими средствами (наркотиками, барбитуратами).
Уровень натрия в плазме крови регулируется альдостероном (антагонисты альдостерона являются простагландины Е).
Гипернатриемия – увеличение уровня Na+ плазмы выше 147 ммоль/л. Избыток Na+ в организме может быть абсолютным и относительным. Относительное увеличение содержания Na+ является обычно результатом дегидратации и возникает вследствие:
· недостаточного поступления воды в организм;
· избыточной потери воды через кожу при избыточном потоотделении, через пищеварительный тракт (диарея), почки (полиурия при несахарном диабете или осмотический диурез при гипергликемии), при лихорадке, альвеолярной гипервентиляции;
· сгущение крови вследствие перехода воды из сосудистого русла в ткани при повышении в них онкотического давления – в условиях распада тканей.
Абсолютный избыток натрия может отмечаться у человека в условиях гипергидратации и даже гиперосмолярной гипогидратации. Причинами гипернатриемии могут быть:
1) Избыточное поступление натрия в организм:
· а) алиментарно – при длительном приеме избыточного количества хлорида натрия с пищей или минеральной водой. Это является фактором риска развития артериальной гипертензии, сердечной недостаточности;
· б) неконтролируемая инфузия растворов хлорида натрия или бикарбоната натрия в условиях недостаточной функции почек.
2) Задержка выведения натрия из организма – нарушение экскреции Na+ почками при хроническом гломерулонефрите с нефротическим синдромом.
3) нарушения механизмов регуляции содержания Na+:
· а) гиперальдостеронизм
· первичный (синдром Кона);
· вторичный (цирроз печени – нарушение разрушения альдостерона, недостаточность кровообращения);
· б) гиперкортицизм (синдром Иценко-Кушинга, терапия глюкокортикоидами);
· в) гиперсекреция ренина и последующая активация ангиотензина-2.
Повышение содержания натрия в крови вызывает рост осмотического давления крови. Это приводит к увеличению продукции АДГ, задержке жидкости в организме и увеличению ОЦК. Это, в свою очередь, сопровождается повышением артериального давления, ростом гидростатического давления в капиллярах клубочков почек, снижением онкотического давления крови и увеличением клубочковой фильтрации. Избыток Na+ может устраняться почечной экскрецией катиона (Рис. 4).

В клинической картине преобладают явления, обусловленные гиперволемией и гиперосмолярностью плазмы. Гиперволемия обусловлена поступлением во внеклеточное пространство дополнительного количества воды, что ведёт к повышению АКД. Кроме того, АКД повышается вследствие роста периферического сопротивления из-за увеличения чувствительности сосудистой стенки к вазоконстрикторным влияниям, а также утолщению стенок резистентных сосудов и уменьшению вследствие этого их просвета. Из-за гиперосмолярности плазмы возникает клеточная дегидратация — вторичное движение воды из внутриклеточного сектора в околоклеточное пространство. Формирующаяся жажда связана с гиперосмолярностью и клеточной дегидратацией.
Гипернатриемия может сопровождаться развитием алкалоза (экзогенный алкалоз при избыточном приёме бикарбоната натрия, или почечный алкалоз при избыточной продукции минералокортикоидов).
Возможно развитие лихорадки, тахикардии, мозговых расстройств, судорог.
Одним из классических проявлений избытка  являются отеки, в генезе которых ведущую роль имеют повышение реабсорбции натрия и воды в почечных канальцах с последующей задержкой их в организме (сердечная недостаточность, цирроз печени).
являются отеки, в генезе которых ведущую роль имеют повышение реабсорбции натрия и воды в почечных канальцах с последующей задержкой их в организме (сердечная недостаточность, цирроз печени).
Гипонатриемия Гипонатриемия – это уменьшение уровня Na+ в плазме ниже 135-137 ммоль/л. Дефицит натрия в организме может быть абсолютным и относительным. Относительный дефицит натрия является следствием избытка воды, гемодилюции, т.е. возникает при гипоосмолярной гипогидратации:
· избыточного приема воды или парентерального введения или парентерального введения больших количеств изотонических жидкостей (5% раствора глюкозы);
· снижения функции почек;
· перемещения воды из межтканевых пространств в кровеносное русло в период схождения отеков.
Абсолютный дефицит натрия может быть связан:
1. С недостаточным поступлением натрия с пищей. Алиментарная гипонатриемия встречается редко (голодание, бессолевая диета, в результате приема большого количества калия).
2. С избыточными потерями натрия:
а) через желудочно-кишечный тракт (рвота, диарея, длительное зондирование, кишечные свищи; например, при рвоте в течение суток теряется 15% всего содержащегося в организме натрия);
б) потери натрия почками вследствие нарушений реабсорбции катиона в канальцах нефронов («сольтеряющая почка»), которые могут быть обусловлены расстройством чувствительности тубулярного аппарата к Na+, альдостерону, блокаде карбоангидразы диуретиками типа диакарба, приёмом сульфаниламидов (за сутки реабсорбируется до 500 г натрия, 80% — проксимальными, 18-19% — дистальными канальцами, 1% – теряется);
в) потери через кожу вследствие обильного потоотделения;
г) ожоги, травмы.
3. Нарушение механизмов регуляции содержания Na+:
а) надпочечниковая недостаточность с дефициром альдостерона (болезнь Аддисона);
б) вследствие натрийуретического эффекта простагландинов группы Е.
4. Гипоксия в условиях сахарного диабета из-за развития внутриклеточного ацидоза и накопления ионов Н+.
Компенсаторно Н+ ионы выходят в околоклеточное пространство в обмен на катионы Na+, однако, внеклеточная вода не идет в клетку за Na+ из-за того, что она удерживается глюкозой и кетоновыми телами, увеличивая степень гипонатриемии.
Патогенез возникающих в организме нарушений. Гипонатриемия сопровождается компенсаторным ввыведением из организма воды, что приводит к уменьшению объема плазмы, гиповолемии, дегидратации. Дегидратация, в свою очередь, может явиться причиной развития почечной недостаточности. Компенсаторные реакции организма способствуют ограничению почечной секреции Na+ и увеличению его потребления (солевой аппетит). Гиповолемия при гипонатриемии сопровождается падением артериального кровяного давления, тахикардией. Гипоосмолярность плазмы включает механизмы движения воды в клетку, формируется клеточная гипергидратация — клеточный отек. Из-за сдвигов клеточного гомеостаза возможно нарушение электрогенеза (снижение возбудимости, мышечная слабость и т.д.), что вносит определенный вклад в расстройство функции сердечно-сосудистой и нервной систем.
При развитии сердечной недостаточности возможно нарушение электрогенеза в кардиомиоцитах, тогда из клеток в околоклеточное пространство выходит К+, а взамен в цитоплазму поступает ион Na+. Создается угроза развития гиперкалиемического ацидоза со всеми вытекающими отсюда последствиями.
При выраженной недостаточности Na+ наблюдаются поведенческие и неврологические изменения: гипорефлексия, апатия, нарушение сознания, судороги, кома, коллапс, тошнота, рвота.
 |
Источник: studopedia.su
Общие сведения
Отек головного мозга развивается на фоне ишемического или геморрагического инсульта, черепно-мозговых травм, повышает вероятность летального исхода. Состояния развивается из-за недостаточности мембранных транспортеров и гематоэнцефалического барьера. При развитии отека сочетаются цитотоксические, ионные и вазогенные механизмы. Для лечения используют декомпрессионную краниэктомию и осмотерапию. Но эти методы не влияют на патологический молекулярный каскад, приводящий к отеку.
Причины отека головного мозга
Отек головного мозга возникает на фоне различных неврологических и других патологических состояний:
- Энцефалиты из-за укуса клещей, в качестве осложнений после гриппа.
- Инфекционные факторы нейроцистицеркоз (паразитарное поражение головного мозга), церебральная малярия или менингиты.
- Инсульты ишемические, геморрагические и эмболические.
- Гидроцефалия, как последствие менингита или травм.
- Ишемическая энцефалопатия при родовых травмах, высоком артериальном давлении, атеросклерозе.
- Венозный тромбоз внутричерепных синусов.
- Опухоли головного мозга.
К заболеваниям, провоцирующим отек мозга, относится диабетический кетоацидоз, печеночная недостаточность, нарушения электролитного баланса. Симптомы отека мозга могут проявиться не сразу.
Церебральный отек у детей с гидроцефалией связан с увеличенным внутричерепным давлением.

Кто в группе риска
К группе высокого риска относятся люди с тяжелой формой диабетического кетоацидоза, а также дети, у которых ацидоз произошел впервые. Факторами, повышающими вероятность отека, являются: обезвоживание, воспалительный процесс и сгущение крови.
В результате снижается приток крови к головному мозгу, возникает каскад реакций ишемии и отека. Повышается внутричерепное давление, снижается артериальное давление и частота сердечных сокращений. Грыжа мозга может сжимать жизненно важные структуры в стволе мозга. Пациенты с гиперактивным течением кетоацидоза подвержены большему риску. Высокие уровни аммиака выше 200 мкмоль/л в крови могут быть индикатором риска развития внутричерепной гипертензии.
При гепатической энцефалопатии к церебральному отеку приводит снижение перфузионного давления сосудах мозга, отек клеток астроцитов из-за скопления аммиака и повышения выработки глутамина. На фоне отека растет внутричерепное давление, развивается ишемический ушиб и грыжа мозга.
Зачастую отек мозга развивается у детей, перенесших гипоксию, и имеющих гидроцефалию. Церебральная эдема может осложнять течение инсультов и черепно-мозговых травм.
Патогенез
Набухание головного мозга — это ступенчатый процесс, при котором острое повреждение приводит к образованию цитотоксического, ионного или вазогенного отека. Что такое отек? Это комбинация патогенетических механизмов. Цитотоксический отек характеризуется истощением внутриклеточного аденозинтрифосфата (АТФ), который нарушает активный транспорт осмолитов через клеточные мембраны. В клетках происходит накопление ионов натрия и воды.
На поверхности клеточных мембран нарушается давление и соотношение ионов, что приводит движению жидкости во внеклеточное пространство паренхимы мозга из сосудов. Этот механизм еще называется ионным. При ушибах мозга повышается активность ионного канала Sur1-Trpm4 в эндотелиальных клетках, что приводит к скоплению жидкости.
Отдельная форма цитотоксического отека – вазогенный. Патология развивается из-за повышенной проницаемости гематоэнцефалического барьера головного мозга после ушиба, выброса воспалительных веществ при инфекции и увеличения свободных радикалов. В результате происходит выделение жидкости вне клетки вместе с протеинами плазмы крови.

По мере развития ушиба мозга данные механизмы сменяют и дополняют друг друга, приводя к набуханию. Считается, что отеку предшествует повышение внутричерепного давления из-за фиксированного объема закрытой полости черепа. Одновременно снижается капиллярная перфузия – давление крови в сосудах мозга. Ткани недополучают питательные вещества и кислород, развивается гипоксемия.
Классификация
Отек головного мозга возникает из-за увеличенного содержания мозговой жидкости. В патогенезе развития эдемы условно разделяют три формы: цитотоксическую, вазогенную и интерстициальную или их комбинацию.
Вазогенный отёк
Вазогенный отек – наиболее распространенная форма, вызванная нарушением гематоэнцефалического барьера. Белки плазмы проникают за пределы сосудов, из-за чего осмотическое давление нагнетает жидкость в интерстициальное пространство головного мозга. Например, эндотелиальный фактор роста, глутамат и лейкотриены локально повышают проницаемость клеток вокруг опухоли. Именно это, наряду со слабостью сосудистых стенок, приводит к попаданию жидкости с белками в паренхиму белого вещества. Отеки возле опухолей в 65% приводят к когнитивным нарушениям у пациентов из-за смещения мозговых структур.
Вазогенный отек провоцируется нарушением проницаемости сосудов и изменением перфузионного давления на фоне следующих заболеваний и состояний:
- абсцесс мозга;
- инсульт;
- гиперкапния;
- энцефалопатия на фоне гипертонии;
- гепатическая энцефалопатия;
- метаболические нарушения;
- диабетический кетоацидоз;
- отравление свинцом;
- горная болезнь.
Патогенные микроорганизмы при менингитах нарушают проницаемость гематоэнцефалического барьера для белков и ионов натрия. Это приводит к накоплению жидкости в межклеточном пространстве, а также набуханию клеток из-за пассивной гипоксии. Повышенное внутричерепное давление нарушает связи между нейронами.
Цитотоксический отёк
Клеточный или цитотоксический отек возникает внутри клеток без повреждения гематоэнцефалического барьера. Развивается патология после инсульта или черепно-мозговой травмы с повреждением глиальной ткани, нейронов и эндотелиальных клеток. В клетках нарушается гемостатический механизм, и натрий накапливается в них, нарушается выход ионов за пределы оболочки. Анионы стараются восстановить нейтральность на поверхности мембраны, что приводит к отеку внутри клетки.
Цитотоксический связан с изменением ионного баланса на поверхности клеточных мембран в результате нескольких причин:
- гипоксическая ишемическая травма головного мозга (при утоплении, остановке сердца);
- травма головного мозга;
- метаболические нарушения обмена органических кислот;
- гепатическая энцефалопатия;
- синдром Рея (острая печеночная недостаточность);
- инфекции (энцефалиты и менингиты);
- диабетический кетоацидоз;
- интоксикации (аспирином, этилен гликолем, метанолом);
- гипонатриемия или избыточное потребление воды без электролитов.
Интерстициальный отёк
Одна из основных причин интерстициального отека – обструктивная гидроцефалия. Интерстициальный отек развивается из-за подтекания спинномозговой жидкости из желудочков мозга в интерстициальное пространство мозга. Пациенты с гидроцефалией или менингитом предрасположены к данной патологии. Увеличенное давление в желудочках приводит к вытеснению содержимого желудочков, что приводит к отеку белого вещества.
Симптомы отека головного мозга
Отек мозга в зависимости от степени изменений может быть бессимптомным или симптоматическим. Тяжесть проявлений зависит от возраста человека. У детей отек компенсируется наличием родничков, и потому симптоматика отличается.
Отек головного мозга имеет различные проявления:
- изменения сознания, в том числе кома;
- головные боли и мигрени;
- эпилепсия;
- интоксикация;
- кишечная непроходимость (заворот кишки, инвагинация)
- неврит зрительного нерва;
- гипертрофический пилоростеноз
- макроцефалия.
Общемозговые симптомы связаны с повышением внутричерепного давления:
- При медленном повышении пациентов беспокоят утренние головные боли, рвота без тошноты, что характерно для опухолей головного мозга. Возникают преходящие головокружения. Медленно меняется поведение: пациенты становятся раздражительными, капризными.
- При быстром повышении боль приступообразная, распирающая, сильная. Рвота не дает облегчения. У пациентов повышаются сухожильные рефлексы, замедляется сердцебиение и двигательные реакции. Меняются движения глаз, наступает сонливость, нарушается речь и мышление.
При декомпенсации повышенного внутричерепного давления развивается кома, а при смещении структур мозга – нарушение дыхания, сердечных сокращений.
Диагностика отека мозга
Ранняя диагностика отека мозга снижает смертность и улучшает функциональные возможности пациентов после ишемического инсульта. При установлении патологии проводят декомпрессионную трепанацию. Нарастание отека мозга можно определить по симптомам увеличения внутричерепного давления: учащения эпизодов потери сознания, тошноты и рвоты, головной боли, нарушению зрения, гемипарезу. Среди перечисленных признаков именно бессознательное состояние, связанное с поражением ретикулярной активирующей системы и таламо-гипоталамической-кортикальной оси, считается самым важным клиническим параметром. Степень поражения сознания измеряется по шкале комы Глазго.
При геморрагическом инсульте существуют другие критерии оценки риска отека мозга. Вероятность увеличения гематомы возрастает при изначальном значительном ее размере, использовании антикоагулянтов, раннем появлении симптомов. Риск развития отека увеличивается при гипергликемии, повышенном артериальном давлении, большом размере гематомы и увеличении перфузионного церебрального давления.
Лечение отека головного мозга
Задача интенсивной терапии – поддерживать дыхание и нормальные показатели гемодинамики. Голова пациента находится на возвышении на высоте 30 градусов для оттока венозной крови. Начинают раннее энтеральное питание.
Применяются следующие методы терапии:
- искусственная вентиляция легких при симптомах дислокации мозга;
- гипервентиляция при условии мониторинга уровня насыщения кислородом крови;
- введение гиперосмолярных растворов;
- барбитуратовая кома;
- трепанация черепа;
- гипотермия (снижение температуры тела).
Протоколы терапии отека зависят от его причины. При вазоспазме важно увеличение объема плазмы крови, а при гиперемии – диуретики и гипервентиляция.
Консервативные методы
Осмотерапия – это базовая медикаментозной терапия при отеках головного мозга. Ее редко используют для профилактики из-за ограниченной эффективности из-за раннего применения. Гиперосмолярные средства создают внутрисосудистый осмотический градиент, который облегчает выведение воды. Чаще всего применяют маннитол и гипертонический физиологический раствор. Последний помогает расширить внутрисосудистый объем, увеличить сократимость сердца и внутричерепное давление.
Осмотический диурез с маннитом может вызвать внутрисосудистую дегидратацию и гипотензию, и после него необходимо обеспечить адекватную замену жидкости изотоническими растворами. Длительное повторное применение гипертонического физиологического раствора приведет к развитию гиперхлоремического метаболического ацидоза. Потому средства используют в качестве альтернативы для лечения симптоматического отека мозга.
Хирургические методы
Хирургическое вмешательство позволяет избежать летальных исходов при обширных полушарных инсультах. Особенно у пациентов в возрасте до 60 лет, если процедура проводится на протяжении 48 часов после появления симптомов. Декомпрессионная хирургия проводится на ранней стадии развития отека, удаляется костный диаметром не менее 12 см. После декомпрессии врачи следят за развитием субдурального кровоизлияния, наружной гидроцефалии, предотвращают инфицирование раны и расхождения кровеносных сосудов.
Хирургия применяется для удаления образования, которое вызывает отек мозга – внутримозговой гематомы, абсцесса или опухоли. Удалению подлежат гематомы в коре размерами более 3 см, а также в области мозжечка – более 2 см.
Особенности терапии цитотоксического отёка
Лечение цитотоксического отека проводят с помощью маннитола или другого осмодиуретика. Маннитол используют в дозировке 0,5-1 г на килограмм массы тела внутривенно. Эффективность осмотических средств сохраняется первые 48-72 часов. При цитотоксическом отеке стараются не снижать артериальное давление, если сохранены механизмы ауторегуляции. Внутривенно вводят растворы для увеличения объема циркулирующей крови, проводят вазопрессорную терапию. Подход применяют при сохранении гематоэнцефалического барьера. Барбитуровый наркоз уменьшает отечность. Тиопентал натрия вводят для снижения внутричерепного давления ниже 20 мм рт. ст.
Особенности терапии вазогенного отёка
Вазогенный отек требует использования ангиопротекторных препаратов. Эсцинулизинат восстанавливает тонус сосудистых стенок, усиливает реабсорбцию и снижает интерстициальный отек. При вазогенных отеках используют глюкокортикоиды для снижения проницаемости гематоэнцефалического барьера. Обычно дексаметазон вводят одновременно с антибиотиками при менингитах. Маннитол при вазогенном отеке наоборот усиливает поступление жидкости в ткани. Для защиты паренхимы мозга применяют антиоксиданты и средства для улучшения метаболизма (актовегин, кортексин).
Прогноз
Отек мозга после инсульта у взрослых развивается под действием ряда факторов. К эпидемиологическим относится история гипертонии или ишемической болезни сердца в анамнезе. Важный клинический критерий — оценка по неврологической шкале NIHSS при инсульте выше 20 в доминирующем полушарии или более 15 в не доминирующем. Развитие тошноты и рвоты первые сутки после инсульта. Систолическое артериальное давление выше 180 мм рт.ст. первые 12 часов после приступа. Снижение реакций на раздражители.
Определить риск отека мозга можно по МРТ:
- окклюзия крупных артерий;
- поражение большого количества сосудов;
- аномалии Виллизиева круга.
- очаг инфаркта более 82 мл спустя 6 часов после появления симптомов;
- очаг более 145 ил спустя 14 часов после первых признаков.
При черепно-мозговых травмах еще до госпитализации важно приступить к нейропротекторной терапии, введению кортикостероиодов и диуретиков, что улучшает прогноз у молодых пациентов.
Какие варианты развития возможны
Зависимо от распространения отека выделяют три синдрома его развития:
- Общемозговой – связан с ростом внутричерепной гипертензии. Головная боль, рвота, нарушения зрения, снижение пульса на фоне роста САД и нарушение мышления.
- Синдром рострокаудального нарастания – распространение отека на кору, подкорковые структуры и ствол мозга. При повреждении коры появляются судороги, подкорковых областей – гиперкинезы, патологические рефлексы. Нарушение сознания означает повреждение гипоталамуса. Стволовые повреждения проявляются угнетением дыхания и сердечно-сосудистой деятельности.
- Синдром дислокации проявляется выпадением функции глазодвигательных нервов, ригидностью мышц затылка, нарушением глотания.
При вклинении ствола мозга в большое затылочное отверстие многие изменения необратимы.
Последствия отека мозга
Осложнения отека мозга связаны с присоединением инфекции в виде пневмонии, пиелонефритов и менингитов. Развиваются трофические нарушения, тромбозы.
Чем опасен отек? При компрессии ствола возможно развитие паралича. Даже после оптимального лечения и восстановления остаются спайки в мозговых оболочках, что приводит к депрессии, головным болями. Последствия отека головного мозга включают психические расстройства, снижение когнитивных функций.
Источник: jneuro.ru
