Кетоацидоз
Биологическая роль КТ
КТ — хорошие топливные молекулы, окисление β-гидроксибутирата до СО2 и Н2О обеспечивает быстрый синтез 26 молекул АТФ. Окисление КТ, как и ЖК сберегает глюкозу, что имеет большое значение в энергоснабжении аэробных тканей при длительном голодании и физических нагрузках, когда возникает дефицит глюкозы. Для нервной ткани КТ имеют исключительное значение, так как в отличие от мышц и почек, нервная ткань практически не использует ЖК в качестве источника энергии, так как ЖК не проходят гематоэнцефалический барьер.
Преимущество КТ перед ЖК: 1) КТ водорастворимы, а ЖК – нет; 2) ЖК разобщают окислительное фосфорилирование и усиливают синтез ТГ, а КТ – нет.
Ацетон, в отличие от β-оксибутирата и ацетоацетата, не утилизируется тканями. Он выделяется с выдыхаемым воздухом, мочой и потом, что позволяет организму избавляться от избытка КТ, которые не успели вовремя окисляться.
В норме концентрация КТ в крови составляет 1—3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации КТ в крови называют кетонемией. При кетонемии развивается кетонурия — выделение КТ с мочой. Накопление КТ в организме приводит к кетоацидозу, так как КТ (кроме ацетона) являются водорастворимыми органическими кислотами (рК~3,5).
Ацидоз достигает опасных величин при сахарном диабете, так как концентрация КТ при этом заболевании может доходить до 400—500 мг/дл. Тяжёлая форма ацидоза — одна из основных причин смерти при сахарном диабете.
Холестерин (ХС) — стероид, характерный только для животных организмов.
Источником ХС в организме являются синтетические процессы и пища. В сутки в организме синтезируется около 1г (0.7) ХС. В печени синтезируется более 50% ХС, в тонком кишечнике — 15— 20%, остальной ХС синтезируется в коже, коре надпочечников, половых железах. С пищей поступает в сутки 0,3—0,5г (0.3-0.4) ХС. Общее содержание ХС в организме составляет в среднем 140г, 90-93% находиться в клетках, 7-10% — в крови (5,2+1,3 ммоль/л).
Биологическая роль ХС
1. ХС входит в состав всех мембран клеток, увеличивает их электроизоляционные свойства, придает им жесткость и прочность;
2. В мембране ХС защищает полиненасыщенные ЖК от окисления;
3. из ХС синтезируются жёлчные кислоты (0,5-0,7 г ХС в сут) 0.45, стероидных гормоны (половые и кортикоиды) (40 мг ХС в сут) и витамин Д3 (10 мг ХС в сут).
4. ХС является компонентом желчи.
Обмен ХС чрезвычайно сложен, в нем участвует около 300 разных белков.
Синтез ХС
Реакции синтеза ХС происходят в цитозоле и ЭПР клеток. Это один из самых длинных метаболических путей в организме человека (около 100 последовательных реакций).
Синтез ХС делят на 3 этапа:
I этап синтеза ХС — образование мевалоната (мевалоновой кислоты).
1. Две молекулы ацетил-КоА конденсируются тиолазой с образованием ацетоацетил-КоА;
2. Гидроксиметилглутарил-КоА-синтаза присоединяет третий ацетильный остаток к ацетоацетил-КоА с образованием ГМГ-КоА (3-гидрокси-3-метилглутарил-КоА). Эта последовательность реакций сходна с начальными стадиями синтеза КТ. Однако синтез КТ происходит в митохондриях печени, а реакции синтеза ХС — в цитозоле клеток.
3. ГМГ-КоА-редуктаза восстанавливает ГМГ-КоА до мевалоната с использованием 2 молекул НАДФH2. Фермент ГМГ-КоА-редуктаза — гликопротеин, пронизывающий мембрану ЭПР, активный центр которого выступает в цитозоль.
II этап синтеза ХС — образование сквалена
1. Мевалонат превращается в изопреноидную структуру — изопентенилпирофосфат (5 атомов С);
2. 2 изопентенилпирофосфата конденсируются в геранилпирофосфат (10 атомов С);
3. Присоединение изопентенилпирофосфата к геранилпирофосфату дает фарнезилпирофосфат (15 атомов С).
4. 2 фарнезилпирофосфата конденсируются в сквален (15 атомов С).
III этап синтеза ХС — образование ХС
Сквален циклазой превращается в ланостерол, (4 цикла и 30 атомов С).
Далее происходит 20 последовательных реакций, превращающих ланостерол в ХС (27 атомов С).
В организме человека изопентенилпирофосфат также служит предшественником убихинона (KoQ) и долихола, участвующего в синтезе гликопротеинов.
Регуляция синтеза ХС
Ключевой фермент синтеза ХС ГМГ-КоА-редуктазы регулируется несколькими способами:
· ХС, желчные кислоты (в печени) репрессируют ген ГМГ-КоА-редуктазы. В норме поступление ХС с пищей снижает синтез собственного ХС в печени, однако с возрастом эффективность этой регуляции у многих людей снижается и уровень ХС повышается.
· Инсулин через дефосфорилирование осуществляет активацию ГМГ-КоА-редуктазы.
· Глюкагон через фосфорилирование осуществляет ингибирование ГМГ-КоА-редуктазы.
Повышение концентрации исходного субстрата ацетил-КоА стимулирует синтез ХС.
Таким образом, синтез ХС активируется при питании углеводами и ингибируется при голодании.
Этерификация ХС
ХС образует с ЖК сложные эфиры (ЭХС), которые более гидрофобны чем сам ХС. В клетках эту реакцию катализирует АХАТ (ацилКоА: холестеролацилтрансферазой): ХС + АцилКоА → ЭХС + HSKoA
АХАТ содержится лишь в некоторых тканях, синтезированный им ЭХС формирует в цитоплазме липидные капли, которые являются формой хранения ХС. По мере необходимости ЭХС гидролизуются холестеролэстеразой на ХС и ЖК.
ЭХС синтезируются также в крови в ЛПВП под действием ЛХАТ (лецетин: холестеролацилтрансферазой): ХС + лецитин → ЭХС + лизолецитин
В составе ЛП ЭХС обеспечивают большую часть транспорта ХС в крови. На долю ЭХС крови приходиться 75% от общего количества ЭХС в организме.
Выведение ХС из организма
Так как производные циклопентанпергидрофенантрена (стероиды) водонерастворимы и в организме не расщепляются, они выводятся из организма в основном с калом в составе желчи и немного с потом через кожу.
В сутки из организма выводится от 1,0г до 1,3г ХС. ХС выводится с желчью (0,5-0,7 г/сут) в основном в виде жёлчных кислот и частично в чистом виде. Часть ХС в кишечнике под действием ферментов бактерий восстанавливается по двойной связи, образуя холестанол и копростанол. С кожным салом в сутки выделяется 0,1г ХС.
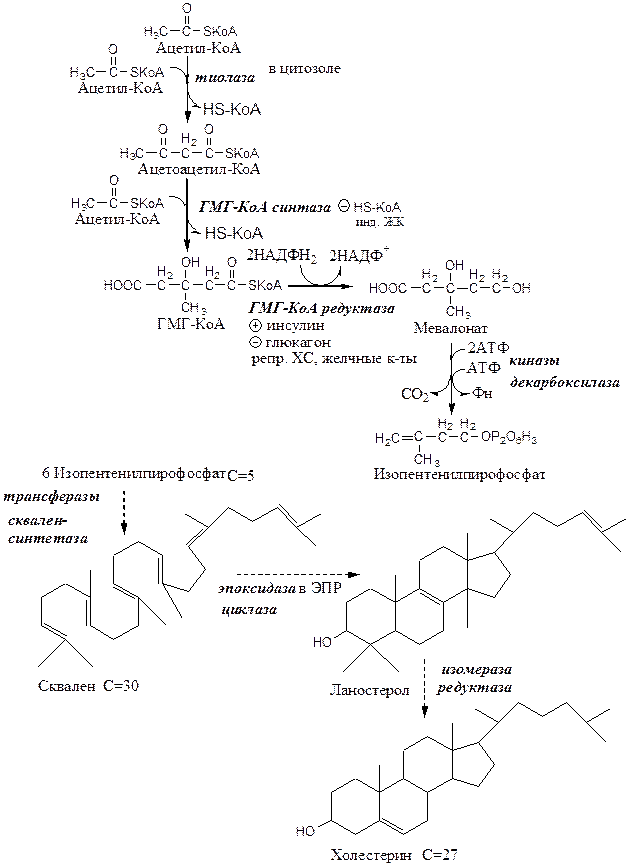
ГИПЕРХОЛЕСТЕРОЛЕМИЯ
Концентрация ХС в крови взрослых составляет 5,2+1,2 ммоль/л, как правило, с возрастом она увеличивается. Нарушения обмена ХС чаще всего проявляется гиперхолестеролемией, повышением ХС в крови выше нормы.
Причины развития гиперхолестеринемии:
1. Избыточного поступления с пищей ХС. Так как выведение из организма ХС ограничено 1,2—1,5 г/сут, излишки ХС накапливаются;
2. Переедание, недостаточная физическая активность, ожирение, сахарный диабет и гипотериоз способствуют гипергликемии и гиперлипидемии. Избыток углеводов и липидов в организме идет на повышенный синтез ХС;
3. Избыток в пище насыщенных и дефицит полиненасыщенных ЖК стимулирует в организме синтез ХС;
4. Некоторые дислипопротеинемии. Любой дефект рецептора ЛПНП (часто) или белка апоВ-100, взаимодействующего с ним, приводит к распространённому наследственному заболеванию — семейной гиперхолестеролемии. Она сопровождается ксантоматозом и атеросклерозом. У гомозигот с дефектом рецептора ЛПНП смерть в возрасте 5—6 лет от инфаркта или инсульта;
Коэффициент атерогенности = (ХСобщ –ХСЛПВП) / ХСЛПВП < 3
Гиперхолестеринемия вызывает атеросклероз и желчекаменную болезнь.
АТЕРОСКЛЕРОЗ
Атеросклероз – хроническое прогрессирующее заболевание крупных и средних эластических и мышечно-эластических артерий. Атеросклероз характеризуется пролиферативно-синтетическим ответом ряда клеток сосудистой стенки и крови – гладкомышечных макрофагов, тромбоцитов, фибробластов на патологические (качественно своеобразные или количественно избыточные) ЛП, с формированием в интиме фиброатером.
Причины развития атеросклероза:
1. Гиперхолестеринемия;
2. Гиперлипидемия ЛПОНП, ЛППП и ЛПНП (вызывают генетические дефекты рецепторов, апобелков, СД, гипотериоз, переедание).
3. Изменение нормальной структуры ЛПНП под действием ПОЛ и гипергликемии. Избыток глюкозы гликозилирует апобелки, повышенное ПОЛ (при гипоксии, воспалении) повреждает липиды и апобелки ЛП. Модифицированные ЛПНП становятся чужеродными для организма, атакуются антителами и поглощаются макрофагами с участием «скевенджер-рецепторов» (рецепторов-мусорщиков);
4. Повреждение сосудистой стенки высоким артериальным давлением (психоэмоциональные стрессы), ПОЛ (гипоксия, курение (через СО), воспаления), иммунными реакциями, токсинами и другими ядовитыми веществами (Pb, Cd). Повреждающие факторы разрыхляют и истончают (до исчезновения) гликокаликс энтероцитов, увеличивают межэндотелиальные щели, что создает на поверхности эндотелия зоны повышенной клейкости и проницаемости;
5. Принадлежность к мужскому полу (гормональный статус).
Молекулярные механизмы развития атеросклероза
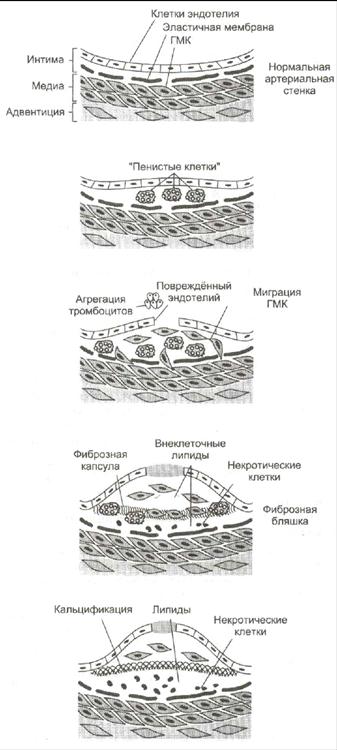
Развитие атеросклероза проходит в 6 стадий:
1. Стадия измененного эндотелия. На поверхности поврежденного эндотелия скапливаются тромбоциты и моноциты. Модифицированные ЛПНП проникают под поврежденный эндотелий сосудов. За ними направляются моноциты (в ткани они макрофаги) и захватывают ЛП через скевенджер-рецепторы. Этот процесс не ингибируется избытком ХС, поэтому макрофаги перегружаются ХС и превращаются в «пенистые клетки». Отдельные «пенистые клетки» есть у новорожденных.
2. Стадия жировых полосок. При увеличении количества «пенистых клеток» они образуют липидные полоски. «Пенистые» клетки адсорбируют все остальные липиды без разбора. Поврежденный эндотелий, активированные макрофаги, тромбоциты выделяют БАВ, которые стимулируют пролиферацию ГМК и миграцию их в очаг повреждения.
3. Стадия переходная. Активированные ГМК синтезируют коллаген и эластин, что приводит к прорастанию бляшки фиброзной тканью. Клетки под фиброзной оболочкой некротизируются, а ХС начинает откладываться в межклеточном пространстве. Может происходить разрыв эндотелия сосудов.
4. Стадия атеромы. ХС межклеточного пространства формирует в центре бляшки липидную каплю – атерому, которая через разрушенный эндотелий выступает в просвет сосуда.
5. Стадия фиброатеромы. Атерома пропитываясь солями кальция, белками, ГАГ и приобретает плотную фиброзную крышку. Атерома становиться фиброатеромой.
6. Стадия осложнения фиброатеромы. Фиброатерома не стабильна, она может надрываться и изъявляться, что приводит к обострению атеросклероза.
Осложнения. Поврежденный эндотелий прекращает синтез PGI2, который в норме ингибирует тромбоциты. Тромбоциты активируются и секретируют тромбоксан ТХА2 и тромбоцитарный фактор роста (пептид). Тромбоцитарный фактор роста привлекает в бляшку клетки крови, ГМК, что способствует росту бляшки и развитию очага воспаления. ТХА2 → агрегацию тромбоцитов → образование тромбов → закупорка сосудов → ишемия тканей → некроз тканей → изъявления стенок сосудов → кровотечения, аневризмы. Оторвавшиеся тромбы → эмболии сосудов.
Чаще всего атеросклероз развивается в коронарных, мозговых, почечных артериях, артериях нижних конечностей и в аорте. Атеросклероз коронарных артерий проявляется ИБС, мозговых – ИБ мозга, почек – вазоренальной артериальной гипертензией. Спазм или тромбоз коронарных сосудов ведет к инфаркту миокарда, эмболия сонных артерий ведет к развитию инсультов.
Смертность от последствий атеросклероза (инфаркт миокарда, инсульт) лидирует в общей структуре смертности населения.
Биохимические основы лечения атеросклероза
Лечение гиперхолестеролемии, как правило, комплексное.
I Диета. Необходимо употреблять:
1) продукты гипокалорийные, гипохолестериные, с низким содержанием легкоусвояемых углеводов (растительная пища). Поступление ХС с пищей не должно превышать 0,3 мг/сут;
2) полиеновые ЖК семейства ω-3 (морепродукты). Из них синтезируются простагландины, подавляющие тромбообразование и замедляют развитие атеросклеротической бляшки. Ненасыщенные ЖК также ускоряют выведение ХС из организма (механизм не ясен);
3) витамины С, Е, А и другие антиоксиданты ингибирующие ПОЛ и поддерживающие нормальную структуру ЛПНП и их метаболизм.
Липримал дает самый сильный эффект
II. «Размыкание» цикла энтерогепатической циркуляции жёлчных кислот. Лекарства типа холестирамина, холестипол (полимеры) адсорбируют в кишечнике жёлчные кислоты, выделяются с фекалиями и таким образом уменьшают возврат жёлчных кислот в печень. В печени увеличивается захват ХС из крови для синтеза новых жёлчных кислот.
III. Ингибирование синтеза ХС. Наиболее эффективные препараты для лечения атеросклероза — ингибиторы ГМГ-КоА-редуктазы, например антибиотик мевакор. Такие препараты могут почти полностью подавить синтез ХС в организме, нормализуя уровень ХС.
IV. Активация катаболизма ЛП. Лекарственные препараты — фибраты (клофибрат, фенофибрат) активируют ЛПЛ и ускоряют катаболизм ЛПОНП. Эти препараты также активируют окисление ЖК в печени, уменьшая тем самым синтез ТГ и ЭХС и, как следствие, секрецию ЛПОНП печенью.
Для эффективного лечения атеросклероза применяют, как правило, комбинированное воздействие нескольких лекарственных препаратов.
 |
|
ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ
Желчнокаменная болезнь — патологический процесс, при котором в жёлчном пузыре образуются камни, основу которых составляет ХС.
Выделение ХС в жёлчь должно сопровождаться пропорциональным выделением жёлчных кислот и фосфолипидов, удерживающих гидрофобные молекулы ХС в жёлчи в мицеллярном состоянии.
Если активность ГМГ-КоА-редуктазы повышена, а активность 7-а-гидроксилазы снижена — ХС синтезируется много, а жёлчных кислот мало. Это приводит к диспропорции ХС и жёлчных кислот, секретируемых в жёлчь. ХС начинает осаждаться в жёлчном пузыре, образуя вначале вязкий осадок, который постепенно становится более твёрдым. Иногда он пропитывается билирубином, белками и солями кальция. Камни, образующиеся в жёлчном пузыре, могут состоять только из ХС (холестериновые камни) или из смеси ХС, билирубина, белков и кальция.
Холестериновые камни обычно белого цвета, а смешанные камни — коричневого цвета разных оттенков.
Причин, приводящих к изменению соотношения жёлчных кислот и ХС, в жёлчи много: пища, богатая ХС, гиперкалорийное питание, застой жёлчи в жёлчном пузыре, нарушение энтерогепатической циркуляции, нарушения синтеза жёлчных кислот, инфекции жёлчного пузыря.
Если камни начинают перемещаться из жёлчного пузыря в жёлчные протоки, то они вызывают спазм жёлчного пузыря и протоков, что больной ощущает как приступ сильной боли. Если камень перекрывает проток некоторое время, то нарушается поступление жёлчи в кишечник, жёлчные пигменты проходят через мембраны гепатоцитов в сторону синусоидов и попадают в кровь, что приводит к развитию обтурационной (подпечёночной желтухи).
Лечение желчнокаменной болезни
В начальной стадии образования камней можно применять в качестве лекарства хенодезоксихолевую кислоту. Попадая в жёлчный пузырь, эта жёлчная кислота постепенно растворяет осадок ХС (холестериновые камни), однако это медленный процесс, требующий нескольких месяцев.
ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
кафедра биохимии
Утверждаю
Зав. каф. проф., д.м.н.
Мещанинов В.Н.
_____‘’_____________2005 г
Источник: studopedia.ru
Утром чай, в обед газета — и всё жиры, жиры…
Автора не помню

Невзирая на катастрофическую нехватку времени, я всё же пишу.
Прошу прощения за длительное молчание, но жизнь — она странная штука, и не всегда ты можешь распоряжаться сам собой…
Итак
Продолжаем наш курс «Биохимия для чайников».
И с полным, уже, пониманием, что же такое белки, функции коих объяснены здесь, здесь и здесь, и с полным пониманием для чего белки нужны организму — переходим к жирам.
По мнению большинства учёных, проблема сумасшедшего роста количества всякого рода заболеваний (и растущее год от года всё быстрее) состоит в том, что мы порабощены (фальшивой) рекламой, продвигающей всего лишь нужный для продажи товар, но нисколько не заботящейся о нашем здоровье. Мы заложники жажды наживы огромных продуктовых и фармацевтических компаний.
Нас пугают, что еды на земле мало, что всем не хватит. Так почему же тогда мы имеем перепроизводство всяческих товаров, в том числе и продуктовых? По какой такой причине нужно добавлять в них консерванты и прочую химозу, ежели нам и так их не хватает? Разве могут они при тотальной нехватке, которой нас запугивают, залёживаться на прилавках? По логике — не должны…
Вместо нормального белка нас пытаются пичкать соей и целлюлозой, говоря, что это полезнее, чем мясо… Вместо нормального жира нам подсовывают всё что угодно. Да мало того, ещё и массово пропагандируется, что натуральный жир это плохо, что натуральный жир это вредно, что жир это фактически дьявол во плоти, пичкая нас транс-жирами и прочей дрянью…
Но вернёмся к биохимии
Жиры — это второй (первый это белок, как мы знаем уже) по значимости для организма компонент питания, который после осуществления белком всех функций приступает к не менее важной работе.
Итак, какая функция жира в организме первая и самая важная? Попробуйте угадать
Думаю, что основная масса людей скажет теплопродукция и будут отчасти правы, конечно, но это лишь третья по значимости функция жиров. Кто-то скажет запас энергии, кто-то скажет мембранная…. И все будут правы, но лишь отчасти.
Главная и наипервейшая функция жиров в организме – ДЫХАТЕЛЬНАЯ. Жир — это сурфактант. В первую и наиважнейшую голову!
В жизни не догадаешься, что за страшный зверь такой этот сурфактант, но тем не менее.
Причём, раньше на первое место ставилась функция мембран. Все учебники по биохимии в главе о жирах начинались с фразы: мембранная функция жиров… Но с развитием нашей науки и появлением новых исследовательских возможностей выяснилось, что мембранная функция лишь на втором месте, а первая, «структурная» функция жиров – именно сурфактантная.
И странно совершенно, что до сих пор об этом даже не все врачи знают…
Новая тойота или бентли вышли, весь мир, включая грудничков, об этом знает, звезда какая-нибудь на сцене каблук сломала или любовника себе очередного завела — весь мир в едином порыве скандирует: — урааа… А какие страдания теперь у всех в связи с новостью о разводе Питта и Джоли, не знает этого только слепо-глухо-немой, пожалуй (и то вряд ли) – мировая трагедия… Какие там жиры….
А тут установлена главнейшая функция жиров, происходит революция в осознании функции основных питательных веществ и их важности, а кто об этом знает…. Никто… Тишина. Не нужно никому собственное здоровье (врачам то оно точно не нужно, им надо чтоб мы все болели).
Но вернёмся к главной функции жиров. Что же это за звэрь такой сурфактант?
Да, мне могут сказать, что сурфактант этот вырабатывается эндогенно самим организмом.
Цитата из учебника: Липиды сурфактанта синтезируются в эндоплазматическом ретикулуме микросомальной фракции альвеолоцитов 2-го типа и транспортируются через комплекс Гольджи и пластинчатые тельца в просвет альвеол.
Вот такой вот умняк.
Однако, суть современных исследований в том, что выработка сурфактанта существенно снижается с возрастом, а при тотальном дефиците поступающего в организм экзогенно (извне) жира (натурального животного), может прекратиться вовсе. Обнаружена прямая связь между количеством поступающего жира в организм человека и количеством вырабатываемого этим организмом сурфактанта.
Установлено, что СВДС (Синдрома Внезапной Детской Смертности) и РДС (Респираторный Дистресс-Синдром новорожденных) связаны именно с полным отсутствием сурфактанта в организме младенца.
Как вы думаете, сколько может прожить человек без кислорода? Без пищи очень много, я, к примеру, могу не есть два с лишним месяца (а официальный мировой рекорд на данный момент — 248 дней голодания, неофициальный – 411 дней), без воды, наука говорит, человек может прожить 7 дней, но есть прецеденты что 15 и даже 27 дней. Без любви и ласки мы можем жить вообще всю жизнь, без руководящей роли партии прекрасно живут многие поколения…
Но вот без кислорода человеческое существо не может жить вообще! Клетка мозга без кислорода может существовать лишь 1 минуту, две-три минуты — это в случае наличия каких-то внутренних резервов, и это уже граница между жизнью и смертью. Три минуты это в лучшем случае. Другие клетки могут прожить и чуть подольше (сердце, например, может продержаться минут 20), но зачем нам, простите, организм без мозга, мы же с вами не просто набор костей и мышц…
Мы не собаки, не птички, и не черви, для Хомо Сапиенса граница выживания – это граница выживания клеток мозга.
Отсюда правило: Основная жизненно-важная функция жиров — это обеспечение бесперебойного поступления в наш организм главного газа жизни – КИСЛОРОДА.
Так вот, кислородом организм насыщается именно благодаря сурфактанту, то есть жирам. Благодаря сурфактанту кислород проникает во все, без исключения, клетки нашего тела.
 Все знают, что у нас есть бронхи и все знают, хоть приблизительно, как бронхи устроены. Сначала идёт трахея, потом два главных бронхиальных ответвления, потом они «ветвятся» сильнее и каждое микроскопическое ответвление заканчивается бронхиолой. В свою очередь каждая бронхиола заканчивается маленьким пузырьком, называющимся альвеолой.
Все знают, что у нас есть бронхи и все знают, хоть приблизительно, как бронхи устроены. Сначала идёт трахея, потом два главных бронхиальных ответвления, потом они «ветвятся» сильнее и каждое микроскопическое ответвление заканчивается бронхиолой. В свою очередь каждая бронхиола заканчивается маленьким пузырьком, называющимся альвеолой.
С наружной части альвеола оплетена капиллярами, и капилляры эти приносят венозную кровь богатую СО₂. Во время выдоха из крови в альвеолу поступает СО₂. Во время вдоха в альвеолу приходит кислород, а кровь (гемоглобин) «хватает» этот кислород и, становясь артериальной, разносит его уже по всему телу. Это всё мы знаем со школы. Обмен кислорода и углекислого газа происходит в альвеолярной части бронхов. Очень простой механизм, осуществляющийся автоматически. Руководит этим процессом специальный центр мозга, называемый дыхательный центр.
Мы обо всём этом можем и не знать, но организм наш гениальный знает всё, и чтобы не происходили в нём перебои поступления кислорода (ну мало ли что) обеспечивает себе гарантию постоянного поступления кислорода. И этой гарантией как раз и является сурфактант. Это вещество, нанесённое на внутреннюю часть альвеолы, нечто вроде смазки. Тончайшая плёнка (мономолекулярный слой, говоря научно), обволакивающая альвеолу с внутренней стороны.
Сурфактант имеет два ключевых качества.
Первое качество: он не даёт альвеоле спадаться, даже когда мы делаем выдох (выталкиваем из себя СО₂).
И второе, удивительное качество: он ускоряет перенос кислорода через мембрану альвеолоцита, примерно в 70-100 раз!
Процесс дыхания (механическая его часть) осуществляется благодаря мышцам, а процесс переноса кислорода, благодаря сурфактанту. И даже если мы, выполняя механическую часть, вроде как дышим, то при отсутствии сурфактанта у нас не работает перенос кислорода к клеткам.
Соответственно, самым «слабым звеном» в этой цепи является наличие или отсутствие сурфактанта в альвеолах!
Капилляры есть всегда, мышцы работают всегда, всё остальное тоже сформировано и работает, и лишь наличие сурфактанта (микроскопической жировой прослоечки в альвеоле) является определяющим фактором, получат наши клетки достаточно кислорода или нет!
Правило из учебника: Человек может получать кислород только (ключевое слово) через альвеолярное звено.
Никаким другим путём или местом мы усвоить кислород не можем!
Дышать кожей или жабрами, всасывать кислород желудком или печенью, или прямой кишкой, мы, к сожалению, не можем при всём своём желании, как бы не старались, даже если захотим и потратим всю свою жизнь на тренировки… 40-50 или 70 лет упорных тренировок не смогут научить нас дышать прямой кишкой, не эволюционировали мы пока в поподышащих… увы, ни в кожедышащих, ни в желудкодышащих…
Многие сейчас, очень многие, не буду говорить нехорошее слово кто, построили целый огромный бизнес на кислородных коктейлях и кислородной косметике и т.п. Нам говорят: «выпейте кислородный коктейль, и будет вам счастье», или «намажьтесь кислородным кремом и …».
Всё это фикция и выкачивание из нас денег! Потому что каждая клетка нашего организма получает кислород только с артериальной кровью, которая насыщается оным только в одном единственном месте – альвеолах… И как бы нас не уверяли те самые «бизнесмены» что мы коже- или желудкодышащие существа, это не есть правда…
Если организм не имеет в достатке сурфактанта, то происходят два непоправимых процесса, альвеола спадается, и количество переносимого кислорода становится меньше (соответственно, клетки его недополучают).
Ну и что страшного, — скажете вы, — у нас этих альвеол миллионы, пусть себе спадаются, не успеем мы помереть от этого…
Так-то оно, конечно, так. Но!
Большинство ныне живущих на планете Хомо Сапиенсов, как выяснено в современных исследованиях всё теми же учёными, находятся в состоянии гипоксии.
*Гипоксия — это состояние кислородного дефицита в тканях организма.
Если гипоксия хроническая – она уже называется ишемия (все, думаю, слышали, слово ишемия, но знать не знали, почему же она случается).
Ишемическая болезнь сердца или ишемия мозга обозначает, что ткани этих органов недополучают кислорода очень и очень долго, не минуту-две, а годы, и вследствие этого образуется некроз этих тканей. Причин тому может быть несколько, но самым уязвимым звеном в этой цепочке являются альвеолы и наличие в них сурфактанта.
Сейчас очень распространённое явление среди беременных — гипоксия плода, страшное дело, скажу я вам. Мамаше и самой-то не хватает кислорода, потому что жиров она не ест, это же плохо и вредно, какой уж тут ребёночек внутри.
Чуть ли не каждому новорожденному сейчас ставят диагноз — гипоксическая энцефалопатия. Ужас! Но жиры это плохо, продолжают нас уверять… Последние 30 лет подсаживают нас на низкожировые диеты, поперепугали всех мифическим холестерином (а проблема холестерина это проблема белкового переноса, как мы уже знаем, нарушенная транспортная его функция) и вдалбывают, буквальным образом, сокращение приёма жиров. Фашисты!
А мы ведь не знаем, что и как работает, мы ведь верим…
Нам говорят: молоко жирное — низяя, мы воду крашеную покупаем вместо молока. Нам говорят жир — плохо, мы вместо масла сливочного ацкие маргарины покупаем, якобы «лайт». Нам говорят: сало – нееее, отрава страшная; мясо жирное – тьфу на вас, мы же не убийцы, мы веганы…
Год-два на обезжиренных продуктах «лайт» и вы уже в очереди за ишемией.
Незнание законов не освобождает от ответственности.
И это печально. Многие бы и рады знать, но взять то эти знания негде. Уже почти 20 лет, как открыли эту главную функцию жиров (кажется американские учёные, если мне память не изменяет), а нигде и никто нас об этом не оповещает, продуктов «обезжиренных» плодится всё больше и больше, свиньи и те уже тощие как газели, ни капельки жира в них…
Ну и как же мы может быть здоровыми? Когда белка нам не хватает, кислорода нам не хватает…кошмар какой-то, а не жизнь. При этом пропаганда всё твердит и твердит жиры — вредно, белки — вредно… жрите сою и целлюлозу с сахаром — и мы вас полюбим (а вернее ваш кошелёк)…
ПРЕНЕБРЕЖЕНИЕ ОСНОВНЫМИ ЗАКОНАМИ ПИТАНИЯ И ФИЗИОЛОГИИ ПОВЫШАЕТ СТАТИСТИКУ ПО ТЕМ ПРОБЛЕМАМ, КОТОРЫЕ МЫ ЯКОБЫ ИСКЛЮЧАЕМ.
Исключили жиры, получили тотальную гипоксию и ишемию, исключили животные белки, получили тотальные дисфункции организма и эпидемии рака.
Гипоксические симптомы я опишу потом, но самые основные и распространённые – сонливость, вялость, хроническая усталость, заторможенность мыслительных процессов в гипоксически-ишемизированном мозгу… А нам сказки рассказывают про стрессы, всякие вегето-сосудистые дистонии выдумывают.
А я считаю, чем вялее, безынициативнее и тугодуместее население, тем легче им манипулировать.
«ЭТИ» всё знают и целенаправленно нас уничтожают.
Давайте разберёмся, откуда же берётся этот сурфактант.
Сурфактант — это на 95% жир и 5% специфического белка. У всяких зверушек и у человека 5% белковой составляющей отличаются, а жировая составляющая совершенно одинакова.
Как я уже говорила, открыли сурфактант около 20-ти лет тому назад, проводилось по этому поводу множество исследований, изучений и экспериментов. И выяснилось, что сурфактант этот ну никак не хочет синтезироваться, несмотря на всю свою простоту. Ну, то есть синтезировать его возможно, но только он абсолютно не работает в организме и не попадает туда, куда должен попадать.
Стали экспериментировать с сурфактантом животных и выяснили, что самый лучший (и подходящий для лечения людей с гипоксией) сурфактант, всем сурфактантам сурфактант, сурфактантище – как вы думаете у кого? У морских млекопитающих, то бишь у китов.
И опять вспоминаем японцев, которые плевать хотели на мировое сообщество, кричащее им, что на китов охотиться запрещено. Добывали и добывать будут (99% мирового китового промысла принадлежит Японии).
А добывают они китов, собственно, из-за этого самого китового сурфактанта. Не знаю, до сих пор ли они раздают жир бесплатно населению или нет, но ещё 15 лет назад это было (15-30 грамм каждому).
Благодаря китовому сурфактанту (не только ему одному, конечно, но и всей политике рационального питания) японцы за 10-15 лет вылезли из послевоенного состояния вымирания (когда нечего было есть вообще и люди мёрли от лучевой болезни, ибо Япония единственная страна которую победили, разбомбив атомными бомбами, и всё отобрали, в надежде, что сами вымрут).
Они разработали и приняли к действию государственную программу по оздоровлению нации. Страна, которую уничтожили почти полностью, которая вымирала, к 70-му году прошлого века дала экономическое чудо мирового масштаба.
Где у нас сейчас Япония – впереди планеты всей, и по показателям здоровья (отсутствия болезней), и по показателям продолжительности жизни, и по росту уже догнали среднего европейца, не говоря уже о технических их достижениях!
Кстати сказать — японцы так же были первыми, кто начал применять технологию обогащения питания, попросту говоря, это они изобрели БАДы, аж в 48 году прошлого века. Морские водоросли, гинко-билоба (самый мощный на планете антиоксидант) – это их «изобретения».
А мы все такие умные и даже знаем кое-что о белках, о витаминах и микроэлементах, о прекрасных и волшебных биодобавках, но скажите мне, нужно ли всё это будет организму, и будет ли оно работать, если нет кислорода…
Главный газ нашей жизни — кислород.
И даже когда сформированы все структуры правильно, то в гипоксических условиях не работает ничто, ни синтез белка, ни иммунные функции, ни транспортные, ни усвоение тех же витаминов и микроэлементов.
Все правильные и здоровые клетки нашего организма требуют кислорода для своих биохимических реакций. Пока нет достаточного количества кислорода, не восстановится никогда обмен веществ (какие бы «разгоняльщики» обмена вы не употребляли). А нет обмена веществ, нет корректной работы организма.
Без кислорода, как уже нам известно, работает, размножается и прекрасно существует только один вид клеток – раковые. Они питаются одной только глюкозой и все их реакции анаэробные (бескислородные)… Вот так.
Отсюда очередное правило – Главным регулятором скорости и активности любых обменных процессов в организме является кислород!
Чем больше кислорода, тем выше скорость и активность биохимических реакций. Любых. Меньше кислорода – ниже активность биохимических реакций и, следовательно, ниже уровень обмена веществ.
И на фоне неимоверной пропаганды «обезжиренного» образа жизни нам продают сурфактанты (уже в виде лекарств) за бешеные деньги, 300-500 долларов стоит 50мг флакончик (это 0,05 грамма, а в человеческом организме должно быть для правильной работы 30-40 грамм сурфактанта). И применяют его, естественно, уже в крайних предсмертных случаях. Продают нам жировые (из жира животных) эмульсии для внутривенного вливания.
Вместо того чтобы развивать пропаганду правильного здорового питания!
Потому что при должном кормлении собственного организма, всё необходимое он вырабатывает САМ!
Если мы правильно питаемся, эта функция у нас в организме поддерживается автоматически.
Но это только ЕСЛИ!
Если мы не сидим на веганской диете, если мы пьём нормальное жирное молоко и йогурты, если мы едим жирный творог и сыр, если едим яйца и сливочное масло, жирное мясо и жирную рыбу, вопреки пропаганде. Всё это работает только ЕСЛИ!
Вспомним даже народные средства. Испокон веков, чем лечили любые заболевания дыхательной системы? Правильно – жиром! Топлёное молоко пили с большим количеством сливочного масла, намазывали наружно барсучьи, медвежьи и прочие жиры. Противно, невкусно, однако действенно! По себе знаю, вечно я кашляла так, что соседские кукушки из часов все в лес поулетали, и поили меня этим делом постоянно, и мазали жиром без остановки. Помогало.
Всегда задаюсь вопросом, откуда народная мудрость знает всё то, что учёные открывают вот только-только…
Если мы станем говорить о жизненно важных функциях, мы должны говорить – что без достаточного снабжения альвеолярного звена сурфактантом мы все находимся в состоянии гипоксии. По поводу дефицита белка мы уже в курсе, вот теперь ещё и в курсе дефицита кислородного.
Те, кто задыхается в душном помещении, кто начинает зевать и чувствует сонливость в метро или закрытых помещениях, знайте – это гипоксия. И, как правило, это женщины, запуганные мыслью «ожирение это жиры» и сидящие на всяких диких диетах. Мужчины же менее подвержены гипоксии, потому что, что бы мы им там не пели, жир они не отдадут никогда, свой килограмм майонеза на бутерброд с салом они всегда положат.

С сурфактантом вроде всё. Другие функции жиров в следующих постах…
Продолжение здесь Жиры и Гипоксия, или биохимия для чайников (часть шестая)
Часть первая, Часть вторая, Часть третья
Будьте здоровы!
Юл Иванчей (Yul Ivanchey)
Источник: yulivanchey.com
Особенности проведения биохимического анализа
Поскольку кровь циркулирует во всех органах человеческого тела, ее химический состав может меняться — в зависимости от наличия патологий в одном или нескольких из них. Поэтому биохимический анализ крови — наиболее распространенное исследование, которое назначают при жалобах пациента на самочувствие и подозрениях на нарушение функции почек, печени, щитовидной железы.
Забор биоматериала осуществляется утром, с 8 до 11 часов, обязательно — на голодный желудок, но при этом время голодания не должно превышать 14 часов. Для анализа у пациента берут венозную кровь в объеме около пяти–восьми миллилитров.
Биохимический анализ мочи также является одним из базовых вспомогательных исследований: он позволяет выявить не только наличие патологий мочеполовой системы, но и получить сведения о состоянии желчевыводящих путей и работе многих систем организма. Анализ назначают в период беременности, при сахарном диабете и подозрениях на заболевания почек.
Забор биоматериала проводят в домашних условиях, в течение суток, начиная с раннего утра, собирая мочу в емкость. Важные правила при сборе:
- использовать только стерильную емкость;
- первую утреннюю порцию собирать не нужно;
- перед мочеиспусканием провести гигиенические процедуры;
- между походами в туалет и до передачи в клинику мочу необходимо хранить в холодильнике (не более суток).
После сбора всего биоматериала за сутки, его перемешивают, измеряют объем, переливают немного (до 50 мл) в специальную маленькую баночку, на которой указывают общее количество мочи за сутки, рост и вес пациента. Затем емкость можно передать в лабораторию.
Расшифровка биохимического анализа крови
Результатом анализа является выданное заключение о содержании химических веществ и биологических агентов в крови. Как правило, документ представляет собой таблицу, в первой колонке которой указано название показателя, во второй — выявленное значение, в третьей — диапазон нормы. По этой таблице специалист оценивает отклонения от нормы и на основании этого может судить о нарушениях в работе органов.
Показатели биохимического анализа и их нормативные величины
Диапазон нормальных значений для того или иного показателя может меняться в зависимости от клиники и лаборатории, и это не является ошибкой. Окончательное решение, считать ли значение превышенным, нормальным или пониженным, принимает врач на основе анамнеза.
В нижеприведенной таблице можно ознакомиться с примерными показателями нормы содержания веществ при биохимическом анализе крови:
|
Показатели |
Норма |
Единицы |
||
|
У мужчин |
У женщин |
|||
|
Белки |
||||
|
Альбумин |
33–50 |
г/л |
||
|
Общий белок |
64–83 |
|||
|
С-реактивный белок (СРБ) |
до 5 |
мг/л |
||
|
Миоглобин |
19–92 |
12–76 |
мкг/л |
|
|
Трансферрин |
2,15–3,65 |
2,50–3,80 |
г/л |
|
|
Ферритин |
20–350 |
10-120 |
мкг/л |
|
|
ЛЖСС |
20–62 |
мкмоль/л |
||
|
ОЖСС |
50–85 |
|||
|
Ферменты |
||||
|
АлАт |
до 45 |
до 34 |
Ед/л |
|
|
АсАт |
до 41 |
до 31 |
||
|
ГГТ |
до 49 |
до 32 |
||
|
ЛДГ |
до 250 |
|||
|
Альфа-амилаза |
27-100 |
|||
|
Амилаза панкреатическая |
до 50 |
|||
|
Креатинкиназа |
до 190 |
до 167 |
||
|
Креатинкиназа МВ |
до 24 |
|||
|
Щелочная фосфатаза |
150 |
120 |
||
|
Липаза |
до 190 |
|||
|
Холинэстераза |
5800–14000 |
|||
|
Липиды |
||||
|
Общий холестерол и липопротеиды |
3,0–6,0 |
ммоль/л |
||
|
очень низкой плотности |
0,26–1,04 |
|||
|
низкой плотности |
2,2–4,8 |
1,92–4,51 |
||
|
высокой плотности |
0,7–1,73 |
0,8–2,28 |
||
|
Триглицериды |
0,34–3,00 |
|||
|
Углеводы |
||||
|
Глюкоза |
3,88–5,83 |
ммоль/л |
||
|
Фруктозамин |
до 319 |
мкмоль/л |
||
|
Пигменты |
||||
|
Билирубин общий |
3,4–17,1 |
мкмоль/л |
||
|
прямой |
до 3,4 |
|||
|
непрямой |
до 19 |
|||
|
Показатели азотистого обмена |
||||
|
Креатинин |
62–115 |
53–97 |
||
|
Мочевая кислота |
210–420 |
145–350 |
||
|
Мочевина |
2,4–6,4 |
ммоль/л |
||
|
Витамины и микроэлементы |
||||
|
Сывороточное железо |
11,6–30,4 |
8.9–30,4 |
||
|
Калий |
3,5–5,5 |
ммоль/л |
||
|
Кальций |
2,15–2,5 |
|||
|
Натрий |
135–145 |
|||
|
Хлор |
98–107 |
|||
|
Магний |
0,66–1,05 |
|||
|
Фосфор |
0,87–1,45 |
|||
|
Фолиевая кислота |
3–17 |
нг/мл |
||
О чем говорят отклонения?
Следует помнить, что отклонения от нормы не обеспечивают моментальную постановку диагноза, а лишь сигнализируют о проблемах в организме. Каждый показатель следует рассматривать как индивидуально, так и в совокупности с другими. Ниже мы рассмотрим, о чем говорит повышенное или пониженное содержание тех или иных веществ.
Белки и аминокислоты
Пониженный показатель общего белка в крови может сказать о наличии таких патологий, как нарушение обменных процессов, хронические кровотечения, анемия и т. д. Впрочем, пониженный белок нормален на поздних сроках беременности, в период кормления грудью, при сильных физических нагрузках и наоборот — для лежачих больных. Также часто снижение уровня белка происходит из-за диет и голодания.
Превышение нормального количества белка в сыворотке крови говорит о наличии серьезных патологий почек, инфекций, злокачественных опухолей, аутоиммунных заболеваниях и т. п.
На серьезные проблемы может указывать и снижение содержания аминокислот — чаще всего оно свидетельствует о проблемах печени и почек, нарушении обменных процессов.
Показатели азотистого обмена
Пониженный уровень мочевины, креатинина и мочевой кислоты в крови говорит о голодании, печеночной недостаточности, замедлении обмена веществ или полиурии.
Повышение мочевины, выявленное при биохимическом анализе крови, сигнализирует о проблемах с почками, отравлении или артериальной гипертензии. Для креатинина увеличенные показатели тоже могут быть признаком патологии почек, а кроме этого — кишечной непроходимости, мышечной дистрофии, сахарного диабета. Повышение уровня мочевой кислоты говорит о наличии таких заболеваний, как подагра, диабет, лейкоз, а также о патологиях кожи, инфекциях или отравлениях.
Метаболиты углеводного обмена и глюкоза
Превышение нормального показателя глюкозы является одним из основных симптомов сахарного диабета, но также может быть сигналом травм головного мозга, заболеваний ЦНС, надпочечников, щитовидной железы и гипофиза. Понижение уровня глюкозы в крови свидетельствует о возможных патологиях поджелудочной железы, печени, эндокринной системы.
Пептиды
Показатель С-пептида является важным для диагностики сахарного диабета и ряда других заболеваний. Превышение нормального показателя свидетельствует о наличии опухоли, панкреатита, избыточном синтезе инсулина. Снижения уровня характерно для сахарного диабета первого типа, воспалительных реакций.
Показатели липидного обмена
Наибольшее диагностическое значение в этой группе имеет холестерин. Его повышение свидетельствует о возможных онкозаболеваниях, ишемической болезни сердца, инфаркте миокарда, панкреатите, сахарном диабете и других серьезных патологиях. Не менее опасно и понижение уровня холестерина: оно может быть связано с опухолями или циррозом печени, заболеваниями легких, ревматоидным артритом.
Ферменты
При нарушении нормального уровня ферментов можно судить о заболеваниях тех органов, которыми данный вид ферментов вырабатывается. Например, показатель АсАт будет повышен при патологиях печени и сердца, а превышение нормального значения АлАт сигнализирует о массовом отмирании клеток печени.
Витамины и микроэлементы
При исследовании крови обычно выявляют показатели содержания витаминов D, B12, а также фолиевой кислоты.
Среди микроэлементов в крови наибольшее значение имеют показатели калия и натрия. Снижение уровня калия чревато тошнотой, рвотой, непроизвольным мочеиспусканием или дефекацией. Превышение нормы этого элемента сопутствует помрачнению сознания, падению артериального давления, аритмии.
Недостаток натрия, в свою очередь, может стать причиной сонливости, головной боли, тошноты и рвоты, судорог и даже комы. При избытке микроэлемента больной испытывает жажду, раздражительность, мышечные подергивания и судороги.
Расшифровка биохимического анализа мочи: норма и патологии
Анализ мочи предполагает оценку около 15-ти показателей, ниже мы приведем нормативные величины самых важных и рассмотрим возможные причины отклонений:
Мочевина
Норма — 333–587 ммоль в сутки. Снижение уровня говорит о патологиях печени и почек, но также может объясняться вегетарианской диетой, периодом восстановления после травм и активного роста у детей. Превышение нормы происходит во время беременности, при употреблении большого количества белка, а также при гепатитах, диабете, различных воспалениях мочевыводящих путей и других патологиях.
Креатинин
В норме показатель составляет 7,4–17,6 ммоль/сутки у мужчин и 5,5–15,9 ммоль/сутки
у женщин. Повышенное значение может говорить о патологии гипофиза и щитовидной железы, о заболевании диабетом, но также встречается при чрезмерных физических нагрузках и высокобелковом питании. Снижение креатинина часто происходит при лейкозе, тяжелых заболеваниях почек, анемии.
Мочевая кислота
Нормальное значение — от 0,4 до 1 грамма за сутки. Превышение нормы свойственно пациентам с заболеванием подагрой; пониженное значение фиксируется при нарушениях обмена веществ или почечной недостаточности.
Микроэлементы
Норма содержания калия — 38–82 ммоль в сутки, натрия — от 100 до 260 ммоль в сутки, хлора — 100–250 ммоль в сутки, кальция — 2,5–6,2 ммоль в сутки. По отклонению содержания калия можно определить патологию почек. Ненормальное количество натрия сигнализирует о диабете, заболеваниях надпочечников, почек и т. д. Повышение уровня хлора является симптомом обезвоживания, а понижение — болезней надпочечников и почек. Превышение нормы кальция в моче может свидетельствовать об остеопорозе, синдроме Иценко-Кушинга. Снижение — о возможных острых почечных патологиях, рахите, онкозаболеваниях костей.
Белки
Допускаются в моче в количестве менее 0,033 грамм на литр. Превышение этого значения может быть вызвано диабетом, аутоиммунными заболеваниями, аллергическими реакциями или инфекциями.
Оксалаты
Не должны превышать значения 40 мг в сутки. Повышенный показатель при отсутствии своевременного лечения приводит к образованию камней в почках. В некоторых случаях чрезмерное количество оксалатов в моче вызвано употреблением большого количества продуктов, содержащих щавелевую кислоту: помидоров, цитрусовых, спаржи, щавеля. Еще одной причиной может являться сахарный диабет.
Биохимические анализы крови и мочи помогают обнаружить патологии практически всех органов человека, проконтролировать течение выявленных заболеваний и сигнализировать о возникновении новых. Поэтому очень важна правильная подготовка к сдаче анализов, корректно выполненный забор материала и, конечно, современное и точное оборудование в клинике, где проводят лабораторные исследования.
Источник: www.kp.ru
Жирные кислоты входят в состав всех омыляемых липидов. У человека жирные кислоты характеризуются следующими общими чертами:
- четное число углеродных атомов в цепи,
- отсутствие разветвлений цепи,
- наличие двойных связей только в цис-конформации.
В свою очередь, по строению жирные кислоты неоднородны и различаются длиной цепи и количеством двойных связей.
К насыщенным жирным кислотам относится пальмитиновая (С16), стеариновая (С18) и арахиновая (С20). К мононенасыщенным – пальмитоолеиновая (С16:1, Δ9), олеиновая (С18:1, Δ9). Указанные жирные кислоты находятся в большинстве пищевых жиров и в жире человека.
Полиненасыщенные жирные кислоты содержат от 2-х и более двойных связей, разделенных метиленовой группой. Кроме отличий по количеству двойных связей, кислоты различаются положением двойных связей относительно начала цепи (обозначается через греческую букву Δ «дельта«) или последнего атома углерода цепи (обозначается буквой ω «омега«).
По положению двойной связи относительно последнего атома углерода полиненасыщенные жирные кислоты делят на ω9, ω6 и ω3-жирные кислоты.
1. ω6-жирные кислоты. Эти кислоты объединены под названием витамин F, и содержатся в растительных маслах.
- линолевая (С18:2, Δ9,12),
- γ-линоленовая (С18:3, Δ6,9,12),
- арахидоновая (эйкозотетраеновая, С20:4, Δ5,8,11,14).
Строение жирных кислот
2. ω3-жирные кислоты:
- α-линоленовая (С18:3, Δ9,12,15),
- тимнодоновая (эйкозопентаеновая, С20:5, Δ5,8,11,14,17),
- клупанодоновая (докозопентаеновая, С22:5, Δ7,10,13,16,19),
- цервоновая (докозогексаеновая, С22:6, Δ4,7,10,13,16,19).
Пищевые источники
Поскольку жирные кислоты определяют свойства молекул, в состав которых они входят, то они находятся в совершенно разных продуктах. Источником насыщенных и мононенасыщенных жирных кислот являются твердые жиры – сливочное масло, сыр и другие молочные продукты, свиное сало и говяжий жир.
Полиненасыщенные ω6-жирные кислоты в большом количестве представлены в растительных маслах (кроме оливкового и пальмового) – подсолнечное, конопляное, льняное масло. В небольшом количестве арахидоновая кислота имеется также в свином жире и молокопродуктах.
Наиболее значительным источником ω3-жирных кислот служит жир рыб холодных морей – в первую очередь жир трески. Исключением является α-линоленовая кислота, имеющаяся в конопляном, льняном, кукурузном маслах.
Роль жирных кислот
1. Именно с жирными кислотами связана самая известная функция липидов – энергетическая. Благодаря окислению насыщенных жирных кислот ткани организма получают более половины всей энергии (β-окисление), только эритроциты и нервные клетки не используют их в этом качестве. Как энергетический субстрат используются, как правило, насыщенные и мононенасыщенные жирные кислоты.
2. Жирные кислоты входят в состав фосфолипидов и триацилглицеролов. Наличие полиненасыщенных жирных кислот определяет биологическую активность фосфолипидов, свойства биологических мембран, взаимодействие фосфолипидов с мембранными белками и их транспортную и рецепторную активность.
3. Для длинноцепочечных (С22, С24) полиненасыщенных жирных кислот установлено участие в механизмах запоминания и поведенческих реакциях.
4. Еще одна, и очень важная функция ненасыщенных жирных кислот, а именно тех, которые содержат 20 углеродных атомов и формируют группу эйкозановых кислот (эйкозотриеновая (С20:3), арахидоновая (С20:4), тимнодоновая (С20:5)), заключается в том, что они являются субстратом для синтеза эйкозаноидов (перейти) – биологически активных веществ, изменяющих количество цАМФ и цГМФ в клетке, модулирующих метаболизм и активность как самой клетки, так и окружающих клеток. Иначе эти вещества называют местные или тканевые гормоны.
Источник: biokhimija.ru
Триацилглицериды образуются, если 3 ОН-группы этерефицированы жирными
кислотами, они составляют основную массу всех жиров. Если этерифицированы 2
группы – это диацилглицеролы, если 1 – это моноацилглицеролы.
ТАГ (триацилглицеролы) могут быть простыми, если во всех трех положениях остатки
одной и той же жирной кислоты; сложными, если в трех положениях стоят различные
жирные кислоты (например, R1 – пальмитиновая, R2- стеариновая, R3 – лауриновая).
1 -пальмитоил – 2 – стеароил – 3 – лауроилглицерин.
При кипячении с кислотами и основаниями ТАГ подвергаются гидролизу (отщепление
жирных кислот в виде натриевых или калиевых солей, которые называются мылами).
Аналогичные продукты получаются при действии фосфолипаз поджелудочной железы.
Жиры растительного происхождения имеют в своем составе ненасыщенные жирные
кислоты ( поэтому температура плавления у них низкая ), животные жиры содержат более насыщенные жирные кислоты (температура плавления выше). При комнатной температуре животный жир твердый, растительный – жидкий.
Переваривание и всасывание жиров.
Катаболизм жиров включает в себя расщепление до СО2 и H2O в 3 стадии
Переваривание жиров включает в себя несколько стадий: эмульгирование, гидролиз
липазой, образование мицелл, всасывание, ресинтез, образование транспортных форм
жиров.
В организме существует 3 вида липаз-ферментов, расщепляющих жиры:
1. панкреатическая, расщепляет ТАГ на жирные кислоты, глицерин и (3-
моноацилглицерол (β-МАГ).
- ЛП-липаза (липопротеидлипаза) находится в эндотелии капилляров, служит для
депонирования жиров, расщепляет жиры на жирные кислоты и глицерин. - ТАГ-липаза находится в адипоцитах, осуществляет мобилизацию жиров из жировых
депо, расщепляет их на жирные кислоты и глицерин.
Жиры в ротовой полости не перевариваются, в желудке тоже, для переваривания
необходима среда, близкая к нейтральной (создается в результате нейтрализации кислой
среды бикарбонатами кишечника).
Прежде чем расщипиться ферментом поджелудочной железы липазой, жиры должны
быть эмульгированы.
Эмульгирование – это смешивание жиров с водой, происходит под действием солей
желчных кислот, которые являются ПАВ. Обладая амфифильностью (имеют
гидрофильную и гидрофобную части), они встраиваются в жировую каплю своим
гидрофобным концом и снижают ее поверхностное натяжение, в результате жировая
капля распадается на тысячи мелких частей. Это увеличивает поверхность
соприкосновения фермента — липазы со своим субстратом — жиром.
Желчные кислоты.
Синтезируются в печени из холестерина, т.е. в основе их структуры лежит циклопентанпергидрофинантреновое кольцо.
Бывают первичные и вторичные:
-первичные (холевая и хенодезоксихолевая)
Они синтезируются в печени путем гидроксилирования (с участием О2, НАДФН и
цитохрома Р450) затем поступают в желчный пузырь, где они существуют в
видеконъюгатов с глицином или таурином (биогенный аммин), получается гликохолевая
или таурохолевая кислоты.
Т.к. в желчи много натрия и калия, то конъюгаты находятся в виде солей кроме желчных
кислот в желчи содержится ~ 5% холестерина, ~ 15% фосфолипидов, -80% желчных
солей. Если это соотношение повышается в сторону холестерина, то он выпадает в
осадок в виде камней.
Желчные кислоты поступают в желчный пузырь постоянно, а выбрасываются из него в
процессе пищеварения.
-вторичные образуются из первичных под действием микрофлоры кишечника. Из холевой образуется литохолевая, из хенодезоксихолевой – дезоксихолевая кислота. Желчные кислоты способствуют активированию панкреатической липазы и всасыванию продуктов гидролиза жиров. Только 5% желчных кислот выводится из организма, остальная часть всасывается в кишечник, поступает в печень и используется повторно, т.е. циркулирует (энтерогепатическая циркуляция).
На эмульгированные жиры действует панкреатическая липаза, расщепляя сложноэфирные связи в а-положении. Отщепление жирных кислот в р-положении происходит медленнее, следовательно, продуктами гидролиза являются жирные кислоты, глицерин и β-МАГ.
Всасывание продуктов гидролиза.
Глицерин и жирные кислоты с кроткой цепью всасываются самостоятельно, а β-МАГ и жирные кислоты с длинной цепью всасываются при помощи мицелл. Мицеллы – это шаровидные образования, имеющие гидрофобное ядро (β-МАГ, жирные кислоты с длинной цепью, жирорастворимые витамины: А, Д, Е, К) и эфиры холестерины. Гидрофильная поверхность образована желчными кислотами и холестерином. Мицеллы всасываются в тонком кишечнике, в клетках слизистой оболочки кишечника они распадаются на желчные кислоты, холестерин, жирорастворимые витамины: А, Д, Е, К, β-МАГ, жирные кислоты.
Ресинтез в клетках слизистой кишечника. Существует заболевание стеаторрея (жирный кал). Причины:
- закупорка желчных протоков или фистула желчного пузыря (желчные кислоты не
поступают в кишечник) - заболевание поджелудочной железы: жиры эмульгируются, но не расщепляются
липазой, выводятся с калом, - нарушение всасывания (диарея)
Ресинтез – это синтез жиров из продуктов гидролиза, в результате чего образуется жир,
характерный для каждого организма, т.к. в состав жира включаются жирные кислоты
собственного организма (эндогенные).
Ресинтез начинается с активирования жирных кислот, идет с участием энергии АТФ,
КоА и фермента ацилКоА синтетазы, активированная форма жирных кислот называется
ацилКоА.
Реакция ресинтеза жиров или ТАГ включает взаимодействие β-МАГ с двумя молекулами активированной жирной кислоты. Ферменты: триацилглицеролсинтетаза, в результате образуется ТАГ, специфические для данного организма.
Ресинтезированные жиры нерастворимы в воде —» в кишечнике образуются транспортные формы жиров – хиломикроны (ХМ), (транспортируют экзогенные или пищевые жиры, имеют гидрофобное ядро и гидрофильную оболочку. Ядро включает в себя ТАГ, эфиры Хс, А, Д, Е, К, поверхность образована монослоем фосфолипидов, полярные головы которых направлены к воде, а неполярные гидрофобные жирнорастворимые хвосты к ядру. На поверхности этих частиц находятся специфические белки – апопротеины). ХМ в кишечнике образуются под действием апопротеина В48. Образовавшиеся ХМ -незрелые. Состав ХМ в процентах: белки – 2%, фосфолипиды -3%, холестерин – 2%,
ЭХс – 3%, ТАГ – 90%—»ХМ – основная транспортная форма жиров. ХМ – большие,
самые крупные из всех липопротеинов, поэтому они не проникают в кровеносные
сосуды, а ХМ незрелые поступают в лимфатические сосуды, потом через лимфатический
проток поступают в сосуды, где превращаются в зрелые ХМ, т.к. получает от
липопротеинов высокой плотности (ЛВП) апобелки С2 и Е.
В дальнейшей судьбе ХМ принимают участие жировая ткань и печень. В крови ХМ
зрелые подвергаются действию ЛП-липазы (фермент, локализованный на поверхности
эндотелия капилляров). Этот фермент узнает ХМ зрелые взаимодействуя с оспобелком
С2, который активирует этот фермент. В результате ТАГ ХМ зрелые гидролизуются
этой липазой на глицерин и жирные кислоты. Глицерин поступает в печень, где
участвует в синтезе эндогенных жиров или фосфолипидов, а жирные кислоты
депанируются в жировой ткани в виде ТАГ, либо окисляется в сердце, в мышцах и
других органах, кроме мозга. В результате действия ЛП-липазы образуются остаточные
ХМ. Они захватываются печенью посредством апобелка энергии и под действием
лизосомальных ферментов распадаются на Хс, ЭХс, А, Д, Е, К, апопротеины и 10% ТАГ.
В кишечнике синтезируется в небольшом количестве другая транспортная форма –
ЛОНП (липопротеины очень низкой плотности), они поступают в кровь , затем в
жировую ткань, где под действием ЛП-липазы из них извлекаются жиры, которые
депонируются, а из ЛОНП в результате извлечения жиров образуются ЛНП, содержащие
до 50% Хс и ЭХс.
ЛНП частично захватываются печенью.
После приема жирной пищи концентрация ХМ и липопротеинов повышается через 4-5
часов (сыворотка мутная или белая), а затем концентрация понижается, т.к. действует
ЛП-липаза. При дефекте ЛП-липазы в крови повышается концентрация ЛОНП и ХМ,
сыворотка остается мутноватой – гиперхиломикронемия или гиперлипопротеинемия.
От жировых депо, где ТАГ распадаются на жирные кислоты и глицерин под действием
ЛП-липазы (или ТАГ-липазы). Жирные кислоты в комплексе с альбумином
транспортируются к органам и тканям, где подвергаются расщеплению с целью
извлечения энергии. Мозг не использует жирные кислоты. Этот процесс называется р-
окисление жирных кислот.
β-окисление – это специфический путь катаболизма жирных кислот до ацетилКоА,
протекает в почках, в мышцах, особенно интенсивно в печени, кроме мозга, в
митохондриях.
Значение процесса – извлечение энергии из жирных кислот. Процесс назван так из-за
окисления группы-СН в р-положении. Процесс циклический, в конце каждого цикла
молекула ЖК укорачивается на 2 углеродных атома в виде ацетилКоА, который
поступает в ЦТК, а укороченная на 2 атома углерода ЖК поступает в новый цикл.
Многократное повторение процесса приводит к полному расщеплению ЖК до
ацетилКоА.
Регуляторный фермент скорость лимитирующий фермент
карнитинацилКоАтрансфераза 1, активируется этот фермент гормоном голода –
глюкагоном. Ингибируется – инсулином и регуляторным ферментом синтеза ЖК
(ацетилКоАкарбоксилаза).
Прежде чем вступить в β-окисление ЖК должна превратиться в активированную форму
– ацилКоА (см. Ресинтез жиров).
Активирование происходит в цитоплазме. Мембрана митохондрий непроницаема для
активированных ЖК, их перенос происходит при участии специфического переносчика
карнитина. Под действием ферментов карнитинацилКоАтрансферазы 1и 2
активированная ЖК присоединяется сложноэфирной связью к спиртовой группе карнитина, образуется комплекс ацилкарнитин. Он диффундирует в митохондрию, где с помощью специфических ферментов ацильная группа с карнитина переносится на КоА. Перенесенная в митохондрии ЖК подвергается β-окислению включая 4 реакции в одном цикле, 2 из них имеют непосредственную связь с ЦПЭ, т.к. это реакции окисления.
В последнем цикле образуется 2 молекулы ацетилКоА.
Подсчет энергии.
Для того, чтобы подсчитать энергетический выход процесса необходимо найти число
ацетилКоА, образующихся при р-окислении и число циклов, необходимых для
расщепления ЖК.
Сп=10
Число ацетилКоА = n/2 — 10/2=5
В данном случае число ацетилКоА = 5 —> ЦТК à 5* 12=60АТФ
Число циклов = п/2 -1=4, т.к. в последнем цикле образуется 2 молекулы ацетилКоА.
В каждом цикле есть 2 реакции окисления:
1- идет с участием НАД —► Р/О = 3
2- идет с участием ФАД —> Р/О — 2, т.е. в каждом цикле за счет водородов от окисляемых
субстратов 1 и 3 реакции, в сопряженном синтезе образуется 5 АТФ, 5*4 = 20 АТФ
Итог: 20 + 60 =80АТФ – 1 АТФ (на активирование ЖК) – 79
79 АТФ выделится при окислении 10-углеродной ЖК.
ЖК с нечетным числом углеродных атомов окисляется аналогично, в последнем цикле
образуется вместе с ацетилКоА пропионилКоА —► в ЦТК энергетический выход будет
немного ниже.
Регуляторный фермент р-окисления активируется в период пониженной концентрации
УВ, а именно, при мышечной нагрузке и в период между приемами пищи. Период после
приема пищи называется абсорбционный, период между приемами пищи –
постабсорбционный.
Биосинтез кетоновых тел.
Кетоновые тела – это β-гидроксимасляная кислота или р-гидроксибутират, ацетоуксусная кислота или ацетоацетат, ацетон (только при патологии). Нормальная концентрация кетоновых тел в крови Змг в 100 мл или 0,03-0,05 ммоль/л. Основное кетоновое тело – это β-гидроксибутират.
Синтезируется только в печени, используется организмом в качестве источника энергии, при длительном голодании даже мозгом. Не использует кетоновые тела печень. Субстратом для синтеза является ацетилКоА (получаемый при β-окислении). Часть ацетилКоА поступает в 1ДТК, часть на синтез кетоновых тел. Процесс протекает в митохондриях. В результате синтеза кетоновых тел образуется вещество -промежуточное соединение, которое играет большую роль при синтезе кетоновых тел или Хс – это вещество называется 3-гидрокси-β-метилглутарилКоА (ГМГКоА). 2 молекулы ацетилКоА под действием фермента тиолаза превращается в ацетоацетилКоА. Он под действием фермента 3-гидрокси-β-метилглутарилКоАсинтетазы с участием еще одной молекулы ацетилКоА образует β-гидрокси-β-метилглутарилКоА. Под действием β-гидрокси-β-метилглутарилсинтетазы образуется ацетоацетат. Про патологии происходит декарбоксилирование ацетоацетата с образованием ацетона.
Распад кетоновых тел.
Для того, чтобы кетоновые тела использовались в качестве источника энергии, необходимо активировать ацетоуксусную кислоту. Реакция протекает под действием фермента сукцинилКоАацетоацетаттрансферазы (его нет в печени, поэтому печень кетоновые тела не использует).
Подсчитаем сколько молекул АТФ выделяется при расщеплении ацетоуксусной кислоты – 24 молекулы АТФ. Так как при регенерации сукцината в сукцинилКоА затрачивается 1 АТФ, то общее количество АТФ – 23 молекулы. При окислении β-гидроксибутирата – 3 АТФ + 23 = 26 АТФ выделяется.
При патологических состояниях, таких как сахарный диабет (недостаток инсулина) или при длительном голодании скорость синтеза кетоновых тел резко повышается и концентрация их в крови повышается до 90мг /100мл, а при сахарном диабете – до 140мг/100мл. При этих состояниях образуется ацетон, который выделяется с выдыхаемым воздухом, такое состояние называется кетоз. В результате накопления этих кислот в крови рН сдвигается в кислую сторону и такое состояние организма называется метаболический некомпенсированный ацидоз (помочь можно в/в введении гипертонического раствора глюкозы).
Почему при голодании и сахарном диабете концентрация кетоновых тел резко увеличивается? В условиях длительного голодания и сахарного диабета, когда клетки находятся в состоянии энергетического голода (нет глюкозы) и поэтому —> основным источником энергии в этих условиях становятся ЖК, в составе жиров, депонированных в жировой ткани. Распад жиров активируется глюкагоном (гормон голода), расщепившиеся жиры жировой ткани на глицерин и ЖК, мобилизуются, глицерин идет в печень, а ЖК подвергаются β-окислению во всех органах, кроме мозга. В результате образуется много ацетилКоА, который в норме практически весь поступил бы в ЦТК, но в условиях голодания и сахарного диабета ЦТК тормозится, т.к. оксалоацетат будет использоваться для синтеза глюкозы в глюконеогенезе, необходимой для работы мозга в этих условиях, т.к. мозг ЖК не использует.
Поэтому основное количество ацетилКоА, образующегося при р-окислении, идет на синтез кетоновых тел à их концентрация повышается.
Биосинтез высших ЖК.
Это синтез их из ацетилКоА, полученного при расщеплении углеводов. Протекает в цитоплазме и наиболее интенсивно в печени, в почках, в молочной железе в период лактации. В организме человека синтезируется в основном пальмитиновая кислота (С 16), а в митохондриях гепатоцитов происходит удлинение цепей синтезированных ЖК.
Регуляторная реакция процесса – образование из ацетилКоА малонилКоА под действием фермента ацетилКоАкарбоксилаза, коферментом является биотип или витамин Н. Активируется этот фермент гормоном инсулином, в период достаточного поступления углеводов (много глюкозы —> гликолиз —»ПВК —» много ацетилКоА для синтеза ЖК). Данный регуляторный фермент ингибирует регуляторный фермент β-окисления (карнитинацилтрансферазу).
В синтезе ЖК во всех этапах вместо HSKoA участвует ацилпереносящий белок (АПБ). В двух реакциях будет участвовать кофермент НАДФН, как источник Н в реакциях восстановления (НАДФН из пентозофосфатного пути).
Синтез ЖК «похож» на β-окисление, но наоборот: процесс циклический, но в конце каждого цикла происходит удлинение цепи ЖК на 2 углеродных атома. В конце синтеза пальмитиновой кислоты происходит отщепление АПБ. Процесс синтеза осуществляется пальмитатсинтетазным комплексом. Это доменный белок (состоит из 1 ППЦ, которая в нескольких участках формирует домен, в третичной структуре обладающий ферментативной активностью).
Включает в себя 6 участков, обладающих ферментативной активностью. Все вместе они объединены в АПБ, который связан с фосфопантонеатом (фосфорилированная пантотеновая кислота с SH-группой на конце). На этом конце и протекают все реакции, то есть S не выделяется в среду. Пальмитатсинтетаза имеет 2 функциональные единицы, каждая из которых синтезирует 1 пальмитиновую кислоту.
Источник: kursak.net
