1. Преображенский Д.В., Сидоренко Б.А., Шатунова И.М., Александрова А.Ю. Застойная хроническая сердечная недостаточность с нормальной систолической функцией левого желудочка // Кардиология. — 2001. — № 1. — С. 85–91. / Preobrazhenskiy D.V., Sidorenko B.A., Shatunova I.M., Alexandrova A.Y. Congestive chronic heart failure with normal systolic function of left ventricle // Сardiology [Kardiologiya]. — 2001. — № 1. — P. 85–91 [Russian].
2. Owan T.E., Hodge D.O., Herges R.M. et al. Trends in preva- Owan T.E., Hodge D.O., Herges R.M. et al. Trends in preva- Owan T.E., Hodge D.O., Herges R.M. et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction // N. Engl. J. Med. — 2006. — Vol. 355, № 3. — P. 251–259.
3. Libby P., Bonow R.O., Mann D.L., Zipes D.P. Braunwald’s heart disease: a textbook of cardiovascular medicine. — 8e. — NY, 2007. — 2400 p.
4. Owan T.E., Redfield M.M. Epidemiology of diastolic heart failure // Progress Cardiovasc. Dis. — 2005. — Vol. 47, № 5. — P. 320–332.
5. Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. Хроническая сердечная недостаточность. Избранные лекции по кардиологии. — М.: Гэотар-Медиа, 2006. — 432 c. / Belenkov Y.N., Mareev V.Y., Ageev F.T. Chronic heart failure. Selected lectures on cardiology. — Мoscow: Geotar-Media, 2006. — 432 p. [Russian].
6. Шляхто Е.В., Шварц Е.И., Нефёдова Ю.Б. и др. Диастолическая дисфункция у больных гипертонической болезнью: распространённость, гемодинамические, демографические и генетические детерминанты // Сердечная недостаточность. — 2003. — № 4. — С. 187–189. / Shlyakhto E.V., Schwartz E.I., Nefyodova Y.B. et al. Diastolic dysfunction in patients with hypertensive disease: prevalence, haemodynamic, demographic and genetic determinants // Heart Failure [Serdechnaya Nedostatochnost’]. — 2003. — № 4. — P. 187–189 [Russian].
7. Горбаченков А.А., Борзова Н.В., Ананьева С.П., Хо- Горбаченков А.А., Борзова Н.В., Ананьева С.П., Хобот В.В. Сердечная недостаточность с преимущественным нарушением диастолической функции // Рос. кардиол. журн. — 2006. — № S. — С. 44–52. / Gorbachenkov A.A., Borzova N. V., Ananyeva S. P., Hobot V.V. Heart failure with primary disorder of diastolic function // Russian Cardiological Journal [Rossiyskiy Kardiologicheskiy Zhurnal]. — 2006. — № 5. — P. 44–52 [Russian].
8. Lenzen W., Reimer W., Bolrsma E. et al. Differens between patients with preserved and a depressed left ventricular function: a report from the Euro Heart Failure Survey // Eur. Heart J. — 2004. — Vol. 25, № 14. — P. 1214–1220.
9. Davie A.P., Francis C.M., Caruana L., Sutherland G.R. et al. The prevalence of left ventricular diastolic filling abnormalities in patients with suspected heart failure // Eur. Heart J. — 1997. — Vol. 18, № 6. — P. 981–984.
10. Pernenkil R., Vincon J., Shan A. et al. Course and prognosis in patients > 70 years of age with congestive heart failure and normal vs. abnormal left ventricular ejection fraction // Am. J. Cardiovasc. Drugs. — 1997. — Vol. 79. — P. 216–219.
11. Lang R.M., Bierig M., Devereux R.B. et al. Recommendations for chamber quantification // Eur. J. Echocardiography. — 2006. — Vol. 7, № 2. — P. 79–108.
12. Соломахина Н.И. Систолическая и диастолическая ХСН: взаимосвязь NT-proBNP с тяжестью клинических проявлений и нарушениями кардиогемодинамики // Сердечная недостаточность. — 2009. — № 1. — С. 16–21. / Solomakhina N.I. Systolic and diastolic chronic heart failure: relation of NT-proBNP level with severity of clinical manifestations and cardiohaemodynamic disorders // Heart Failure [Serdechnaya Nedostatochnost’]. — 2009. — № 1. — P. 16–21 [Russian].
13. Либис Р.А., Коц Я.И. Показатели качества жизни у боль- Либис Р.А., Коц Я.И. Показатели качества жизни у боль- Р.А., Коц Я.И. Показатели качества жизни у больных с хронической сердечной недостаточностью // Кардиология. — 1995. — № 11. — С. 13–17. / Libis R.A., Kots Y.I. Indicators of quality of life in patients with chronic heart failure // Cardiology [Kardiologiya]. — 1995. — № 11. — P. 13–17 [Russian].
14. Гарганеева Н.П. Концепция факторов риска в оценке прогноза сердечно-сосудистых заболеваний у пациентов с тревожными и депрессивными расстройствами // Сибирский вестник психиатрии и наркологии. — 2010. — № 2. — С. 63–66. / Garganeeva N.P. Concept of risk factors in assessment of prognosis of cardiovascular diseases in patients with anxiety and depressive disorders // Siberian Bulletin of Psychiatric and Narcology [Sibirskiy Vestnik Psikhiatrii i Narkologii]. — 2010. — № 2. — P. 63–66 [Russian].
15. Стаценко М.Е., Фабрицкая С.В., Туркина С.В., Спорова О.Е. Особенности поражения органов-мишеней, состояния углеводного и липидного обмена, качества жизни у пациентов с хронической сердечной недостаточностью и сахарным диабетом 2 типа // Сердечная недостаточность. — 2010. — Т. 11, № 4. — С. 206–212. / Statsenko M.E., Fabritskaya S.V., Turki- С. 206–212. / Statsenko M.E., Fabritskaya S.V., Turki- . 206–212. / Statsenko M.E., Fabritskaya S.V., Turkina S.V., Sporova O.E. The features of target lesions, conditions of carbohydrate and lipidic exchange, quality of life in patients with chronic heart failure and diabetes 2 types // Heart Failure [Serdechnaya Nedostatochnost’]. — 2010. — T. 11, № 4. — P. 206–212 [Russian].
Источник: htn.almazovcentre.ru
1. Mosterd A, Hoes AW. Clinical epidemiology of heart failure. Heart 2007; 93(9):1137-46.
2. Headenreich PA, Trogdon JG, Khavjou OA, et al. Forecasting the future of cardiovascular disease in the United States: a policy statement from the American Heart Association. Circulation 2011; 123(8): 933-44.
3. Echeverria HH, Bilsker MS, Myerburg RJ, et al. Congestive heart failure: Echocardiography insights. Am J Med 1983; 75(5): 750-55.
4. Owan TE, Hodge DO, Herges RM, et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. New Engl J Med 2006; 355(3): 251-59.
5. Smiseth OA, Tendera M. Diastolic heart failure. Springer-Verlag London Limitted 2008; 349 p.
6. Mareev VYu. the Contribution of a violation of diastole in the formation and progression of cardiovascular continuum Heart. Educational application: Heart failure with preserved systolic left ventricular function — the epidemic of the XXI century, 2010; 2: 1-5. Russian (Мареев В. Ю. Вклад нарушения диастолы в формирование и прогрессирование сердечно-сосудистого континуума Сердце. Образовательное приложение: Сердечная недостаточность с сохраненной систолической функцией левого желудочка — эпидемия XXI века 2010; 2: 1-5).
7. Van Heerebeek L, Borbely A, Niessen HWM et al. Myocardial structure and function differ in systolic and diastolic heart failure. Circulation 2006; 113(16): 1966-73.
8. National guidelines SSHF, RSC and RNMOT for the diagnosis and treatment of CHF (fourth revision). Heart failure 2013; 14(7): 379-472. Russian (Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр). Сердечная недостаточность 2013; 14(7): 379-472).
9. Tereschenko SN. Diastolic heart failure: soluble Lee difficulties of diagnosis and treatment? Therapeutic archive 2009; 81(11): 73-6. Russian (Терещенко С. Н. Диастолическая сердечная недостаточность: разреши¬мы ли трудности диагностики и лечения? Терапевтический архив 2009; 81(11): 73-6).
10. Ha J-W, Oh JK. Therapeutic strategies for diastolic dysfunction: a clinical perspective. Cardiovascular Ultrasound 2009; 17(3): 86-95.
11. Guyatt GH, Thompson PL, Berman LB, et al. How should we measure function in patients with chronic heart and lung disease? J Chron Dis 1985; 38(6): 517-24.
12. Mentz RJ, Kelly JP, Von Lueder TG, et al. Noncardiac comorbidities in heart failure with reduced versus preserved ejection fraction. Journal of the American College of Cardiology 2014; 64(21): 2281-93.
13. McMurray JJ, Adamopoulos S, Anker SD et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure 2012; 14(8): 803-69.
14. Owan TE, Redfield MM. Epidemiology of diastolic heart failure. Progress in Cardiovascular Diseases 2005; 47(5): 320-32.
15. Epidemiology of chronic heart failure in the Russian Federation. Chronic heart failure. Moscow: GEOTAR-Media 2010: 7-77. Russian (Эпидемиология хронической сердечной недостаточности в Российской Федерации. Хроническая сердечная недостаточность. М.: ГЭОТАР-Медиа 2010: 7-77).
Источник: cardiovascular.elpub.ru
Хроническая сердечная недостаточность (ХСН) является клиническим синдромом, распространенность которого в популяции носит характер эпидемии. В США, по данным 2013 г., этот диагноз имели 5,1 млн пациентов, и ожидается, что частота заболевания вырастет на 25% к 2030 г. ХСН характеризуется тяжелым состоянием пациентов, приводит к снижению качества жизни, к инвалидности и смерти. Существует два морфофункциональных типа ХСН, критерием которых считают фракцию выброса (ФВ) левого желудочка (ЛЖ), — с низкой ФВ и сохраненной. Распространенность обоих типов ХСН увеличивается с возрастом, но ХСН с сохраненной ФВ (ХСНсФВ) является наиболее частой причиной госпитализации пациентов старше 65 лет и оценивается как основной тип в будущем [1].
В классификации Европейского общества кардиологов 2016 г. впервые выделена промежуточная форма ХСН, или ХСН среднего диапазона, с ФВ 40–49%. Ее объективные диагностические критерии: повышенные уровни натрийуретических пептидов (НУП), структурные и функциональные признаки поражения сердца (не отличаются от используемых при диагностике ХСНсФВ).
ХСНсФВ рассматривается как полиэтиологичный синдром, характеризующийся острым или хроническим повышением давления заполнения ЛЖ. Частота его в популяции примерно равна частоте ХСН со сниженной ФВ. Различий между клиническими проявлениями обсуждаемых типов ХСН не существует. Наиболее частыми и неспецифичными симптомами являются одышка и слабость при физической нагрузке (ФН). Пациенты с ХСНсФВ старше, одновременно страдают АГ, ожирением, сахарным диабетом и хронической болезнью почек (ХБП), среди них преобладают женщины [2].
Коморбидность больше влияет на прогноз заболевания и физическое состояние этих пациентов, чем на симптоматику и прогноз при ХСН со сниженной ФВ [3].
Неблагоприятное влияние на прогноз обоих синдромов примерно одинаково. Диагностика ХСНсФВ должна основываться на клинических симптомах при наличии признаков структурных изменений: гипертрофии ЛЖ (ГЛЖ), дилатации левого предсердия (ЛП), диастолической дисфункции ЛЖ (ДДЛЖ) при малоизмененной ФВ ЛЖ. Предложен достаточно сложный алгоритм на основе анализа скоростных параметров митрального кровотока и базальных структур сердца, определенных с помощью ЭхоКГ, с привлечением биомаркеров — НУП. Однако такой подход имеет низкую чувствительность, и большинство пациентов с ХСНсФВ остаются в так называемой серой (пограничной) зоне, исключающей точный диагноз.
АГ является наиболее частым фактором риска и главным предшественником ХСН [4]. Стратегии, направленные на раннее агрессивное снижение АД, наиболее эффективны в профилактике ХСН. Поскольку большинство случаев ХСНсФВ связаны с АГ, прием ингибиторов АПФ или блокаторов рецепторов ангиотензина II должен быть частью лечения таких больных. У пациентов с ХСНсФВ на фоне АГ существенно более выражены ГЛЖ и дилатация ЛП в сравнении с гипертониками без признаков ХСН [5].
Ожирение имеет высокую корреляцию с функциональным классом ХСН, обусловливает выраженность одышки. Наряду с воспалительной реакцией, дислипидемией, ожирение вызывает микроваскулярную дисфункцию, что становится причиной системной АГ, необструктивной ишемии миокарда, ХБП, дисциркуляторной энцефалопатии, легочной гипертензии при ХОБЛ [6].
В последнее время намечается смена парадигмы в отношении ХСНсФВ как коморбидного статуса с проявлениями системного и микроциркуляторного воспаления, а не первичного структурного и функционального поражения миокарда [7].
ДДЛЖ — это не клинический синдром, и она не означает наличие ХСН у данного пациента. Первоначально ХСНсФВ обозначалась как диастолическая ХСН, что, однако, не считается корректным термином. Диастолическая ХСН предполагает единственный механизм, что не может относиться ко всем пациентам с сохраненной ФВ. С другой стороны, ДДЛЖ есть у каждого больного со сниженной ФВ, она не является характеристикой исключительно ХСНсФВ [8].
ДДЛЖ — лишь один из механизмов формирования ХСНсФВ, который может сочетаться с перегрузкой объемом (почечная дисфункция), с легочной гипертензией (при морбидном ожирении и синдроме ночного апноэ), с недостаточной периферической артериальной вазодилатацией, низкой экстракцией кислорода скелетной мускулатурой при ФН и с хронотропной недостаточностью [9].
Полностью механизм возникновения ХСНсФВ не установлен, тем более что в отличие от ХСН с низкой ФВ до сих пор не разработаны эффективные терапевтические стратегии. Отчасти это объясняется отсутствием четких дефиниций и включением гетерогенных групп пациентов с различными степенями тяжести заболевания без проявлений ХСН. Для больных ХСН выработана одна стратегия — стандартное сочетание блокаторов ренин-ангиотензин-альдостероновой системы (РААС), β-блокаторов, блокаторов минералокортикоидных рецепторов. Для пациентов с ХСНсФВ наиболее целесообразной стратегией считается разгрузка миокарда путем коррекции АД и сопутствующих синдромов. Эти данные — обоснование тактики ведения пациентов с ХСНсФВ, направленной на агрессивное лечение коморбидности. Примерно 50% таких больных страдают ожирением, а ИМТ более 35 кг/м2 — независимый прогностически неблагоприятный маркер летального исхода. Кроме того, ожирение — независимый этиологический фактор этого типа ХСН [10].
Патофизиологические механизмы ДДЛЖ полностью не объяснены. Под ней понимают неспособность желудочка к адекватному заполнению без увеличения давления в соответствующем предсердии. Обсуждаются и другие механизмы — хронотропная недостаточность, коронарная болезнь, коронарная микроваскулярная рарефикация, фиброз и умеренная систолическая дисфункция [11].
Коронарная микроваскулярная воспалительная реакция рассматривается как ключевой фактор прогрессирования ХСНсФВ. Увеличение жесткости миофибрилл и экстрацеллюлярного матрикса приводят к нарушению диастолической функции желудочков. Причиной ее считают уменьшение фосфорилирования титина, опосредованного протеинкиназой. В последних работах найдена прямая корреляция воспалительной активности в эндодомиокардиальных биоптатах с выраженностью ДДЛЖ [12].
Таким образом, ХСНсФВ представляется одним из заключительных элементов сердечно-сосудистого континуума, ассоциированной с пожилым возрастом, коморбидностью, что существенно затрудняет точную диагностику. В реальной клинической практике малая специфичностью симптоматики ХСН приводит к ее гипердиагностике у пациентов с ХБП, анемией, ХОБЛ, мальнутрицией, характерных для больных старческого возраста. С другой стороны, у пациентов с ожирением одышка, слабость и отечность нижних конечностей могут быть недооценены как проявления ХСН, что приводит к гиподиагностике этого синдрома.
Не существует параллелизма между степенью ДДЛЖ и выраженностью клинических проявлений ХСН. То есть мерилом ХСН как клинического синдрома, основные проявления которого возникают при физическом усилии, является значимость для организма недостаточного прироста сердечного выброса при физическом стрессе.
Методы диагностики субклинической диастолической дисфункции
Морфологической и функциональной основой ХСН как клинического синдрома считается дисфункция миокарда. Доказано, что наиболее распространенная кардиальная патология в начальных фазах развития характеризуется ДД с признаками нарушенного расслабления в раннюю диастолу с последующим увеличением жесткости миокарда. У ряда пациентов патологические процессы приводят к усугублению диастолических расстройств вплоть до формирования крайней степени — рестриктивного типа, у других формируется дилатационный морфофункциональный тип с кардиомегалией и снижением ФВ.
Согласно классификации Американской коллегии кардиологов/Американской ассоциации сердца выделяют 4 стадии ХСН:
А — высокий риск ХСН при отсутствии структурной патологии сердца или симптомов сердечной недостаточности;
В — структурные поражения сердца без симптомов ХСН;
С — симптомная ХСН;
D — тяжелая ХСН, рефрактерная к лечению.
Оценка толерантности к ФН — хорошо апробированный метод определения тяжести ХСН. У здоровых людей при ФН сердечный выброс возрастает более чем в 3 раза за счет координированного увеличения темпа сердечных сокращений, вазодилатации и преднагрузки. Способность увеличивать объем преднагрузки при ФН является важным механизмом, с помощью которого стареющее сердце поддерживает сердечный выброс в условиях частичной утраты хронотропного и вазодилатационного резервов. Кроме того, в норме рост диастолического наполнения при ФН осуществляется благодаря большей степени сокращения, связанного с адренергической стимуляцией, что формирует т. н. феномен «отдачи» в раннюю диастолу, реализуемый за счет вязко-эластических свойств волокон миокарда. У здоровых людей скорость расслабления миокарда в фазу изоволюмического расслабления увеличивается на 50%.
Другой причиной повышения конечно-диастолического давления является жесткость миокарда. Наиболее значительный рост конечно-диастолического давления при ФН наблюдается у пациентов с выраженным рестриктивным (ограничительным) типом диастолических расстройств. Фиброз, увеличение толщины стенки ЛЖ при малом конечно-диастолическом его объеме, соответствующие понятию концентрической гипертрофии, — основные детерминанты жесткости. Таким образом, общим для ХСН с сохраненной и сниженной ФВ ЛЖ является недостаточный прирост ударного объема сердечного выброса, что приводит к одинаковой клинической картине, проявляющейся одышкой и слабостью при ФН. Однако ведущим механизмом при ХСН со сниженной ФВ считается недостаточность собственной способности миокарда к укорочению, а при ХСНсФВ — недостаточный резерв преднагрузки.
ЭхоКГ играет основную роль в диагностике ДД. Однако получаемые параметры зависят от темпа сердечных сокращений, от пред- и постнагрузки. Наиболее известный параметр Е/А отражает соотношение объемов крови: поступающего в раннюю диастолу и превалирующего в норме Е-пики объема предсердного пула, который отражает пик А, завершающий диастолический период. В своих начальных проявлениях ДДЛЖ — результат нарушенной его релаксации, сопровождающейся уменьшением восстанавливающих воздействий, таких как отдача в ранний диастолический период. Повышенное диастолическое давление в ЛЖ при отсутствии роста объема ЛЖ является сильным аргументом в пользу ДДЛЖ. Термин «давление заполнения ЛЖ» относится к давлению заклинивания легочной артерии, к среднему давлению в ЛП, среднему диастолическому давлению и конечно-диастолическому давлению в ЛЖ (КДДЛЖ).
В ранних фазах ДДЛЖ возрастает только КДДЛЖ из-за увеличения объема систолы предсердия, в то время как среднее давление в ЛП и заклинивающее остаются в норме. Доплеровские параметры поздней диастолы хорошо коррелируют с КДДЛЖ. Они включают пиковую скорость волны А, ее длительность, пиковую скорость регургитируемой предсердной волны на уровне легочных вен, тканевые параметры доплерографии — скорость движения фиброзного кольца митрального клапана, соответствующую предсердному сокращению (Аm). Раннюю диастолу отражают пиковая скорость трансмитрального потока в фазу быстрого наполнения Е, отношение Е/А, замедление волны Е, отношение Е/Еm, пиковая скорость трикуспидальной регургитации как суррогатный критерий легочной гипертензии. Существуют тесные прямые корреляции между перечисленными параметрами с одной стороны и давлением заклинивания легочной артерии, КДДЛЖ с другой. Оценка ДД затруднена в связи с тем, что параметры ЭхоКГ частично совпадают в группах здоровых и больных и нет изолированного параметра, который имел бы всеобъемлющее значение для диагностики. При физиологическом старении скорость расслабления ЛЖ уменьшается, и пациенты 40–60 лет имеют в норме профили заполнения, соответствующие умеренной ДД в молодости. У пожилых это объясняется преимущественно увеличенной жесткостью ЛЖ. Снижение Еm связано с уменьшением скорости раннего расслабления. Есть также ряд индексов, мало зависящих от возраста, например Е/Em, изменение митрального потока при пробе Вальсальвы. На рисунке показано уменьшение пиковой скорости трансмитрального потока при I степени ДД с последующим нарастанием пика Е и увеличением Е/А на III стадии рестриктивных нарушений.
Реверсивное отношение Е/А при легкой ДД свидетельствует о снижении скорости быстрого наполнения ЛЖ и активации предсердной функции при отсутствии увеличения давления в ЛП в момент открытия митрального клапана. В то же время исследование скорости движения кольца митрального клапана демонстрирует прогрессивное снижение раннего расслабления независимо от давления в ЛП в раннюю диастолу.
Предложены параметры и их уровни [13], свидетельствующие о поражении миокарда: септальная скорость Еm менее 7 см/с, латеральная скорость Em менее 10 см/с, Е/Em более 14, индекс ЛП более 34 мл/м2, пиковая скорость трикуспидальной регургитации более 2,8 м/с. Наиболее полезными критериями ДДЛЖ являются соотношения латеральных Е/Em более 13 и септальных Е/Em более 15. Считается, что диастолическая функция ЛЖ сохранена, если половина из рекомендуемых выше показателей не выходит за нормальные пределы. Если соотношение Е/А менее 0,8 и скорость пика Е менее 0,5 м/с, то среднее давление в ЛП — низкое или нормальное, что соответствует I степени ДД. Если отношение Е/А более 2, среднее предсердное давление повышено, и это соответствует III степени ДДЛЖ.
У лиц до 40 лет отношение Е/А может быть больше 2 в норме, поэтому у них необходимо использовать другие параметры в качестве критериев ДДЛЖ. Достаточная скорость митрального кольца в пике Е верифицирует нормальную диастолическую функцию. Если Е/А менее 0,8 и скорость пика Е более 0,5м/с или если Е/А от 0,8 до 2, то следует рассмотреть индекс ЛП и наличие признаков легочной гипертензии: если индекс объема ЛП более 34 мл/м2, а пиковая скорость трикуспидальной регургитации более 2,8 м/с, то диагноз ДДЛЖII степени сомнений не вызывает.
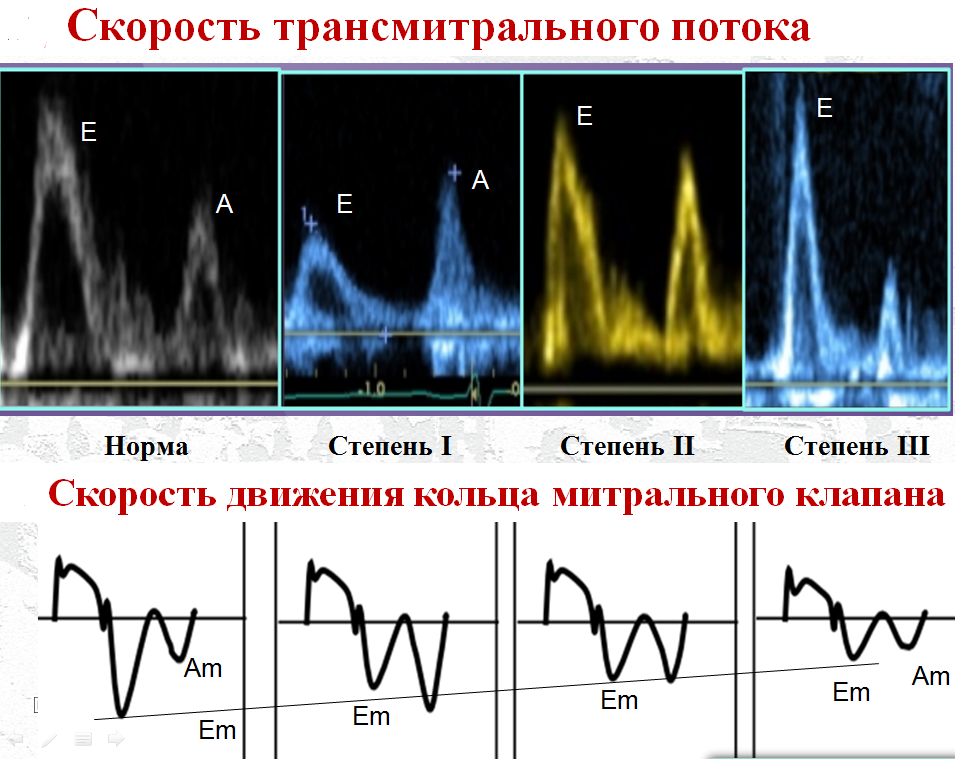
Рис. Доплерография трансмитрального потока (пиковая скорость фазы быстрого наполнения Е и пиковая скорость в фазу систолы предсердий А) и латеральной части фиброзного кольца митрального клапана (пиковая скорость в фазу быстрого наполнения Em и систолы предсердий Am в норме и при I–III степенях диастолической дисфункции. Показано прогрессивное уменьшение Em пропорционально выраженности диастолической дисфункции левого желудочка
Если только один из этих параметров соответствует патологическому значению, то давление в ЛП следует считать нормальным, имеется ДД I степени. Если два и более параметра выходят за рамки нормы, то давление в ЛП повышено и наблюдается ДД II степени. Если доступен для анализа только один параметр, то диагноз ДДЛЖ не может быть установлен. Важным параметром является объем ЛП, хотя авторы рекомендаций [13] считают, что отсутствие увеличения ЛП не исключает во всех случаях ДДЛЖ.
Увеличение ЛП коррелирует с ростом давления заполнения ЛЖ, и чем сильнее он увеличен, тем хуже прогноз диастолической ХСН. Поэтому размер ЛП называют барометром ДД [14]. Принято считать, что небольшой размер ЛП исключает значительное увеличение давления, а значительный объем ЛП может не отражать повышенное давления в нем [15]. В случае пограничных состояний показано проведение диастолического стресс-теста [16].
Уровни натрийуретических пептидов как диагностический критерий хронической сердечной недостаточности с сохраненной фракцией выброса
Уровни НУП рассматриваются как хорошо апробированные критерии ХСН со сниженной ФВ. Их измерение рекомендуется и при ХСНсФВ, согласно европейским рекомендациям 2016 г. Однако их чувствительность в последнем случае меньше. Это связано с тем, что содержание НУП более точно отражает внутримиокардиальное напряжение в диастолу, чем давление заполнения ЛЖ. У пациентов с ХСН на фоне ДДЛЖ внутримиокардиальный стресс типично снижен, чему способствует ГЛЖ. Нормальные уровни НУП обнаруживаются у 30% пациентов с ХСНсФВс подтвержденной инвазивно ДДЛЖ по значительно увеличенному диастолическому давлению в его полости [17].
Ожирение также ассоциировано с низкой активностью НУП [18]. Все эти факты снижают клиническую ценность уровней НУП как биологических маркеров ХСН на фоне ДД и позволяют рассматривать повышение концентраций НУП как дополнительный признак ХСН при наличии обязательных критериев ДДЛЖ по ЭхоКГ или по данным катетеризации левых отделов сердца. Очевидно, что мы должны разделять использование уровней НУП как маркеров ХСН вследствие ДДЛЖ и как «предсказателей» сердечно-сосудистых осложнений у этой категории пациентов с уже установленным диагнозом.
Значение диастолического стресс-теста в выявлении ранних признаков диастолической дисфункции
Диастолический стресс-тест позволяет выявить ранние стадии ДД. При ФН происходит рост Е-пика за счет феномена «отдачи». Под ним понимают механическое повышение присасывающей силы желудочков в раннюю диастолу, вызванное увеличением силы и скорости их сокращения в предшествующую систолу. Феномен «отдачи» является проявлением вязко-эластических свойств миокарда аналогично поведению пружины, сила распрямления которой пропорциональна степени ее укорочения. Это увеличение инотропной функции желудочков в условиях ФН стимулируется выбросом катехоламинов, которые в то же время оказывают самостоятельный эффект, ускоряя раннее расслабление миокарда ЛЖ у здоровых людей.
Одновременно с увеличением пика Е пропорционально увеличивается пик Еm, поэтому их соотношение меняется мало. У испытуемых среднего возраста, как и у молодых, соотношение Е/Еm было равно 6 в покое и увеличивалось до 8 во время нагрузки [19]. Диастолические параметры при нагрузке более тесно коррелируют с физической работоспособностью, чем параметры диастолы в покое. Чем выше скорость миокардиального расслабления при ФН, тем выше работоспособность. Несколько исследований показали рост соотношения Е/Еm у пациентов с ДД и выраженную корреляцию этого параметра с давлением заклинивания в легочной артерии, с давлением в ЛП или со средним диастолическим давлением ЛЖ [20].
Авторы исследования, направленного на выявление ранних маркеров ХСН у гипертензивных пациентов с нормальной ЭхоКГ покоя, из 99 пациентов выделили две группы — без признаков одышки в покое и с одышкой при физическом напряжении без физикальных признаков ХСН. Изучение параметров ЭхоКГ в покое не продемонстрировало какие-либо различия, однако при ФН в группе с диспноэ были ниже скорость движения митрального клапана в фазу раннего наполнения, в систолу и выше отношение Е/Еm. При многофакторном анализе только Е/Еm было значимо ассоциировано с диспноэ [21]. Авторы считают, что сниженный диастолический резерв приводит к увеличению давления заполнения ЛЖ, индикатором которого является соотношение Е/Еm.
В рекомендациях [13] указано, что пациенты с нормальным Еm латеральной части фиброзного кольца миокарда не нуждаются в стресс-тесте, поскольку у них вряд ли разовьется ДД и усилится при стрессе. В нем также нет необходимости, если в покое у пациента наблюдаются выраженные признаки ДДЛЖ. Следовательно, кандидатами на данную процедуру становятся пациенты с I типом ДДЛЖ — замедленным расслаблением ЛЖ и низким давлением наполнения. Тест считается положительным, если получены все три критерия ДДЛЖ: Е/Еm более 14, пиковая скорость трикуспидальной регургитации более 2,8 м/с, латеральная скорость менее 10 см/с. Результаты являются нормальными, если септально Е/Еm менее 10 при нагрузке и скорость трикуспидальной регургитации составляет менее 2,8 м/с. Надо иметь ввиду, что изолированное повышение скорости трикуспидальной регургитации описано у здоровых молодых людей при ФН.
Роль артериальной гипертензии в формировании структурных изменений и субклинической диастолической дисфункции
ГЛЖ — наиболее частый признак структурных изменений миокарда. ГЛЖ подразделяют на два типа — концентрическую и дилатационную. В последнее время концентрическую ГЛЖ также делят на два типа: 1) без увеличения индекса конечно-диастолического объема ЛЖ; 2) с увеличением этого индекса. Из когорты Framingham Heart Study были выделены 4768 пациентов без признаков ХСН и перенесенного инфаркта миокарда (средний возраст — 50 лет). Сформированы 4 группы по данным ЭхоКГ: без ГЛЖ, с эксцентрическим ремоделированием, с концентрической ГЛЖ и эксцентрической ГЛЖ. За 21 год наблюдения у 458 (9,6%) человек развилась ХСН. Частота ХСН в группе без ГЛЖ составила 6,96%, в группе с концентрическим ремоделированием — 8,67%, с концентрической ГЛЖ — 13,38%, с эксцентрической ГЛЖ — 15,27% [22].
МРТ сердца является наиболее точным неинвазивным методом оценки ГЛЖ. В исследовании Dallas Heart Study показано, что I тип ГЛЖ был ассоциирован с комбинированной конечной точкой — диагнозом ХСН или сердечно-сосудистой смертностью, которая в этой группе составила 11,8% против 2,0% у пациентов без ГЛЖ, а у больных с комбинированной гипертрофией стенок и увеличением конечно-диастолического объема ЛЖ наблюдался II тип. Данные события регистрировались у 42,9% участников [23].
Частота АГ при концентрической ГЛЖ составила 74% против 23% у пациентов без ГЛЖ. I тип концентрической ГЛЖ сопровождался увеличением уровня высокочувствительного тропонина плазмы крови у 43% пациентов, II тип ГЛЖ — у 100%, у пациентов без ГЛЖ он был повышен лишь в 24% случаев. Поскольку содержание тропонинов отражает специфично и чувствительно процессы повреждения миокарда, его рост позволяет объяснить бóльшую частоту новых случаев ХСН и смертность среди пациентов с фенотипами концентрической ГЛЖ [23].
У пациентов с маскированной АГ отношение Е/Еm выше, оно отражает повышение КДДЛЖ, а пиковая скорость Еm (параметр расслабления ЛЖ) значимо ниже, чем у нормотензивных, не отличалась от параметров диастолы пациентов с явной нелеченой АГ, и оба доплеровских параметра не зависели от индекса массы миокарда ЛЖ. При этом нарушения диастолической функции в группах с устойчивой АГ и с маскированной АГ не сопровождались значимой ГЛЖ [24]. Средний возраст обследованных составил 45 лет, 66% имели семейный анамнез АГ. Эти данные позволяют говорить о первичных изменениях диастолы даже при эпизодическом повышении АД без явных структурных изменений миокарда левых отделов сердца.
Замедление наполнения ЛЖ является чувствительным индикатором всех типов поражения миокарда, связанных с возрастом; ишемией и почти всех известных факторов риска, включая метаболический синдром [25]. С другой стороны, обратное развитие ДДЛЖ продемонстрировано при коррекции этих факторов риска, включая малоподвижный образ жизни и ожирение [26].
Вызывают интерес исследования влияния постнагрузки ЛЖ на скорость движения кольца митрального клапана в раннюю диастолу. Изучались эффективный артериальный эластанс, системное сосудистое сопротивление, каротидный характеристический импеданс, индексы поздней систолической нагрузки, индекс аугментации центрального давления в аорте и поздний интеграл «давление/время», а также жесткость аорты по каротидно-феморальной скорости распространения пульсовой волны.
Параметр Еm обратно коррелировал с эластансом (жесткостью ЛЖ), со скоростью распространения пульсовой волны, каротидным сопротивлением и потерей артериальной податливости. Наличие АГ не изменяло эту зависимость. Однако параметры поздней систолической нагрузки особенно сильно влияли на скорость расслабления ЛЖ в ранней диастоле [26]. Таким образом, имеются четкие данные об ухудшении диастолических свойств миокарда ЛЖ при увеличении его постнагрузки как в состоянии покоя, так и при ФН, что позволяет расценивать увеличенную постнагрузку как терапевтическую мишень для восстановления диастолических свойств миокарда ЛЖ. Это особенно важно у пациентов пожилого возраста с АГ.
В наших собственных исследованиях монотерапия периндоприлом у пациентов с гипертонической болезнью и субклинической ДД (СДД) ЛЖ была высокоэффективна: способствовала достижению целевых параметров АД в покое и при ФН, улучшению функции сосудистого эндотелия и снижению ЧСС. Присоединение ивабрадина к периндоприлу у пациентов с ЧСС выше 75 уд/мин в покое позволяет нормализовать ЧСС в покое и избыточный прирост темпа сердечных сокращений при ФН, что сопровождается наиболее выраженным уменьшением двойного произведения — суммарно на 60% [27].
В исследовании Flemengho Study [28] у 650 человек (средний возраст — 50,7 года) в течение 4,7 года изучались наиболее информативные предикторы ухудшения ДДЛЖ. Распространенность АГ составила 41,2% и выросла к концу исследования до 51,2%, частота сахарного диабета — 4%. За время наблюдения у больных уменьшились пиковые скорости митрального потока Е и А, отношение Е/А, а также параметры тканевого доплера: Еm (на 15%), Аm и Еm/Аm. При этом увеличились Е/Еm (на 7%) и индекс ЛП.
Наиболее значимыми предикторами возникновения ДДЛЖ являются возраст, темп сердечных сокращений и прирост ЧСС за время наблюдения. Удвоение уровня инсулина в крови по сравнению с исходной концентрацией повышало риск усиления ДДЛЖ на 184%. Высокое исходное диастолическое АД (ДАД) и прирост систолического АД (САД) предсказывали переход от I ко II степени ДДЛЖ. При повышении ДАД на 10 мм рт. ст. риск увеличивался на 102%, а при повышении САД на 10 мм рт. ст. — на 47% [28].
Этот же авторский коллектив, используя имевшиеся данные по 793 обследованным из той же популяции, изучил влияние параметров диастолы на частоту сердечно-сосудистых событий. ДДЛЖ I степени, определяемая по признакам нарушения расслабления в раннюю диастолу, выявлена у 9,6%; ДДЛЖ II степени, критериями которой были перечисленные признаки повышения давления заполнения ЛЖ, — у 12,1%; III степени (комбинированная дисфункция) — у 3,4%. Уменьшенная скорость Еm статистически значимо предсказывала сердечно-сосудистые и кардиальные события (р < 0,001). Этот показатель позволял реклассифицировать риск, увеличивая точность прогноза сердечно-сосудистых событий на 54% и кардиальных на 64% .
Повышение давления наполнения ЛЖ повышало сердечно-сосудистый риск в 2,21 раза и кардиальных осложнений в 4,5 раза в сравнении с теми, кто имел нормальную диастолическую функцию ЛЖ. Эти результаты согласуются с данными литературы о роли Е/Еm как независимого предиктора фатальных и нефатальных кардиальных событий [29]. В более раннем исследовании низкая скорость Еm независимо предсказывала смерть у 174 пациентов с АГ [30].
Имеющиеся возможности гипотензивной терапии в профилактике ХСНсФВ являются дополнительным свидетельством значимости АГ в прогрессировании СДД до явных клинических признаков ХСН. В большой когорте обследованных в HOPE показано, что применение ингибиторов АПФ у пациентов с высоким риском снижало вероятность ХСН, особенно у больных с АГ (на 37%) [31]. АГ как долговременный фактор не только вызывает ремоделирование сердца из-за перегрузки сопротивлением ЛЖ и увеличение его преднагрузки за счет нейрогуморальных сдвигов, но также способствует системному низкоинтенсивному воспалению. Поэтому нормализация АГ может снизить выраженность доклинической ДДЛЖ. Использование блокаторов РААС, ингибиторов АПФ и блокаторов минералокортикоидных рецепторов у пациентов с АГ является независимым предиктором улучшения прогноза. В подисследовании международного трайла ALLHAT у пациентов с АГ диуретики оказались более эффективны в предотвращении ХСН, чем кальциевый блокатор амлодипин [32].
Эпидемиология и клиническое значение субклинической диастолической дисфункции
Точная распространенность СДД неизвестна. Случайная выборка из когорты MONICA выявила ДДЛЖ у 11% участников. Доступны всего 4 публикации, в которых содержатся такие сведения. Первая степень бессимптомных диастолических расстройств выявлена у 20,6% больных, умеренная и выраженная — у 6,8% [33]. Через 4 года наблюдения распространенность ДД увеличилась до 39,2%. В группе высокого риска у пациентов с гипертонической болезнью и ИБС старше 65 лет частота ДДЛЖ легкой степени составила 47,6%, а умеренной и тяжелой — 16,5%. К тому же среди пациентов с выраженной ДДЛЖ меньше половины имели диагноз ХСН.
Эти результаты согласуются с данными исследования [34], которое выявило, что 86% больных с умеренной и тяжелой ДДЛЖ при нормальной ФВ находились в доклинической фазе болезни по Фрамингемским критериям, и 36% из них не имели клинических симптомов ХСН по Нью-Йоркской классификации.
Частота доклинической ДДЛЖ в общей популяции оценивается в 20–30%. В недавнем метаанализе исследований, включавших 25 369 пациентов, в течение 7,9 года изучалась вероятность ХСН у тех, кто на входе в исследование имел бессимптомную систолическую или диастолическую дисфункцию. Абсолютный риск прогрессии первоначально бессимптомной систолической дисфункции составил 8,4 на 100 человеко-лет, а ДД — 2,8 на 100 человеко-лет. В группе обследованных без признаков какой-либо дисфункции вероятность клинически выраженной ХСН — 1,04 на 100 человеко-лет. Максимальный скорректированный относительный риск для систолической дисфункции был наиболее высоким — 4,6 (2,2–9,8), а для ДД — 1,7 (1,3–2,2) [35]. Распространенность бессимптомной ДДЛЖ оценивается в 25%.
В исследовании «Предиктор» итальянской популяции из 1720 пожилых людей 65–84 лет изолированную ДДЛЖ нашли у 35% [36]. Авторы подтвердили связь ДДЛЖ со структурной патологией ЛЖ, повышением уровней НУП в крови, а также отметили снижение качества жизни.
Рост тяжести ДДЛЖ связан со степенью гипертрофии миокарда ЛЖ и объемом ЛП. ДДЛЖ независимо предсказывала общую смертность в модели, учитывающей возраст, пол и ФВ [33]. Субклиническая ДДЛЖ увеличивает вероятность клинической манифестации ХСН в 1,8 раза с коррекцией по возрасту, полу, наличию АГ, диабета и ИБС [37].
Заключение
Хроническая сердечная недостаточность с сохраненной фракцией выброса (ХСНсФВ) является клиническим синдромом — проявлением поздней фазы сердечно-сосудистого континуума. Она представляет собой частую геронтологическую проблему. Множественные факторы риска, ассоциированные с возрастом и коморбидностью, среди которых АГ играет главную роль, приводят к комплексному поражению всей сердечно-сосудистой системы, структурные и функциональные изменения которой становятся основой манифестной ХСНсФВ. Необратимость и полисистемность изменений при ХСНсФВ препятствуют эффективной терапии.
Субклиническая диастолическая дисфункция (ДД) — чрезвычайно распространенный инструментальный патофизиологический феномен, являющийся лишь одним из механизмов формирования ХСНсФВ. Значение субклинической ДД определяется ее возможностью предсказывать не только ХСН, но и широкий спектр сердечно-сосудистых осложнений. Идентификация ее у пациента, оценка выраженности требуют проведения комплексного эхокардиографического исследования, стресс-теста. Коррекция АГ, способствующая обратному развитию ДДЛЖ, высокоэффективна в профилактике ХСН, в том числе ХСНсФВ, а также сердечно-сосудистых исходов.
Источник: journal.therapy.school

