Фибрилляция и трепетание желудочков
Фибрилляция и трепетание желудочков – основная причина внезапной смерти.
Трепетание желудочков представляет собой частые поверхностные ритмичные сокращения желудочков с частотой 250 – 300 в 1 мин., возникающие по механизму риентри. На ЭКГ при трепетании желудочков выявляется синусоидальная кривая с широкими ритмичными волнами, на которой не различаются ни зубцы, ни изоэлектрическая линия (рис. 1.20, а). Фибрилляция желудочков, возникающая по механизму множественных риентри, проявляется на ЭКГ полиморфными осцилляциями с изменяющейся частотой от 300 до 600 в 1 мин. (рис. 1.20, б).
Трепетание и фибрилляция желудочков развиваются на фоне тяжелых органических изменений в миокарде, особенно часто при инфаркте миокарда, кардиомиопатиях, сердечной недостаточности.
Клиническая картина при трепетании и фибрилляции желудочков характеризуется внезапной остановкой кровообращения, что требует экстренного проведения реанимационных мероприятий, включая дефибрилляцию.
Синдром преждевременного возбуждения желудочков (синдром WPW)
Синдром преждевременного возбуждения желудочков, или синдром WPW [Wolff L., Parkinson J., White P. D., 1930], обусловлен наличием врожденных добавочных проводящих путей, представляющих собой сократительные кардиомиоциты, проникающие через предсердножелудочковое фиброзное кольцо и соединяющие предсердия и желудочки. По дополнительному пути импульс проводится быстрее, чем через атриовентрикулярный узел, что вызывает преждевременное возбуждение части миокарда желудочков.
На ЭКГ это проявляется укорочением интервала P – R < 0,12 с, формированием волны δ в начале желудочкового комплекса, в результате чего расширяется комплекс QRS. Вторичными являются изменения периода реполяризации желудочков – дискордантное смещение сегмента ST и инверсия зубца Т (рис. 1.21). Чаще выявляются правый и левый предсердножелудочковые пучки Кента, анатомическое расположение которых отражается на характере проявлений ЭКГ. Тип А наблюдается при аномальных трактах, соединяющих миокард левого предсердия и левого желудочка, и характеризуется высоким зубцом R с положительной волной δ в правых грудных отведениях. При типе В с пучком Кента между миокардом правого предсердия и правого желудочка в отведениях V1,2 отмечается отрицательная волна δ и желудочковый комплекс чаще типа QS. В обоих случаях в левых грудных отведениях желудочковые комплексы начинаются с положительной волны δ и напоминают блокаду левой ножки пучка Гиса.
Существует много других вариантов аномальных путей проведения с особенностями ЭКГ картины. Так, при синдроме укороченного интервала Р – R ускоренное проведение объясняют наличием дополнительного пути, соединяющего предсердия с пучком Гиса или нижней частью атриовентрикулярного узла (тракт Джеймса). Дополнительные пути в виде волокон Махейма, соединяющие атриовентрикулярный узел или пучок Гиса с миокардом желудочков, проявляются картиной неполной блокады левой ножки пучка Гиса.
Синдром WPW встречается в 1 – 2 случаях на 1000 человек, чаще у молодых, заметно реже после 50 лет. У 2/3 пациентов с синдромом WPW не находят органических изменений в сердце. Описаны сочетания синдрома WPW с другими врожденными дефектами, например с аномалией Эбштейна, незаращением межпредсердной или межжелудочковой перегородки.
Преждевременное возбуждение желудочков не оказывает существенного влияния на гемодинамику. У 50 % больных с синдромом WPW изменения на ЭКГ являются единственным признаком, обнаруживаются случайно, и это называют феноменом WPW. Существуют преходящие, интермиттирующие формы феномена WPW.
Главным клиническим проявлением у половины больных с синдромом WPW является развитие пароксизмальных наджелудочковых аритмий. В 80 % случаев – это пароксизмальные атриовентрикулярные реципрокные тахикардии, чаще ортодромные, в 15 – 30 % – фибрилляция предсердий и в 5 % – трепетание предсердий.
звивающиеся после экстрасистолы по механизму макрориентри пароксизмальные реципрокные атриовентрикулярные тахикардии при синдроме WPW всегда начинаются и прекращаются внезапно. При ортодромной атриовентрикулярной реципрокной тахикардии циркуляция импульса к желудочкам происходит по атриовентрикулярному соединению, а обратно к предсердиям – по дополнительному пути. Признаки WPW синдрома при этом исчезают на ЭКГ, комплексы QRS становятся узкими, зубцы Р отрицательные и предшествуют QRS.
При антидромной наджелудочковой тахикардии на ЭКГ регистрируются широкие комплексы QRS, и приходится проводить дифференциальный диагноз с желудочковой тахикардией. Зубцы Р наслаиваются на сегмент ST или зубец Т. Фибрилляция и трепетание предсердий на фоне синдрома WPW характеризуются нередко высокой частотой возбуждения желудочков, иногда достигающей 250 – 300 в 1 мин., что связано с высокой проводимостью по дополнительному пути и опасно нарушениями гемодинамики и трансформацией в фибрилляцию желудочков.
Все больные с нарушениями ритма и подозрением на синдром WPW нуждаются в проведении внутрисердечного электрофизиологического исследования для подтверждения диагноза, установления локализации добавочного пути и выявления больных с высоким риском внезапной смерти. При длительности эффективного рефрактерного периода дополнительного пути ≤260 мс велика опасность развития фибрилляции желудочков во время пароксизма фибрилляции или трепетания предсердий.
ектрофизиологическое исследование позволяет подобрать антиаритмические препараты для купирования пароксизмальных нарушений ритма и оценить возможность хирургического лечения. Больные с феноменом WPW на ЭКГ, без нарушения ритма и без высокого риска внезапной смерти, по данным электрофизиологического исследования, нуждаются в наблюдении и периодической съемке ЭКГ.
Лечение атриовентрикулярных реципрокных ортодромных пароксизмальных тахикардий проводится по обычным правилам: начинается с вагусных воздействий и введения АТФ. Для купирования антидромных реципрокных тахикардий при WPW синдроме необходимо выбирать антиаритмические препараты, которые блокируют проведение по дополнительному пути или одновременно – и по основному, и по дополнительному (табл. 1.25).
Таблица 1.25
Препараты, замедляющие проводимость по атриовентрикулярному узлу и по дополнительному пути
Как при ортодромных, так и при антидромных атриовентрикулярных тахикардиях предпочтение в купировании отдают новокаинамиду, используют также аймалин, при их неэффективности применяют препараты III класса, реже используют средства IС класса. При явном синдроме WPW, учитывая возможность трансформации пароксизмальной тахикардии в фибрилляцию предсердий, не рекомендуется применять сердечные гликозиды, верапамил и β-адреноблокаторы. Особенностью купирования фибрилляции и трепетания предсердий с выраженной тахисистолией желудочков при синдроме WPW является более частое использование ЭИТ. Основным способом радикального излечения нарушений ритма у больных с синдромом WPW является метод катетерной радиочастотной абляции дополнительного пути проведения, эффективность которого составляет 95 %.
Нарушения проводимости, или блокады сердца
Определение. Блокада сердца – это нарушение проведения импульса вследствие анатомического или функционального повреждения проводящих путей. Блокада может возникнуть в любом участке проводящей системы.
Классификация. По локализации блокады классифицируют на синоатриальную, внутрипредсердную, предсердножелудочковую (атриовентрикулярную) и внутрижелудочковую формы. В настоящее время выделяют также дисфункцию синусового узла, в основе которой может быть комбинация нарушений автоматизма и проводимости.
По течению нарушения проводимости могут быть преходящими и постоянными.
По тяжести блокады подразделяют на три степени. При I степени блокады время проведения увеличивается, но все импульсы проводятся. II степенью называют блокаду, при которой часть импульсов не проводится. I и II степени представляют неполную блокаду. При III степен и блокады ни один импульс из одного отдела проводящей системы не проводится в другой. Ее называют полной блокадой.
Этиология. Самой частой причиной блокад сердца является ИБС: это может быть преходящая ишемия миокарда, инфаркт миокарда, постинфарктный кардиосклероз.
ще блокады возникают при задних инфарктах миокарда. При этом развиваются как синусовые, так и атриовентрикулярные нарушения проводимости вследствие общности кровоснабжения этих областей из правой или левой огибающей коронарных артерий. Передние инфаркты миокарда осложняются более тяжелыми и стойкими блокадами. Нарушения проводимости могут быть одними из основных проявлений при ревматическом и дифтерийном миокардитах, дилатационной кардиомиопатии, третичном сифилисе, идиопатическом внутрисердечном кальцинозе. У людей пожилого, реже среднего возраста встречается идиопатическое изолированное склеродегенеративное поражение проводящей системы с блокадами множественных локализаций (болезни Lev M., Lenegre J.). Важное место среди причин блокад занимают также гипертоническая болезнь, приобретенные и врожденные пороки сердца и другие заболевания.
Нельзя забывать о ятрогенных нарушениях проводимости под влиянием лекарственных препаратов. Умеренная гиперкалиемия нарушает проводимость в области волокон Пуркинье, а повышение содержания калия до 8 ммоль/л может стать причиной остановки синусового узла.
Нарушения проводимости функционального происхождения развиваются при заболеваниях с повышением тонуса блуждающего нерва и у спортсменов. Ваготония может нарушать функцию синусового узла и замедлять атриовентрикулярное проведение.
Наибольшее клиническое значение имеют дисфункция синусового узла и атриовентрикулярные блокады.
ДИСФУНКЦИЯ СИНУСОВОГО УЗЛА. СИНДРОМ СЛАБОСТИ СИНУСОВОГО УЗЛА
Термином «дисфункция синусового узла» обозначают все нарушения работы синусового узла, которые проявляются брадиаритмиями.
В основе дисфункции синусового узла могут быть два механизма: снижение автоматизма пейсмекеров синусового узла и нарушение проведения импульсов из синусового узла на предсердия. К дисфункции синусового узла приводят структурные изменения в синоатриальной зоне, нарушения вегетативной регуляции сердца, состоящие в преобладании тонуса блуждающего нерва, а также токсические, в том числе лекарственные, воздействия, электролитные нарушения и физические факторы. Самыми частыми органическими причинами дисфункции синусового узла являются ИБС, гипертоническая болезнь и идиопатическое изолированное поражение проводящей системы. Синусовая брадикардия как следствие повышения парасимпатического тонуса наблюдается при многих заболеваниях: при гипотиреозе, остром гломерулонефрите, некоторых инфекциях, повышении внутричерепного давления, механической желтухе. Известно много примеров рефлекторных преходящих дисфункций синусового узла, возникающих при раздражении блуждающего нерва. Так, синусовая брадикардия часто наблюдается при диафрагмальной грыже, заболеваниях глотки, гортани, дивертикуле пищевода, при икоте, рвоте. Значительное урежение синусового ритма и даже короткие остановки синусового узла по механизму вазовагального рефлекса описаны во время пункции вены.
мороки, развивающиеся при этом, могут быть вызваны не только брадикардией, но и снижением артериального давления. Аналогичные проявления вазовагальных синкопальных состояний наблюдаются при кардиоингибиторном варианте синдрома гиперчувствительности каротидного синуса в условиях раздражения его барорецепторов при резком повороте головы или сдавлении шеи тугим воротником. Дисфункция синусового узла может возникнуть под влиянием β-адреноблокаторов, сердечных гликозидов, верапамила и других антиаритмических препаратов, а также при интоксикациях, например отравлении фосфорорганическими соединениями, при тяжелой дизэлектролитемии и в условиях гипотермии.
Синусовая брадикардия обычно наблюдается у здоровых, хорошо тренированных молодых людей, более выражена ночью и с возрастом встречается реже. Иногда у спортсменов, вырабатывающих выносливость к большим физическим нагрузкам, синусовая брадикардия достигает 40 в 1 мин. и менее. Особенностью этих лиц является способность значительно учащать ритм при нагрузке.
В 1966 г. В. Lown ввел понятие синдрома слабости синусового узла, к которому относят те случаи дисфункции синусового узла, которые возникают вследствие органических причин и не связаны с воздействием лекарств или усилением парасимпатических влияний. Отделение синдрома слабости синусового узла от регуляторных дисфункций важно, так как различаются их прогноз и методы лечения.
Клиническая картина. Выделяют следующие клинические формы синдрома слабости синусового узла [Кушаковский М. С., 1998]:
1. Постоянная синусовая брадикардия с частотой менее 45 – 50 в 1 мин.
2. Синоатриальная блокада.
3. Остановка синусового узла (синусовые паузы более 2 – 2,5 с).
4. Медленное восстановление функции синусового узла после кардиоверсии.
5. Синдром брадикардии-тахикардии.
Согласно Е. Вrounwald (1992), к синдрому слабости синусового узла относятся и случаи сочетания синусовых и атриовентрикулярных блокад.
Основные клинические проявления синдрома слабости синусового узла – эпизоды головокружений и синкопальные состояния, выраженность которых зависит от степени брадикардии и продолжительности пауз. Брадикардия может ухудшить течение ИБС или другого основного заболевания и привести к появлению или нарастанию признаков сердечной недостаточности. У некоторых больных развивается синдром брадикардиитахикардии (синдром Шорта), который представляет собой чередование брадикардии с приступами фибрилляции предсердий (в 70 – 80 % случаев) и реже – трепетания предсердий или наджелудочковой тахикардии. Приступ тахиаритмии еще более подавляет автоматизм синусового узла, и по окончании пароксизма нередко наблюдается длительная асистолия, которая может быть причиной потери сознания. Для некоторых больных эти обмороки становятся привычными и ожидаемыми после прекращения сердцебиения. Иногда у больных с синдромом слабости синусового узла устанавливается постоянная форма фибрилляции предсердий. В таких случаях о патологии синусового узла можно подумать на основании анамнестических данных и анализа ЭКГ, снятых до появления фибрилляции предсердий.
Диагностика дисфункции синусового узла и синдрома слабости синусового узла основана прежде всего на регистрации признаков заболевания на ЭКГ. Если проявления брадиаритмии непостоянны, то используется 24 – 48-часовое холтеровское мониторирование ЭКГ, которое позволяет также установить связь клинических симптомов с синусовыми паузами. При синдроме слабости синусового узла на ЭКГ может быть обнаружена постоянная синусовая брадикардия с частотой менее 50 в 1 мин. Зубцы Р обычной формы и предшествуют каждому желудочковому комплексу с постоянным Р – R интервалом, превышающим 0,12 с.
Синоатриальная блокада развивается вследствие замедления проведения импульсов от пейсмекеров синусового узла к предсердиям. Выделяют три степени синоатриальной блокады. При блокаде I степени все импульсы из синусового узла с замедлением проводятся на предсердия, что никак не проявляется на ЭКГ. При синоатриальной блокаде II степени часть импульсов блокируется и не проводится на предсердия. Существует два типа II степени синоатриальной блокады. При I т и п е (периоды Самойлова – Венкебаха) выпадению зубца Р предшествует постепенное укорочение интервалов Р – Р. Длительность паузы с выпадением зубца Р меньше удвоенного интервала Р – Р. Наиболее часто встречается II т и п блокады, для которого характерно выпадение одного или более зубцов Р, в результате чего появляются длинные паузы, равные двум и более интервалам Р – Р (рис. 1.22). Так же как и первую, III степень синоатриальной блокады нельзя распознать на ЭКГ: ни один импульс из синусового узла не проводится на предсердия, и может установиться любой несинусовый ритм (ритм атриовентрикулярного соединения, фибрилляция предсердий и др.).
Остановка синусового узла возникает из-за внезапного прекращения его спонтанного автоматизма. Это распознается на ЭКГ по паузе в синусовом ритме. В отличие от синоатриальной блокады пауза не будет кратна какому-либо числу нормальных интервалов Р – Р.
Достоверно диагностировать синоатриальную блокаду I и III степени, а также остановку синусового узла можно только с помощью эндокардиального ЭФИ и записи электрограммы синусового узла.
Во время длинных пауз в синусовом ритме создаются условия для появления выскальзывающих замещающих комплексов или ритмов, источники которых обычно находятся в предсердиях или атриовентрикулярном соединении, возможна миграция водителя ритма по предсердиям. Это вторичные нарушения ритма, часто сопровождающие синдром слабости синусового узла. С целью проведения дифференциального диагноза между синдромом слабости синусового узла и регуляторными дисфункциями синусового узла используются ЭКГ-проба с физической нагрузкой и фармакологические тесты. В пользу синдрома слабости синусового узла свидетельствует незначительное учащение ритма, не более чем до 70 в 1 мин. при физической нагрузке, а при внутривенном введении атропина (0,02 мг/кг) число сокращений сердца не превышает 90 в 1 мин.
Если у больного с синкопальными состояниями подозревается синдром гиперчувствительности каротидного синуса, то записывается ЭКГ во время массажа синокаротидной зоны. Диагноз подтверждается, если на ЭКГ при этом регистрируется синусовая пауза более 3 с.
Больным, у которых не удается доказать связь клинических симптомов с дисфункцией синусового узла по ЭКГ и холтеровскому мониторированию, показано проведение ЭФИ сердца. Обычно для оценки функции синусового узла используется частая чреспищеводная стимуляция предсердий, в процессе которой угнетается пейсмекерная активность синусового узла. Величина предавтоматической паузы после прекращения стимуляции предсердий характеризует автоматизм синусового узла. Этот показатель называется «время восстановления функции синусового узла» и в норме не превышает 1500 мс. При проведении ЭФИ оценивается также атриовентрикулярная проводимость, так как нарушения функции синусового узла и атриовентрикулярного соединения часто сочетаются. От результатов этого исследования зависит правильный выбор метода последующей электрокардиотерапии. Бессимптомные больные с синусовой брадикардией не должны подвергаться ЭФИ, так как никакая терапия им не показана.
АТРИОВЕНТРИКУЛЯРНАЯ БЛОКАДА
Атриовентрикулярная блокада – замедление или прекращение проведения импульса от предсердий к желудочкам. Атриовентрикулярная блокада может локализоваться на уровне атриовентрикулярного узла, пучка Гиса, его ножек и разветвлений. Блокады, локализующиеся на уровне атриовентрикулярного узла и пучка Гиса, называют проксимальными, а формирующиеся ниже, в области ножек пучка Гиса и их ветвей, — дистальными. Это деление важно для определения прогноза блокады.
По степени тяжести атриовентрикулярные блокады разделяются на три степени. В основу этой классификации положены ЭКГ признаки.
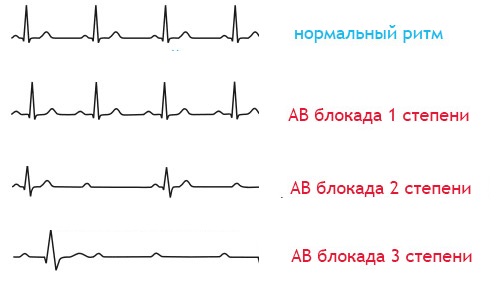
Атриовентрикулярная блокада I степени проявляется на ЭКГ только удлинением интервала P – R (P – Q) свыше 0,20 с. При этом все импульсы из предсердий проводятся на желудочки. В общей популяции населения атриовентрикулярная блокада I степени встречается у 0,45 – 2 % лиц, с возрастом ее частота увеличивается. Основной локализацией атриовентрикулярного блока I степени является атриовентрикулярный узел, значительно реже – ствол и ножки пучка Гиса. Атриовентрикулярная блокада I степени не оказывает влияния на гемодинамику, больными не ощущается и поэтому впервые диагностируется на ЭКГ (рис. 1.23, а).
Клиническое значение атриовентрикулярной блокады I степени зависит от причины. Функциональные атриовентрикулярные блокады I степени могут наблюдаться у практически здоровых людей с ваготонией и у спортсменов. У таких лиц атриовентрикулярная блокада исчезает при физической нагрузке и специального лечения не требует. Если атриовентрикулярная блокада I степени возникает на фоне применения лекарственных средств, то это обычно проходит после отмены препарата. Дистальная атриовентрикулярная блокада I степени при обширном переднем инфаркте миокарда, осложненном блокадами ножек пучка Гиса, может прогрессировать и имеет неблагоприятный прогноз.
Рис. 1.23. Атриовентрикулярная блокада:
а – атриовентрикулярная блокада I степени; б – атриовентрикулярная блокада II степени I тип Мобитца, проведение 3: 2; в – атриовентрикулярная блокада II степени, проведение 2: 1; г – атриовентрикулярная блокада II степени, проведение 3: 1; д – атриовентрикулярная блокада III степени (полная); е – синдром Фредерика: полная атриовентрикулярная блокада на фоне трепетания предсердий, число возбуждений предсердий 300 в 1 мин., число возбуждений желудочков 33 в 1 мин.
При атриовентрикулярной блокаде II степени часть импульсов из предсердий не проводится к желудочкам, в результате чего отдельные возбуждения желудочков отсутствуют («выпадают»). II степень атриовентрикулярной блокады разделяется на два типа.
Первый тип атриовентрикулярной блокады, Мобитца I тип, или периоды Самойлова – Венкебаха, характеризуется постепенным замедлением предсердно-желудочковой проводимости, что на ЭКГ проявляется прогрессирующим увеличением интервала P – R на протяжении нескольких последовательных сердечных циклов. При этом в типичных случаях степень прироста интервалов P – R уменьшается, и укорачиваются интервалы R – R. Такой период завершается перерывом атриовентрикулярного проведения, выпадением одного комплекса QRS. Во время паузы, длительность которой менее 2 интервалов R – R, восстанавливается атриовентрикулярная проводимость, и в первом после паузы комплексе интервал P – R приобретает исходную величину. Во втором после паузы комплексе наблюдается максимальный прирост интервала P – R и далее все повторяется. Периодом Самойлова – Венкебаха называется промежуток между двумя последовательными выпадениями желудочковых комплексов (рис. 1.23, б).
При атриовентрикулярной блокаде II степени Мобитца типа II выпадение желудочковых комплексов QRS наступает внезапно без предшествующего нарастания интервала P – R, который может быть постоянно увеличенным или нормальным.
На ЭКГ при атриовентрикулярной блокаде II степени предсердных зубцов всегда больше, чем желудочковых комплексов, и проведение можно обозначить как 3: 2, 4: 3 и т. д. (рис. 1.23, в). Проведение 2: 1 бывает как при I, так и при II типах Мобитца, поэтому оно выделяется в отдельную группу. Кроме того, если подряд не проводится несколько предсердных зубцов, и соотношение зубцов Р и желудочковых комплексов составляет 4: 1, 5: 1, такую блокаду называют далекозашедшей и также относят ко II степени (рис. 1.23, г). Два типа атриовентрикулярных блокад II степени существенно различаются по локализации, причине, течению и прогнозу. Так, атриовентрикулярная блокада Мобитца I типа в большинстве случаев является проксимальной с локализацией в атриовентрикулярном узле, чаще функциональной природы, может быть обратима и редко прогрессирует. Блокада II типа Мобитца относится к дистальной, обычно формируется на фоне органических изменений в миокарде и имеет тенденцию к прогрессированию в полную атриовентрикулярную блокаду.
При атриовентрикулярной блокаде III степени , или полной атриовентрикулярной блокаде, ни один импульс из предсердий не проводится к желудочкам (рис. 1.23, д). Водителем ритма для предсердий остается обычно синусовый узел. Однако в предсердиях может быть и несинусовый ритм, например, фибрилляция или трепетание предсердий. Сочетание фибрилляции предсердий и полной атриовентрикулярной блокады носит название синдрома Фредерика (рис. 1.23, е). Желудочки при полной атриовентрикулярной блокаде возбуждаются под влиянием импульсов из латентных центров автоматизма в атриовентрикулярном соединении или системе Гиса – Пуркинье. Ритм желудочков редкий и правильный и не зависит от появления зубцов Р, которые располагаются на разных расстояниях от желудочковых комплексов и могут наслаиваться на различные элементы комплекса QRST. В случае проксимальной блокады возбуждение желудочков может исходить из атриовентрикулярного соединения с частотой 40 – 60 в 1 мин., а желудочковый комплекс будет неуширен, суправентрикулярного типа. При дистальной полной атриовентрикулярной блокаде возбуждения желудочков регистрируются с частотой менее 40 в 1 мин., а комплекс QRS расширяется более 0,12 с и деформируется. Полная атриовентрикулярная блокада чаще развивается на фоне структурных изменений миокарда, но и она бывает обратимой, как это наблюдается при передозировке сердечных гликозидов или в остром периоде задненижнего инфаркта миокарда.
Клиническая картина. Клинические проявления при атриовентрикулярных блокадах зависят от выраженности брадикардии, характера основного заболевания и степени изменений миокарда. При редких паузах больные могут жаловаться только на ощущения «перебоев» или «замирания» сердца. Выраженная брадикардия приводит к снижению минутного объема кровообращения, развитию сердечной и коронарной недостаточности и нарушению кровоснабжения мозга. Больные жалуются на слабость, утомляемость, головокружение, появление или учащение приступов стенокардии. У больного с неполной атриовентрикулярной блокадой может быть аритмичный пульс. Для полной блокады характерен редкий и правильный пульс, не изменяющийся при дыхании и физической нагрузке. При аускультации сердца у больного с полной атриовентрикулярной блокадой отмечается изменчивость громкости первого тона, периодически возникает усиление первого тона, «пушечный» тон Стражеско, при одновременном сокращении предсердий и желудочков.
На фоне брадикардии увеличивается ударный объем сердца, что проявляется систолической артериальной гипертензией. При длительно существующей брадикардии появляются признаки застойной сердечной недостаточности. В условиях значительного урежения числа сокращений сердца до 20 в 1 мин. менее, а также при осложнении полной блокады фибрилляцией желудочков или асистолией, особенно при миграции водителя ритма по желудочкам, развивается клиника острой ишемии мозга с потерей сознания, или синдром Морганьи – Эдемса – Стокса. Приступ возникает внезапно без предвестников с побледнения кожных покровов, головокружения и через 10 – 20 с больной теряет сознание. Вскоре (через 20 – 45 с) развиваются генерализованные эпилептиформные судороги, непроизвольное мочеиспускание и дефекация. К концу первой минуты может остановиться дыхание и появиться диффузный цианоз. Пульс и артериальное давление не определяются. Над сердцем могут выслушиваться редкие тоны. Если сердечная деятельность восстанавливается спонтанно или под влиянием терапии, то больной быстро приходит в сознание. Приступ Морганьи – Эдемса – Стокса может окончиться летально.
Диагностика атриовентрикулярных блокад основывается прежде всего на данных ЭКГ. При интермиттирующем течении нарушений проводимости неоценимую помощь в диагностике оказывает 24 – 48-часовое мониторирование ЭКГ, во время которого не только можно зарегистрировать преходящую блокаду, но и установить связь ее с клинической симптоматикой. В некоторых случаях для выявления и уточнения уровня атриовентрикулярной блокады проводится чреспищеводное или эндокардиальное электрофизиологическое исследование.
Источник: fictionbook.ru
с синусом ритме. Опыт доказывает, что атриовентрикулярный узел также способен к автоматии, но это свойство у него выражено в 2 раза слабее, чем у синусного узла.
Степень автоматии это то количество импульсов возбуждения, которое может генерировать в минуту тот или иной элемент проводящей системы сердца. Синоатриальный узел у человека в покое генерирует 70-80 имп. в мин, атриовентрикулярный в два раза меньше 40, ножки Гиса 20 имп. в мин. Убывание степени автоматии элементов проводящей системы сердца по мере удаления их от синусного узла называется градиентом автоматии. В норме импульсная активность нижележащих водителей ритма подавляется синоатриальным узлом, и они выполняют только функцию проводников возбуждения.
|
Скорости проведения возбуждения |
|
|
по проводящей системе сердца |
|
|
От синоатриального узла по миокарду предсердий |
возбуждение |
распространяется со скоростью 1000мм в сек. В атриовентрикулярном узле скорость значительно снижается 50-200 мм в сек. Это называется атриовентрикулярной задержкой, она способствует последовательному сокращению предсердий и желудочков. По пучку и ножкам Гиса скорость самая высокая, до 4000 мм в сек., что позволяет практически одновременно охватить возбуждением всю массу правого и левого желудочков. А по рабочему миокарду желудочков, где уже нет элементов проводящей системы, и возбуждение передается с клетки на клетку через плотные контакты, скорость невысока и составляет всего 400 мм в сек.
Нарушение проведения импульсов по проводящей системе сердца.
Неполный атриовентрикулярный блок. При патологических изменениях в атриовентрикулярном узле (например, при воспалении) падает скорость проведения импульсов от предсердий к желудочкам. Это отражается постепенным увеличением времени между их сокращениями и удлинением интервала PQ на ЭКГ. Дальнейшее ухудшение проводимости приводит к тому, что одно из сокращений желудочков выпадает. Во время возникшей длинной паузы восстанавливается проводимость атриовентрикулярного узла, и следующий синусовый импульс проходит до желудочков и вызывает их сокращение. При дальнейшем развитии процесса выпадает каждое второе или третье сокращение желудочков, а на ЭКГ отсутствует каждый второй или третий комплекс QRST.
Полная атриовентрикулярная (поперечная) блокада характеризуется прекращением передачи возбуждения от предсердий к желудочкам. При этом предсердия сокращаются в обычном синусовом ритме (60-72 сокращения в минуту), а желудочки в более медленном ритме (30-40 сокращений в минуту), который задаётся здоровой частью атриовентрикулярного узла или пучком Гиса. В такой ситуации деятельность предсердий и желудочков оказывается несогласованной, что приводит к серьезным расстройствам
12
Источник: studfile.net
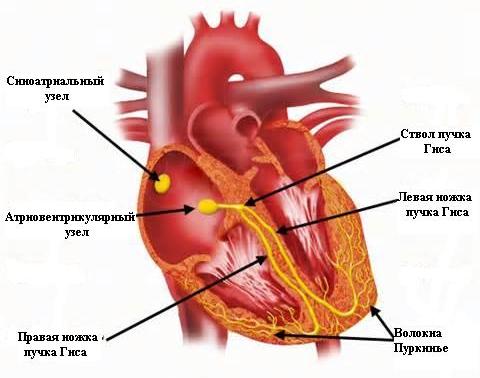
ПРОВОДНИКОВАЯ СИСТЕМА

1. Синусовый узел (синоатриальный, S—A-узел Keith и Flack)
2. Передний межузловой путь с двумя разветвлениями:
2а — пучок к левому предсердию (пучок Bachmann)
2б — нисходящий пучок к межпредсердной перегородке и атриовентрикулярному узлу
3. Средний межузловой путь
4. Задний межузловой путь
5. Атриовентрикулярный (А—V) узел Ашоффа—Тавара
6. Пучок Гиса
7. Правая ножка пучка Гиса
8. Левая ножка пучка Гиса
9. Задняя ветвь левой ножки
10. Передняя ветвь левой ножки
11. Сеть волокон Пуркинье в желудочковой мускулатуре
12. Сеть волокон Пуркинье в предсердной мускулатуре
СИНУСОВЫЙ УЗЕЛ
Синусовый узел представляет собой пучок специфической сердечно-мышечной ткани, длина которого достигает 10—20 мм и ширина — 3—5 мм. Он расположен субэпикардиально в стенке правого предсердия, непосредственно сбоку от устья верхней полой вены. Клетки синусового узла расположены в нежной сети, состоящей из коллагеновой и эластической соединительной ткани. Существует два вида клеток синусового узла — водителя гритма или пейсмекерные (Р-клетки) и проводниковые (Т-клетки). Р-клетки генерируют электрические импульсы возбуждения, а Т-клетки выполняют преимущественно функцию проводников. Клетки Р связываются как между собой, так и с клетками Т. Последние, в свою очередь, анастомозируют друг с другом и связываются с клетками Пуркинье, расположенными около синусового узла.
В самом синусовом узле и рядом с ним находится множество нервных волокон симпатического и блуждающего нервов, а в субэпикардиальной жировой клетчатке над синусовым узлом расположены ганглии блуждающего нерва. Волокна к ним исходят в основном из правого блуждающего нерва.
Питание синусового узла осуществляется синоатриальной артерией. Это сравнительно крупный сосуд, который проходит через центр синусового узла и от него отходят мелкие ветви к ткани узла. В 60% случаев синоатриальная артерия отходит от правой венечной артерии, а в 40% — от левой.
Синусовый узел является нормальным электрическим водителем сердечного ритма. Через равные промежутки времени в нем возникают электрические потенциалы, возбуждающие миокард и вызывающие сокращение всего сердца. Клетки Р синусового узла генерируют электрические импульсы, которые проводятся клетками Т в близкорасположенные клетки Пуркинье. Последние, в свою очередь, активируют рабочий миокард правого предсердия. Кроме того, по специфическим путям электрический импульс проводится в левое предсердие и атриовентрикулярный узел.
МЕЖУЗЛОВЫЕ ПУТИ
 Электрофизиологическими и анатомическими исследованиями в последнее десятилетие было доказано наличие трех специализированных проводниковых путей в предсердиях, связывающих синусовый с атриовентрикулярным узлом: передний, средний и задний межузловые пути (James, Takayasu, Merideth и Titus). Эти пути образованы клетками Пуркинье и клетками, очень похожими на клетки сократительного предсердного миокарда, нервными клетками и ганглиями блуждающего нерва (James).
Электрофизиологическими и анатомическими исследованиями в последнее десятилетие было доказано наличие трех специализированных проводниковых путей в предсердиях, связывающих синусовый с атриовентрикулярным узлом: передний, средний и задний межузловые пути (James, Takayasu, Merideth и Titus). Эти пути образованы клетками Пуркинье и клетками, очень похожими на клетки сократительного предсердного миокарда, нервными клетками и ганглиями блуждающего нерва (James).
Передний межузловой путь делится на две ветви — первая из них идет к левому предсердию и называется пучком Бахманна, а вторая спускается вниз и кпереди по межпредсердной перегородке и достигает верхней части атриовентрикулярного узла.
Средний межузловой путь, известный под названием пучок Венкебаха, начинается от синусового узла, проходит позади верхней полой вены, спускается вниз по задней части межпредсердной перегородки и, анастомозируя с волокнами переднего межузлового пути, достигает атриовентрикулярного узла.
Задний межузловой путь, названный пучком Тореля, отходит от синусового узла, идет вниз и кзади, проходит непосредственно над коронарным синусом и достигает задней части атриовентрикулярного узла. Пучок Тореля самый длинный из всех трех межузловых путей.
Все три межузловые пути анастомозируют между собой недалеко от верхней части атриовентрикулярного узла и связываются с ним. В некоторых случаях от анастомоза межузловых путей отходят волокна, которые обходят атриовентрикулярный узел и сразу достигают его нижней части, или же доходят до того места, где он переходит в начальную часть пучка Гиса.
АТРИОВЕНТРИКУЛЯРНЫЙ УЗЕЛ
Атриовентрикулярный узел находится справа от межпредсердной перегородки над местом прикрепления створки трехстворчатого клапана, непосредственно рядом с устьем коронарного синуса. Форма и размеры его разные: в среднем длина его достигает 5-6 мм, а ширина — 2-3 мм.
Подобно синусовому узлу, атриовентрикулярный узел содержит также два вида клеток — Р и Т. Однако имеются значительные анатомические различия между синоаурикулярным и атриовентрикулярным узлами. В атриовентрикулярном узле гораздо меньше Р-клеток и незначительное количество сети коллагеновой соединительной ткани. У него нет постоянной, центрально проходящей артерии. В жировой клетчатке за атриовентрикулярным узлом, вблизи устья коронарного синуса, находится большое число волокон и ганглиев блуждающего нерва. Кровоснабжение атриовентрикулярного узла происходит посредством ramus septi fibrosi, называемой еще артерией атриовентрикулярного узла. В 90% случаев она отходит от правой венечной артерии, а в 10% — от ramus circumflexus левой венечной артерии.
Клетки атриовентрикулярного узла связываются анастомозами и образуют сетчатую структуру. В нижней части узла, перед переходом в пучок Гиса, клетки его располагаются параллельно друг другу.
ПУЧОК ГИСА
Пучок Гиса, названный еще и атриовентрикулярным пучком, начинается непосредственно в нижней части атриовентрикулярного узла, и между ними нет ясной грани. Пучок Гиса проходит по правой части соединительнотканного кольца между предсердиями и желудочками, названного центральным фиброзным телом. Эта часть известна под названием начальной проксимальной или пенетрирующей части пучка Гиса. Затем пучок Гиса переходит в задне-нижний край мембранозной части межжелудочковой перегородки и доходит до ее мышечной части. Это так называемая мембранозная часть пучка Гиса. Пучок Гиса состоит из клеток Пуркинье, расположенных в виде параллельных рядов с незначительными анастомозами между ними, покрытых мембраной из коллагеновой ткани. Пучок Гиса расположен совсем рядом с задней некоронарной створкой аортального клапана. Длина его около 20 см. Питание пучка Гиса осуществляется артерией атриовентрикулярного узла.
Иногда от дистальной части пучка Гиса и начальной части левой ножки его отходят короткие волокна, идущие в мышечную часть межжелудочковой перегородки. Эти волокна называются параспецифическими фибрами Махайма.
До пучка Гиса доходят нервные волокна блуждающего нерва, но в нем нет ганглиев этого нерва.
ПРАВАЯ И ЛЕВАЯ НОЖКИ ПУЧКА ГИСА
Пучок Гиса в нижней части, названной бифуркацией, разделяется на две ножки — правую и левую, которые идут субэндокардиально или интракардиально по соответствующей стороне межжелудочковой перегородки. Правая ножка представляет собой длинный, тонкий, хорошо обособленный пучок, состоящий из множества волокон, имеющих незначительные проксимальные разветвления или без таковых. В дистальной части правая ножка пучка Гиса выходит из межжелудочковой перегородки и достигает передней сосочковой мышцы правого желудочка, где разветвляется и связывается анастомозами с волокнами сети Пуркинье.
Несмотря на усиленные морфологические изучения, проводимые в последние годы, структура левой ножки пучка Гиса остается невыясненной. Существуют две основные схемы строения левой ножки пучка Гиса. Согласно первой схеме (Rosenbaum и сотр.), левая ножка еще с самого начала делится на две ветви — переднюю и заднюю. Передняя ветвь — относительно более длинная и тонкая — достигает основания передней сосочковой мышцы и разветвляется в передне-верхней части левого желудочка. Задняя ветвь — относительно короткая и толстая — достигает основания задней сосочковой мышцы левого желудочка. Таким образом внутрижелудочковая проводниковая система представлена тремя проводящими путями, названными Rosenbaum и сотр. фасцикулами, — правой ножкой, передней ветвью и задней ветвью левой ножки пучка Гиса. Множество электрофизиологических исследований поддерживают мнение о трехпучковой (трифасцикулярной) внутрижелудочковой проводниковой системе.
По второй схеме (James и сотр.) считается, что в отличие от правой ножки, левая не представляет собой обособленного пучка. Левая ножка еще в самом начале, отходя от пучка Гиса, разделяется на множество варьирующих по числу и толщине волокон, которые веерообразно разветвляются субэндокардиально по левой стороне межжелудочковой перегородки. Два из множества разветвлений образуют более обособленные пучки — один, расположенный спереди, — в направлении передней, а другой сзади — в направлении задней сосочковой мышцы.
Как левая, так и правая ножка пучка Гиса, подобно межузловым путям предсердий, составлены из двух видов клеток — клеток Пуркинье и клеток, очень похожих на клетки сократительного миокарда.
Большая часть правой и передние две трети левой ножки кровоснабжаются септальными веточками левой передней нисходящей артерии. Задняя треть левой ножки питается септальными веточками задней нисходящей артерии. Существует множество транссептальных анастомозов между септальными веточками передней нисходящей венечной артерии и веточками задней нисходящей венечной артерии (James).
Волокна блуждающего нерва доходят до обеих ножек пучка Гиса, однако в проводниковых путях желудочков нет ганглиев этого нерва.
ВОЛОКНА СЕТИ ПУРКИНЬЕ
Конечные разветвления правой и левой ножек пучка Гиса связываются анастомозами с обширной сетью клеток Пуркинье, расположенных субэндокардиально в обоих желудочках. Клетки Пуркинье представляют собой видоизмененные клетки миокарда, которые непосредственно связываются с сократительным миокардом желудочков. Электрический импульс, поступающий по внутрижелудочковым проводящим путям, достигает клеток сети Пуркинье и отсюда переходит непосредственно к сократительным клеткам желудочков, вызывая сокращение миокарда.
Нервные волокна блуждающего нерва не доходят до сети волокон Пуркинье в желудочках.
Клетки сети волокон Пуркинье питаются кровью из капиллярной сети артерий соответствующего района миокарда.
Источник: e-cardio.ru
Описание атриовентрикулярного узла
Определение “атриовентрикулярный узел” походит от латинского: atrium — вход, ventriculus — маленький живот.
Синонимы: узел AV (АВ-узел), узел Ашоффа-Тавара, атриовентрикулярный узел.
В 1906 году Сунао Тавара (1873-1952), молодой японский анатом, работающий под руководством Людвига Ашоффа в Марбурге, Германия, опубликовал “Систему переноса импульсов в сердце млекопитающих», в которой описывается его трехлетний гистологический поиск. Тавара обнаружил “сложный узловой” (атриовентрикулярный (AV) узел) участок на проксимальном конце расхождения проводящих волокон. Он пришел к выводу, что это было началом электропроводящей системы, которая распространялась от АВ-узла через пучок Гиса, разделенного на правую и левую ветви и заканчивающегося волокнами Пуркинье. Тавара был первым, кто понял, что волокна Пуркинье содержат ткань, которая быстро доставляет импульсы к вершине желудочка, так что их сжатие распространяется от вершины сердца к его основанию.
Атриовентрикулярный узел, или AV-узел, является вторичным центром проводящей системы сердца (узел второго порядка), участвующим в комплексной регуляции частоты сердечных сокращений.
- Анатомия
AV-узел представляет собой мышечную структуру в треугольнике Коха, расположенную в области правого предсердия около предсердной перегородки. На макроскопическом уровне трудно выделяется. Расположен на стыке с желудочками и регулирует передачу импульсов через непроводящий кардиальный скелет в нижние камеры сердца. Узел расположен на вершине пучка Гиса. Вероятно, контролируется симпатическими и парасимпатическими системами, которые участвуют в комплексной регуляции сердечного ритма. Обычно он снабжается кровью из атриовентрикулярной узловой ветви, отходящей от правой коронарной артерии.
Таким образом, атриовентрикулярный узел является единственной электрической связью между предсердиями и ниже расположенными сердечными камерами.
- Гистология
Атриовентрикулярный узел состоит из специфических сердечных клеток (кардиомиоцитов), которые частично связаны с соединительной тканью кардиального скелета. В отличие от рабочих мышц сердца, узловые клетки отчасти лишены миофибрилл и митохондрий.
- Физиология
AV-узел является вторичным центром стимуляции сердца. Обычно он получает деполяризацию, распространяемую через рабочие мышцы предсердий, и перенаправляет их в желудочки после секундной задержки. Период времени для этого перехода называется временем атриовентрикулярной проводимости (AV-время), соответствующее на ЭКГ интервалу PQ. Задержка возбуждения в AV-узле необходима для обеспечения скоординированного и упорядоченного сокращения предсердий и желудочков. Систола предсердий осуществляется немного раньше, чем желудочковая систола, что необходимо для полноценного наполнения нижних отделов сердца.
Дополнительно AV-узел действует как частотный фильтр. В физиологических условиях он не проводит сигналов больше определенной частоты из-за рефрактерного периода деполяризованных клеток сердечной мышцы. В результате даже при трепетании предсердий, когда ЧСС атриумов увеличивается до 300 уд/мин и выше, к желудочкам доходит намного меньше сигналов, поэтому они сокращаются в допустимых пределах.
- Патофизиология
В случае сбоя работы синусового узла, AV-узел может принимать функцию первичного генератора ритма и контролировать частоту сердечных сокращений от 40 до 60 / мин.
Чрезмерное временное отставание импульсной проводимости через AV-узел или отказ проводимости могут привести к AV-блокаде, которая делится на три стадии клинической выраженности. Иногда определяется ускоренная передача электрических импульсов, тогда отмечается тахикардия и учащенный пульс, в основном присутствующие в контексте синдрома Вольфа-Паркинсона-Уайта.
Заболевания, связанные с атриовентрикулярным узлом
Блокада атриовентрикулярного узла
Наиболее распространенным атриовентрикулярным расстройством является AV-блокада. Это сердечная аритмия, развивающаяся из-за запаздывающей или прерванной передачи сигналов через атриовентрикулярный узел. Часто блокада остается незамеченной и в таких случаях обычно определяют соответствие блокаде первой степени. Однако тяжелая AV-блокада заставляет сердце биться очень медленно. Это явление вызывает так называемую брадикардию, которая иногда переходит во временную остановку сердца со всеми вытекающими последствиями. Для лечения таких состояний обычно используется кардиостимулятор, который стабилизирует нарушенную передачу импульсов. При таком серьезном нарушении работы АВ-узла говорят о AV-блокаде третьей степени.
Блокада AV-узла может быть диагностирована с помощью ЭКГ, где она выражается в удлиненном интервале PQ, в зависимости от степени тяжести. Врожденные АВ-блокады встречаются чрезвычайно редко, но могут определяться как часть другой врожденной болезни сердца. Большинство AV-блокад являются приобретенными. Они обычно возникают в результате дегенеративных изменений сердца. Например, воспаление или инфекция сердечной мышцы могут способствовать образованию блокады. Больные с этим заболеванием сначала лечатся медикаментозно для устранения аритмии. При ухудшении состояния больным с блокадой AV-узла 2 и 3 степени обычно имплантируется кардиостимулятор, поскольку медикаментозная терапия считается ненадежной при выраженных симптомах.
Видео: АВ блокады и ее степени на ЭКГ (атривентрикулярные блокады)
Ускоренная проводимость между предсердиями и желудочками
Противоположностью AV-блокаде является ускоренная проводимость между предсердиями и желудочками. Это явление нередко определяется на фоне синдрома Вольфа-Паркинсона-Уайта. При этой сердечной аритмии обычно определяется один или несколько дополнительных путей проведения, сообщающих желудочки и предсердия в обход АВ-узла. Ускоренная передача обычно проявляется значительным увеличением пульса, также при ней может определяться тахикардия, то есть учащенное биение сердца.
В большинстве случаев тахикардия может регулироваться самим пациентом. Например, сердцебиение и ритм сердца немного останавливаются при задержке воздуха на выдохе. Кроме того, врач обычно назначает пациентам с тахикардией соответствующие препараты по типу аджмалина. В отличие от замедленной передачи возбуждения синусового узла, хирургическая имплантация кардиостимулятора при ускоренной проводимости и тахикардии в большинстве случаев не проводится.
Атриовентрикулярная узловая ре-ентри тахикардия
Может возникать внезапно и сопровождаться увеличением нормальных сердечных сокращений между патологическими. Симптомы могут длиться от нескольких минут до нескольких дней, а некоторые больные вообще не отмечают никаких признаков.
Ре-ентри тахикардия становится проблемой, когда она возникает часто и длительно продолжается, особенно на фоне других повреждений сердца.
Основными признаками болезни является:
- Трепетание в груди
- Частое сердцебиение
- Сбивчивое дыхание
- Головокружения
- Потение
- Тяжесть в шее
- Обморок или предобморочное состояние
Самые распространенные типы ре-ентри тахикардии:
- Атриовентрикулярная узловая ре-ентри тахикардия (AVNRT). Встречается у мужчин и женщин любого возраста, хотя чаще наблюдается у молодых женщин.
- Атриовентрикулярная возвратно-поступательная тахикардия (AVRT). Является вторым по встречаемости типом ре-ентри тахикардии. Чаще всего диагностируется у молодых людей.
В лечении клинически выраженной патологии в начале используют консервативное лечение. При этом очень важно принимать любые антиаритмические препараты точно так, как это предписано доктором, чтобы свести к минимуму осложнения. Если лекарства не помогают, используют катетерную абляцию. В ходе этой процедуры врач направляет один или несколько катетеров через кровеносные сосуды к сердцу. Электроды на кончиках катетера могут воздействовать на ткани теплом, экстремально низкими температурами или радиочастотной энергией. Это позволяет повредить небольшой участок миокарда и создать электрический блок вдоль пути, который являлся причиной аритмии.
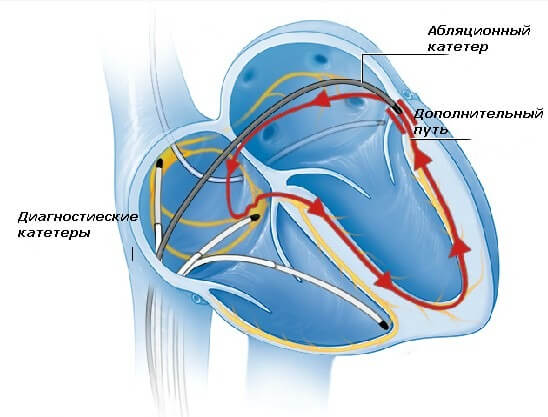
Иногда лечение ре-ентри тахикардии основывается на использовании небольшого имплантируемого прибора, называемого кардиостимулятором, который генерирует электрические импульсы, стимулирующие сердце биться в нормальном ритме. Кардиостимулятор располагается под кожей в районе ключицы во время незначительного хирургического вмешательства. Изолированный провод направляется от устройства к сердцу, где он закрепляется на постоянное время.
Кистозная опухоль атриовентрикулярного узла
Первичные кардиальные опухоли являются редкими заболевания, определяемыми с частотой от 0,0017% до 0,03% от общего количества.
Кистозная опухоль атриовентрикулярного (AV) узла, также известна как мезотелиома AV-узла, является доброкачественной врожденной опухолью, которая расположена в треугольнике Коха в AV-узловой области межпредсердной перегородки сердца.
AV-узловая область образуется во время эмбрионального слияния, при нарушении которого ткани преобразоваться в подобную опухоль. Исследования показали, что у 10% людей с кистозной опухолью AV-узла также имеются дефекты развития средней линии вдоль центральной оси вертикального тела (1,9), что указывает на генетический дефект, связанный с миграцией эмбриологических тканей и с неблагоприятной наследственностью. Было высказано предположение, что, в отличие от настоящего новообразования, это, скорее всего, результат дилатации кистозных пространств, а не клеточной репликации. В дополнение отсутствуют митозы этой опухоли
Поскольку имплантация кардиостимулятора не предотвращает внезапную смерть у больных с этой опухолью, чаще всего проводится хирургическое вмешательство. Существуют различные способы иссечения области поражения, однако из-за редкости кистозной опухоли AV-узла в сочетании со сложностью диагностики поражения методы хирургической резекции и терапевтические концепции до конца не стандартизированы. Например, остается спорным вопрос, должно ли поражение полностью или частично удаляться от основания межпредсердной перегородки.
Прогноз при кистозной опухоли AV-узла благоприятен при ранней диагностики с последующим оперативным и полным хирургическим удалением патологического образования. Случаи внезапной сердечной смерти показали, что эта опухоль связана с фатальной сердечной дисритмией и частичной / полной блокадой сердца. Таким образом, несмотря на то, что опухоль доброкачественна, большинству больным ставиться окончательный диагноз после вскрытия. Дополнительно стоит указать, что размер опухоли, по-видимому, не связан с симптомами летальной аритмией или внезапной смертью.
Диагностика патологий атриовентрикулярного узла
Чтобы диагностировать патологию АВ-узла, врач учитывает симптомы, историю болезни и проводит физическое обследование. Также он может спросить о наличии факторов риска, которые нередко провоцируют развитие болезни. Это может быть другая патология сердца или проблема со щитовидной железой. При необходимости выполняются тесты, направленные на исследование сердца. Чаще всего используется:
- Электрокардиограмма (ЭКГ). Во время ЭКГ датчики (электроды), которые будут определять электрическую активность сердца, прикрепляются к груди и иногда к конечностям. ЭКГ измеряет время и продолжительность каждой электрической фазы сердцебиения.
- Холтеровский мониторинг. Это портативное устройство ЭКГ, которое можно носить в течение дня или более для записи активности сердца во время обыденных дел человека.
- Мониторинг событий. Для спорадических эпизодов заболевания нужно держать портативное устройство ЭКГ в пределах доступности, чтобы в случае появления приступа прикрепить его к своему телу и нажать на кнопку записывающего устройства. Это позволит врачу проверить сердечный ритм во время эпизода нарушения ритма.
- ЭхоКГ. В ходе использования этого неинвазивного исследования ручное устройство (преобразователь) размещается на груди. Посредством использования звуковых волн, создаются изображения, по которым изучаются размеры, структура и движения сердца.
- Имплантируемый рекордер. Прибор обнаруживает неправильные ритмы сердца, для чего его имплантируют под кожу в области грудной клетки.
Если врач не определит признаки аритмии во время этих исследований, могут быть задействованы другие методы диагностики:
- Стресс тест. У некоторых людей аномальный ритм вызывается или прогрессирует под действием стресса или физических нагрузок. Во время стресс-теста предлагается делать упражнение на беговой дорожке или на стационарном велосипеде, пока сердечная деятельность будет находиться в норме. Если врачи во время оценки определили вероятность развития аритмии из-за болезни коронарной артерии, но при этом больной испытывает трудности с тренировкой, тогда может быть использовано лекарство, стимулирующее сердечную деятельность таким образом, что это похоже на физические упражнения.
- Тест на наклонном столе. Врач может порекомендовать этот тест, если у больного были обморочные состояния. Сердечный ритм и артериальное давление измеряются, когда человек лежит на столе. Затем стол наклоняется, как будто он встает. Врач наблюдает, как сердце и нервная система реагируют на изменение расположения тела.
- Электрофизиологическое тестирование и картирование. При этом исследовании врач проводит тонкие трубки (катетеры) через кровеносные сосуды в различные места сердца. Находясь в сердечных камерах электроды могут отображать распространение электрических импульсов по проводящей системе сердца.
При необходимости кардиолог может использовать электроды, чтобы стимулировать сердце биться в таком темпе, чтобы вызвать или остановить аритмию. Это позволяет определить локализацию аритмической активности и то, что ее вызывает.
Видео: Проводящая система сердца (ПСС)
Источник: arrhythmia.center

