Одним из важнейших свойств крови является её способность сохраняться в жидком состоянии внутри неповреждённых сосудов и свёртываться при их ранении и возникновении кровотечения. Кровь, которая вытекает из небольшой раны, достаточно быстро свёртывается, образовывая плотный кровяной сгусток — тромб (с гр. пробка, сгусток).
Свёртывание крови — это защитная реакция организма, направленная на остановку кровотечения и предотвращение попадания в организм болезнетворных микроорганизмов через открытую рану и сосуды.
Процесс свёртывания крови сложный и имеет много стадий. В нём принимают участие по меньшей мере 13 факторов плазмы и форменных элементов крови.
Схема образования тромба такая:
- В процессе травмы разрушаются кровяные пластинки — тромбоциты — мельчайшие форменные элементы крови диаметром 1,5-2 мкм. В одном литре крови здорового человека их содержится 200-400 • 109, всего их в организме 1,5 трлн.
- Сталкиваясь с шершавыми краями раны повреждённого кровеносного сосуда или с инородной поверхностью, тромбоциты разрушаются, из них высвобождается фермент тромбопластин.
- В плазме крови есть неактивный фермент — протромбин, который образуется в печени. Под действием тромбопластина в присутствии ионов кальция, что постоянно присутствуют в плазме крови, он переходит в активную форму — тромбин. Обычно в крови здорового человека его не бывает, поэтому кровь в неповреждённых сосудах не свёртывается. Материал с сайта http://worldofschool.ru
- Тромбин действует на растворимый белок плазмы фибриноген (с латин. тот, что создаёт волокна), который также продуцирует печень. Он превращается в нерастворимый волокнистый белок фибрин (с латин. волокнистый). В нитях фибрина, которые постепенно сокращаются, как в рыбачьей сети, запутываются форменные элементы крови. Образуется тромб — плотная «пробка», которая закупоривает «дыру» в сосуде. В норме кровь свертывается за 3-4 мин.
Источник: WorldOfSchool.ru
- Наследственные тромбофилитические синдромы: этиология, патогенез, клинические проявления.
Врожденные (наследственные, первичные). Это тромбофилии, которые обусловлены наличием аномалий в генах, содержащих информацию о белках, участвующих в свертывании крови. Чаще всего встречается дефицит антитротромбина III, протеинов C и S, аномалия фактора V (мутация Лейден), аномалия протромбина G 202110А.
1. Дефицит антитромбина. Существуют различные типы дефицита антитромбина: наследственный и приобретенный. Наследственная форма встречается редко. При этой патологии сгусток крови может формироваться в венах ног и легких, а также в венах рук, кишечника, мозг или печени. У 50% людей с дефицитом антитромбина тромб формируется в возрасте до 30 лет.
Приобретенный дефицит антитромбина III возникает при нарушении синтеза этого фактора или при избыточном его разрушении. Например, при заболеваниях печени, дефиците витамина К, при нефротическом синдроме происходит потеря антитромбина с мочой.
2. Аномалия фактора V (мутация Лейдена). При этом заболевании появляется дефект в гене, несущем информацию о пятом факторе свертывания крови. В результате фактор V становится устойчивым к разрушающему действию протеина C. При этом повышается риск развития тромбов в венах примерно в восемь раз.
3. Аномалия протромбина. При этом заболевании увеличивается синтез протромбина – предшественника тромбина.
результате активность свертывающей системы крови увеличивается. При подобном нарушении синтеза протромбина часто встречаются не только венозные тромбозы, но и тромбы в артериях сердца и головного мозга, что может привести к инфарктам и инсультам у людей моложе 50 лет.
4. Дисфибриногенемия. Это редкий генетический дефект, при котором нарушается нормальная функция фибрина. При этом может быть увеличено свертывание крови и/или повышенная кровоточивость.
Этиология:
• генетический дефект проакцелерина (фактора V);
• наследственная гипергомоцистеинемия, приводящая к повреждению сосудистой стенки, усилению агрегации тромбоцитов, активации образования тканевого тромбопластина, следствием чего являются артериальный и венозный тромбоз;
• генетические аномалии синтеза антитромбина III, антикоагулянтных протеинов C и S, которые служат причиной венозного тромбоза;
• наследственные гиперлипопротеидемии, особенно типа I (гиперхиломикронемия) и типа V, которые обусловливают развитие атеросклероза и повышенную склонность к тромбообразованию.
Патогенез. Основными механизмами, которые могут обусловить развитие тромбофилического синдрома, являются:
• снижение антитромботических свойств сосудистой стенки;
• увеличение содержания тромбоцитов в крови (тромбоцитоз);
• повышение функциональной активности свертывающей системы крови за с.
нфаркта) и функциональной недостаточности этих органов;
• уменьшение времени кровотечения;
• нарушение показателей коагулограммы — увеличение содержания прокоагулянтов и уменьшение компонентов системы антигемостаза.
- Приобретенные тромбофилитические синдромы: этиология, патогенез, клинические проявления.
Тромбофилитический синдром (гематогенная тромбофилия)— повышенная склонность к тромбообразованию, обусловленная нарушением систем гемостаза и антигемостаза.
Этиологические факторы :
• гипергомоцистеинемия, вызванная недостаточностью витаминов B6, B9 и B12;
• атеросклероз;
• сахарный диабет;
• сепсис (нарушение тромборезистентности сосудистой стенки и активация гемостаза под действием бактериальных токсинов);
• послеоперационный тромбоз как следствие травмы, стресса и гиподинамии, которые способствуют активации свертывания крови;
• нефротический синдром (потеря антитромбина III при значительн.
отеиназы — активаторы фактора X (аденокарцинома молочной железы, легких и др.).
Патогенез:
• снижение антитромботических свойств сосудистой стенки;
• увеличение содержания тромбоцитов в крови (тромбоцитоз);
• повышение функциональной активности свертывающей системы крови за счет усиленного поступления в кровь прокоагулянтов и активаторов свертывания крови;
• снижение антикоагуляционной активности крови и активности фибринолитической системы.
Клинические проявления:
• флеботромбоз, тромбофлебит, варикозное расширение вен с дальнейшим развитием отеков и трофических нарушений в тканях и органах;
• тромбоз и тромбоэмболия артериальных и венозных сосудов различных органов (легких, сердца, головного мозга, кишечника и др.) с развитием некроза (инфаркта) и функциональной недостаточности этих органов;
• уменьшение времени кровотечения;
• нарушение показателей коагулограммы — увеличение содержания прокоагулянтов и уменьшение компонентов системы антигемостаза.
- Система фибринолиза: состав, механизм действия.
Система фибринолиза – ферментативная система, расщепляющая нити фибрина, которые образовались в процессе свертывания крови, на растворимые комплексы. Фибринолиз регулирует проницаемость сосудов, восстанавливает их проходимость и обеспечивает жидкое состояние крови в сосудистом русле.
Компоненты:
1) Фибринолизин (плазмин). Неактивен – плазминоген (расщепляет фибрин, фибриноген, некоторые плазменные факторы свертывания крови);
2) Активаторы плазминогена (профибринолизина). Активаторы: прямого действия переводят плазминоген в плазмин (трипсин, урокиназа, кислая и щелочная фосфатаза); непрямого действия в плазме крови в виде проактиватора ( для активации лизокиназа);
3) Ингибиторы фибринолиза (антиплазмины) – альбумины (тормозят действие фермента фибринолизина и превращение профибринолизина в фибринолизин).
Фазы:
I фаза – лизокиназы в крови => плазминогена в активное состояние (отщепления от проактиватора АК).
II фаза –плазминоген в плазмин (отщепления липидного ингибитора под действием активатора).
III фаза – плазмин влияет на фибрин => расщепление до полипептидов и АК. Эти ферменты обладают выраженным антикоагулянтным действием, ингибируют тромбин и тормозят процесс образования протромбиназы, подавляют процесс полимеризации фибрина, адгезию и агрегацию тромбоцитов, усиливают действие брадикинина, гистамина, ангеотензина на сосудистую стенку, что способствует выбросу из эндотелия сосудов активаторов фибринолиза.
Виды:
Ферментативный фибринолиз — при участии плазмина.
Неферментативный фибринолиз — осуществляется комплексными соединениями гепарина с тромбогенными белками, биогенными аминами, гормонами, совершаются конформационные изменения в молекуле фибрина-S.
Механизмы:
По внешнему пути активация фибринолиза идет за счет лизокиназ тканей, тканевых активаторов плазминогена.
Во внутреннем пути активации принимают участие проактиваторы и активаторы фибринолиза, способные превращать проактиваторы в активаторы плазминогена или же действовать непосредственно на профермент и переводить его в плазмин.
Значительную роль в процессе растворения фибринового сгустка играют лейкоциты в силу своей фагоцитарной активности. Лейкоциты захватывают фибрин, лизируют его и выделяют в окружающую среду продукты его деградации.
Процесс фибринолиза рассматривается в тесной связи с процессом свертывания крови. Их взаимосвязи осуществляются на уровне общих путей активаций в реакции ферментного каскада, а также за счет нервно-гуморальных механизмов регуляции.
6.Синдром диссеминированного внутрисосудистого свертывания (ДВС): этиология, патогенез, проявления, лабораторная диагностика в различные стадии синдрома.
ДВС-синдром (диссеминированное внутрисосудистое свёртывание, коагулопатия потребления, тромбогеморрагический синдром) — нарушенная свёртываемость крови по причине массивного освобождения из тканей тромбопластических веществ.
Классификация:
- По клиническому течению:
- острый (мгновенные формы характеризуются тяжелым течением);
- хронический;
- По распространенности:
- Локализированный;
- Генерализированный;
Инициатором процесса свертывания крови при ДВС-синдроме является тканевой тромбопластин. Он поступает в кровоток из поврежденных тканей (травмы, операции, некрозы, деструкции), а при участии активированных тромбоцитов из эндотелия сосудистой стенки и моноцитов. Начавшееся свертывание крови быстро истощает внутренние резервы противосвёртывающей системы, в частности антитромбина III (AT III) и системы протеина С, которые расходуются на нейтрализацию активированных факторов свертывания и образующегося тромбина.
Этиология:
Источник: topuch.ru
Стаз
НАРУШЕНИЯ ТЕЧЕНИЯ И СОСТОЯНИЯ КРОВИ
• Стаз (от лат. stasis — остановка) — резкое замедление и остановка тока крови в сосудах микроциркуляторного русла, главным образом в капиллярах.
Причиной развития стаза являются нарушения циркуляции крови, возникающие при действии физических (высокая и низкая температура) и химических (токсины) факторов, при инфекционных, инфекционно-аллергических и аутоиммунных заболеваниях, болезнях сердца и сосудов.
Механизм развития.В возникновении стаза большое значение имеют изменения реологических свойств крови, обусловленные развитием сладж-феномена (от англ. sludge — тина), для которого характерно прилипание друг к другу эритроцитов, лейкоцитов или тромбоцитов и нарастание вязкости плазмы, что приводит к затруднению перфузии крови через сосуды микроциркуляторного русла. Развитию внутрикапиллярной агрегации эритроцитов способствуют следующие факторы:
▲ изменения капилляров, ведущие к повышению их проницаемости и плазморрагии;
▲ нарушение физико-химических свойств эритроцитов;
▲ изменение вязкости крови за счет грубодисперсных фракций
белков;
▲ нарушения циркуляции крови — венозное полнокровие (застойный стаз);
▲ ишемия (ишемический стаз) и др.
Стаз — явление обратимое. Длительный стаз ведет к необратимым гипоксическим изменениям — некробиозу и некрозу.
• Тромбоз (от греч. thrombosis — свертывание) — прижизненное свертывание крови в просвете сосуда или полостях сердца. Образующийся при этом сверток крови называют тромбом.
Хотя тромбоз представляет собой один из важнейших механизмов гемостаза, он может стать причиной нарушения кровоснабжения органов и тканей с развитием инфарктов, гангрены.
Патогенез.Патогенез тромбоза складывается из участия как местных, так и общих факторов.
К местным факторам относят изменения сосудистой стенки, замедление и нарушение тока крови.
Среди изменений сосудистой стенки особенно важно повреждение внутренней оболочки сосуда, чаще всего обусловленное атеросклеретическими и воспалительными поражениями ее. К повреждению стенки сосуда ведут и ангионевротические расстройства — спазмы артерий и артериол. Повреждение эндокарда при эндокардитах, инфарктах миокарда также сопровождается тромбообразованием.
Замедление и нарушение (завихрение) тока крови в артериях обычно возникают вблизи атеросклеротических бляшек, в полости аневризмы, при спазме; в венах — при варикозном расширении. Роль нарушений тока крови в развитии тромбоза подтверждается наиболее частой их локализацией на месте ветвления сосудов. О значении замедления тока крови для тромбообразования свидетельствует частое возникновение тромбов в венах при развитии сердечно-сосудистой недостаточности, при сдавлении вен опухолями, беременной маткой, иммобилизации конечности.
К общим факторам патогенеза тромбоза относят нарушение регуляции свертывающей и противосвертывающей систем крови и изменение состава крови. Главная роль принадлежит нарушениям баланса между свертывающей и противосвертывающей системами в регуляции жидкого состояния крови в сосудистом русле. Состояния повышенной свертываемости (гиперкоагуляция) часто являются следствием обширных хирургических операций и травм, беременности и родов, некоторых лейкозов, сопровождающихся тромбоцитозом (истинной полицитемин и других миелопролиферативных заболеваний), спленэктомии, эндотоксемии, шока, реакций гиперчувствительности, злокачественных опухолей.
Среди изменений состава (качества) крови наибольшее значение имеет повышение вязкости. Оно может быть обусловленс эритроцитозом или полицитемией, возникающими при дегидратации (чаще у детей), при хронических гипоксических состояниях (дыхательной недостаточности, цианотических врожденных пороках сердца), истинной полицитемии, увеличении содержания грубодисперсных фракций белков (например, при миеломной болезни).
С практической точки зрения важно выделить группы больных со склонностью к образованию тромбов. К ним можно отнести:
▲ больных, находящихся на длительном постельном режиме после операции;
▲ страдающих хронической сердечно-сосудистой недостаточностью (хроническим венозным полнокровием);
▲ больных с атеросклерозом;
▲ онкологических больных;
▲ беременных;
▲ больных с врожденными или приобретенными состояниями гиперкоагуляции, предрасполагающими к рецидивирующему тромбозу.
Механизм образования тромба.Инициальным моментом тромбообразования является повреждение эндотелия. Тромб образуется при взаимодействии тромбоцитов (кровяных пластинок), поврежденного эндотелия и системы свертывания крови (коагуляционного каскада).
Тромбоциты. Основная их функция — поддержание целости сосудистой стенки — направлена на прекращение или предотвращение кровотечения и является важнейшим звеном гемостаза. Тромбоциты осуществляют следующие функции:
▲ участвуют в репарации эндотелия посредством выработки PDGF (тромбоцитарный фактор роста);
▲ формируют тромбоцитарную бляшку на месте повреждения сосуда в течение нескольких минут — первичный гемостаз;
▲ участвуют в коагуляционном каскаде (вторичный гемостаз) путем активации фактора 3 тромбоцитов, что в конечном счете приводит к тромбообразованию.
Эндотелий. Для сохранения крови в своем обычном состоянии необходима целостность (структурная и функциональная) сосудистого эндотелия. Интактная эндотелиальная клетка модулирует некоторые звенья гемостаза и обеспечивает тромборезистентность, т.е. противостоит тромбообразованию в результате следующих процессов:
▲ продукция гепарансульфата — протеогликана, активирующего антитромбин III, который нейтрализует тромбин и другие факторы свертывания, включая IXa, Xa, XIa и ХПа;
▲ секреция естественных антикоагулянтов, таких как тканевый активатор плазминогена;
▲ расщепление АДФ;
▲ инактивация и резорбция тромбина;
▲ синтез тромбомодулина — поверхностноклеточного протеина, связывающего тромбин и превращающего его в активатор протеина С — витамин К-зависимый плазменный протеин, который ингибирует коагуляцию, лизируя факторы Va и VI—Иа;
▲ синтез протеина S — кофактора активированного протеина С;
▲ продукция PGI-2 — простациклина, обладающего антитромбогенным эффектом;
▲ синтез оксида азота (II) (NO), который действует аналогично PGI-2.
Понимание этих антитромбогенных механизмов, осуществляемых эндотелиальной клеткой на ее поверхности, позволяет понять значение дисфункции эндотелия как триггера тромбообразования.
Существуют также следующие факты, доказывающие про-тромбогенную функцию эндотелия:
• эндотелий синтезирует фактор Виллебранда, который способствует агрегации тромбоцитов и фактора V;
• эндотелий способен связывать факторы IX и X, что может вызвать коагуляцию на поверхности эндотелия;
• под воздействием интерлейкина-1 и фактора некроза опухоли (ФНО) эндотелий выбрасывает в плазму тромбопластин — потенциальный инициатор свертывания крови по внешней системе (внешнему пути).
Активация системы свертывания крови. Это решающий этап в прогрессировании и стабилизации тромба. Процесс завершается образованием фибрина — вторичный гемостаз. Это многоэтапный каскадный ферментативный процесс — коагуляционный каскад, требующий довольно много времени; при этом последовательно активируются проферменты. В процессе свертывания прокоагулянты — тромбопластины, превращаются в активные ферменты — тромбины, способствующие образованию из циркулирующего в крови растворимого фибриногена нерастворимого фибрина. Образующиеся нити фибрина скрепляют агрегаты тромбоцитов, образовавшиеся при первичном гемостазе. Это имеет большое значение для предотвращения вторичного кровотечения из крупных сосудов, наступающего через несколько часов или дней после травмы.
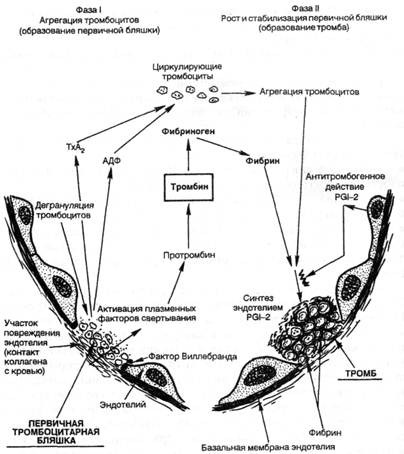
Механизм тромбообразования (тромбогенез) представлен следующими звеньями (рис. 4).
1. Адгезия тромбоцитов к обнаженному коллагену в месте повреждения эндотелиальной выстилки осуществляется с помощью фибронектина на поверхности тромбоцитов и стимулируется в большей степени коллагеном типа III, чем коллагеном базальной мембраны (IV тип). Медиатором является фактор Виллебранда, вырабатываемый эндотелием.
2. Секреция тромбоцитами АДФ и тромбоксана-А2 (ТХ-А2). вызывающего вазоконстрикцию и агрегацию тромбоцитов (блокирование образования Тх-А2 небольшими дозами аспирина лежит в основе превентивной терапии тромбообразования), гистамина, серотонина, PDGF и др.
3. Агрегация тромбоцитов — образование первичной тромбоцитарной бляшки.
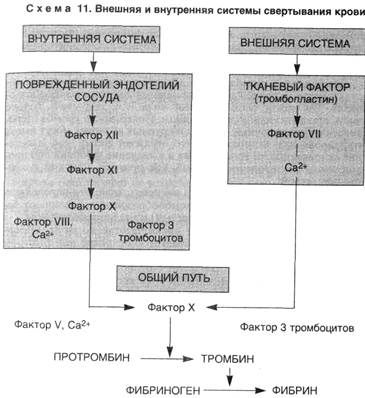
4. Активация процесса свертывания крови, или коагуляционного каскада (схема 11), с помощью следующих механизмов:
▲ внутренней системы свертывания, которая запускается контактной активацией фактора XII (Хагемана) коллагеном, фактора XI, прекалликреина, высокомолекулярного кининогена и усиливается фосфолипидом тромбоцитов (фактор 3), высвобождающимся при конформационных изменениях их мембраны;
▲ внешней системы свертывания, которая запускается тканевым тромбопластином, высвобождающимся из поврежденного эндотелия (тканей), и активирует фактор VII. В конечном итоге оба пути приводят к превращению протромбина (фактор II) в тромбин (фактор Па), который способствует превращению фибриногена в фибрин, а также вызывает дальнейшее выделение АДФ и Тх-А2 из тромбоцитов, способствуя их агрегации.
5. Агрегация стабилизируется образующимися отложениями фибрина — стабилизация первичной бляшки. В дальнейшем фибриновый сверток захватывает лейкоциты, агглютинирующиеся эритроциты и преципитирующие белки плазмы крови.
Таким образом, можно выделить следующие стадии морфогенеза тромба: ▲агглютинация тромбоцитов; ▲ коагуяция фибриногена с образованием фибрина; ▲ агглютинация эритроцитов; ▲ преципитация плазменных белков.
Рис. 4. Механизм образования тромба (схема). Объяснение в тексте.
Система свертывания работает в тесной связи с фибринолитической системой, которая модулирует коагуляцию и препятствует тромбообразованию. Механизм Действия фибринолитической истемы складывается из следующих стадий:
▲ превращение проэнзима плазминогена в плазмин — наиболее важный фибринолитический фермент; ▲ растворение фибрина с помощью плазмина; ▲ взаимодействие фибринолитической системы с системой свертывания на уровне активации фактора XII в ХIIа связывает систему свертывания, систему комплемента и кининовую систему.
Морфология тромба.Тромб обычно прикреплен к стенке сосуда в месте ее повреждения, где начался процесс тромбообразования. Он может быть пристеночным (т.е. закрывать только часть просвета) или обтурирующим. Поверхность тромба шероховатая. Пристеночные тромбы в крупных артериях могут иметь гофрированную поверхность, что отражает ритмичное выпадение склеивающихся тромбоцитов и выпадение фибрина при продолжающемся кровотоке. Тромб, как правило, плотной консистенции, сухой.
В зависимости от строения и внешнего вида, что определяется особенностями и темпами тромбообразования, различают белый, красный, смешанный (слоистый) и гиалиновый тромбы.
Белый тромб состоит преимущественно из тромбоцитов, фибрина и лейкоцитов, образуется медленно при быстром токе крови (чаще в артериях). Красный тромб, помимо тромбоцитов и фибрина, содержит большое число эритроцитов, образуется быстро при медленном токе крови (обычно в венах). В наиболее часто встречающемся смешанном тромбе, который имеет слоистое строение (слоистый тромб) и пестрый вид, содержатся элементы как белого, так и красного тромба. В смешанном тромбе различают головку (имеет строение белого тромба), тело (собственно смешанный тромб) и хвост (имеет строение красного тромба). Головка прикреплена к эндотелиальной выстилке сосуда, что отличает тромб от посмертного сгустка крови. Слоистые тромбы чаще образуются в венах, в полости аневризмы аорты и сердца. Гиалиновый тромб — особый вид тромбов, образующихся в сосудах микроциркуляторного русла; он редко содержит фибрин, состоит из разрушенных эритроцитов, тромбоцитов и преципитирующих белков плазмы, напоминающих гиалин. Увеличение тромба происходит путем наслоения тромботических масс на первичный тромб, причем рост тромба может происходить как по току крови, так и против тока. Исход тромбоза.Может быть различен. К благоприятным исходам относят асептический аутолиз тромба, возникающий под влиянием протеолитических ферментов и прежде всего плазмина. Установлено, что большинство мелких тромбов рассасывается в самом начале их образования. Другим благоприятным исходом является организация тромба, т.е. замещение его соединительной тканью, которая может сопровождаться процессами канализации и васкуляризации (восстановление проходимости сосуда). Возможно обызвествление тромба, в венах при этом возникают камни — флеболиты.
К неблагоприятным исходам относят отрыв тромба с развитием тромбоэмболии и септическое расплавле ние тромба, которое возникает при попадании в тромботические массы гноеродных бактерий, что приводит к тромбобактериальной эмболии сосудов различных органов и тканей (при сепсисе).
Значение тромбоза.Определяется быстротой его развития локализацией и распространенностью. Обтурирующие тромбы в артериях — явление опасное, так как приводят к развитию ин фарктов и гангрены.
Источник: studopedia.ru
1. Тромбоз. Определение.
Тромбоз (от греческого «тромбос» — комок) — это сложный прижизненный процесс образования в кровеносных сосудах или полостях сердца плотных масс, состоящих из стабилизированного фибрина и форменных элементов крови, способных в той или иной степени препятствовать деятельности сердца или/и движению крови по сосудам.
Анализируя данное определение, необходимо обратить внимание на следующие моменты. Во-первых, тромбоз является прижизненным явлением, отличаясь тем самым от посмертного свертывания крови. При тромбозе тромб фиксирован на сосудистой стенке, а посмертный сгусток крови лежит в просвете сосуда свободно и легко может быть из него удален. Это обстоятельство имеет важное значение в судебно-медицинской практике, когда необходимо установить причину смерти и время ее наступления. Во-вторых, тромбоз — это внутрисосудистое образование плотных масс, в той или иной степени препятствующих движению крови по сосудам. Образование тромба – это защитная реакция организма на повреждение (альтерацию) сосудистой стенки, препятствующая кровотечению. Однако, образовавшийся тромб не может так же и не препятствовать нормальному ламинарному кровотоку, и, в ряде случаев, способствовать дополнительному тромбообразованию, увеличению массы тромба и полной обтурации кровеносного сосуда. Тромбоз микроциркуляторных сетей – это основной патогенетический механизм шока и ДВС-синдрома. Кроме того, хорошо известно, что именно тромбы, образовавшиеся в сосудах или полостях сердца, в случаях их отрыва от сосудистой стенки, становятся эмболами, которые, обтурируя соответствующие сосудистые сети, способны вызывать серьезные нарушения кровообращения. Говоря о тромбозе, мы имеем в виду именно внутрисосудистое свертывание крови и образование плотных масс. Сгустки крови могут образовываться и вне сосудов, при физической, химической и иного рода травмах тканей организма, но в этом случае речь идет только об образовании кровяного сгустка, а не о тромбозе. Более подробно механизм так называемого «внешнего пути свертывания крови» будет рассмотрен далее. В-третьих, тромбоз – это сложный процесс, который включает в себя ряд стадий и ведет к образованию плотных масс, состоящих из стабилизированного фибрина и форменных элементов крови. Действительно, тромбоз – это многостадийный и многокомпонентный процесс, в котором участвуют как клеточные, так и плазменные факторы свертывания крови. Патология любого звена этого сложного процесса может иметь для организма весьма тяжелые последствия.
2. Свертывание крови.
Тромбообразование начинается с процесса свертывания крови. «Крупноблочную» схему свертывания крови можно представить следующим образом:
— образование ферментов, активирующих протромбин;
— превращение протромбина в тромбин под влиянием этих ферментов;
— превращение фибриногена в фибрин под влиянием тромбина.
Однако, как это уже было указано выше — свертывание крови это весьма сложный и многокомпонентный биохимический процесс и, что особенно важно, нарушение, возникшее на любой его стадии, может привести к развитию опасной патологии. Именно по этому, мы должны более подробно рассмотреть основные механизмы процесса свертывания крови.
Свертывание крови может инициироваться в двух случаях:
— при разрушении ткани в результате воздействия на нее некоего повреждающего (механического, физического, химического) фактора. В результате повреждения ткани в кровотоке и вне его появляются остатки разрушенных клеток и клеточных мембран. В этом случае свертывание крови развивается за счет действия активных факторов свертывания, выделяющихся из поврежденных тканей. Это, так называемый, внешний механизм свертывания крови;
— при изменении и повреждении (альтерации) эндотелия сосудов без физического разрушения последних. Это, так называемый, внутренний механизм свертывания крови, при котором образование тромбов инициируется биологически активными веществами, выделяющимися эндотелием сосудов и тромбоцитами. Именно такой процесс тромбообразования очень часто приводит к серьезным нарушениям микроциркуляции, гемодинамики и в исходе может иметь тяжелую патологию организма.
2.1. Физиологические механизмы свертывания крови.
В процессе свертывания крови сопряжены два физиологических механизма: клеточный и плазменный механизмы гемостаза.
Клеточный механизм гемостаза обеспечивает агрегацию (склеивание между собой) форменных элементов крови, их прикрепление к эндотелию сосудов (адгезию) и выделение из них веществ, активирующих каскадный процесс свертывания крови за счет плазменных факторов гемостаза.
Плазменный механизм гемостаза обеспечивается плазменными факторами свертывания крови и завершается процессом фибриообразования (образование сгустка крови), ретракцией кровяного сгустка и, в дальнейшем, его рассасыванием (фибринолизом).
Наиболее важную роль в клеточном механизме гемостаза играют кровяные пластинки — тромбоциты. В организме тромбоциты выполняют ряд весьма важных функций, среди которых, конечно, основное место занимают функции, связанные с тромбообразованием. Укажем основные функции тромбоцитов:
— способность к адгезии к сосудистой стенке и образование тромбоцитарных агрегатов за счет действия биологически активных веществ, выделяемых как тромбоцитами, так и эндотелиоцитами;
— поддержание спазма сосудов при их повреждении (первичный спазм сосудов возникает за счет симпатических влияний, поддержание спазма – за счет выделения биологически активных веществ из тромбоцитов и эндотелиоцитов);
— активация плазменных факторов свертывания крови, за счет выделения тромбоцитами соответствующих биологически активных веществ;
— участие в ретракции кровяного сгустка;
— участие в процессе фибринолиза;
— ангиотрофическая функция, заключающаяся в том, что тромбоциты обеспечивают питание, поддержание нормальной структуры и функции эндотелия микрососудов;
— репаративная функция, связанная с выделением тромбоцитами тромбоцитарного фактора роста (PDGF – Platelet-Derived Growth Factor), обеспечивающего пролиферацию фибробластов и гладкомышечных клеток.
2.1.1. Внутренний механизм тромбообразования. Клеточный гемостаз.
Рассмотрим более подробно каскадный процесс тромбообразования. В данном случае речь идет о внутреннем механизме тромбообразования.
Этот механизм запускается повреждением (альтерацией) эндотелия сосудистой стенки. Повреждение эндотелия может быть вызвано многими факторами, среди которых нужно выделить воспалительный и аллергический процессы, а также атеросклероз. В свою очередь, повреждение эндотелия сосудов приводит к инициации двух процессов: обнажению адгезивных белков субэндотелия и активации тромбоцитов.
Адгезивные белки субэндотелия (коллаген, фибронектин, тромбоспондин, фактор Виллебранда) связываются с рецепторами (интегринами) тромбоцитов и способствуют их прикреплению (адгезии) к сосудистой стенке. При активации тромбоцитов происходит образование и встраивание в мембрану этих клеток рецепторов агрегации («склеивания» тромбоцитов между собой) и рецепторов адгезии тромбоцитов к сосудистой стенке. Биологически активные вещества, активирующие тромбоциты, выделяются поврежденными клетками эндотелия сосудов. В их число входят фактор агрегации тромбоцитов (ФАТ), АДФ, тромбин и некоторые другие. Кроме того, активация тромбоцитов происходит и под влиянием катехоламинов и серотонина. Указанные активаторы тромбоцитов соединяются с рецепторным аппаратом этих клеток, что приводит к повышению уровня внутриклеточного Са++ за счет выхода его из внутриклеточных депо (из так называемых «электронно-плотных» гранул) и повышению поступления Са++ в тромбоциты из внеклеточной среды. Повышение концентрации Са++ в протоплазме тромбоцитов способствует дегрануляции a-гранул тромбоцитов, выходу из этих гранул таких биологически активных веществ (белков) как тромбоспондин, фактор Виллебранда, фибриноген, обеспечивающих агрегацию и адгезию тромбоцитов. Кроме того, помимо Са++ из электронно-плотных гранул во внеклеточную среду поступают серотонин и АДФ. В свою очередь, ионы кальция активируют фосфолипазу А2, лизирующую арахидоновую кислоту мембран тромбоцитов и, тем самым, обеспечивающую выработку мощного агреганта и вазоконстриктора – тромбоксана А2. Кроме того, тромбоксан А2 так же способствует выходу ионов Са++ из электронно-плотных гранул тромбоцитов. Активация тромбоцитов вызывает и увеличение количества адгезивных рецепторов на их мембране. Белковые вещества – тромбоспондин, фактор Виллебранда, фибриноген образуют своеобразные «мостики» между рецепторами тромбоцитов и рецепторами белков субэндотелиального слоя микрососудов. Тромбоцитарные факторы свертывания крови приведены в таблице № 1.
Таблица 1
Фактор 2 – фибринопластический фактор (акцелератор тромбина). Ускоряет превращение фибриногена в фибрин.
Фактор 3 – тромбоцитарный тромбопластин.
Фактор 4 – антигепариновый фактор. Предотвращает ингибирующее действие антитробина III (плазменного кофактора гепарина) на тромбин крови.
Фактор 5 – свертываемый фактор (тромбоцитарный фибриноген). Участвует в формировании рецепторов тромбоцитов к фибриногену плазмы крови.
Фактор 6 – тромбостенин. Сократительный белок тромбоцитов (актимиозиновый комплекс), обеспечивающий ретракцию тромба
Фактор 7 – тромбоцитарный котромбопластин.
Фактор 8 – антифибринолизин. Белковый фактор, препятствующий преждевременному лизису фибрина
Фактор 9 – фибринстабилизирующий фактор. По действию аналогичен XIII плазменному фактору свертывания крови.
Фактор 10 – серотонин.
Фактор 11 – аденозиндифосфат (АДФ).
Этап клеточного гемостаза завершается тем, что на поврежденном участке сосудистой стенки оседает и закрепляется слой тромбоцитов тесно связанных как между собой, так и субэндотелием сосудов. Образовавшаяся тромбоцитарная прослойка, белки субэндотелия, а также кининоген плазмы крови являются активаторами плазменного XII фактора свертывания крови (фактора Хагемана). Так запускается внутренний механизм каскадной активации плазменных факторов свертывания крови. Сведения о плазменных факторах свертывания крови приведены в таблице № 2. Схема, иллюстрирующая плазменные механизмы свертывания крови, представлена на Рис. 1.
Таблица № 2.
По решению Международного комитета по гемостазу и тромбозу в 1957 году плазменным факторам свертывания крови присвоены римские цифры, а тромбоцитарным (клеточным) факторам свертывания – арабские. Активированным плазменным факторам свертывания крови присваивается тот же номер, что и неактивированным, но с добавлением символа «а». Например, «Ха» — активированный десятый фактор свертывания крови.
Фактор I – фибриноген. Гликопротеин с массой 340 кДа, вырабатывается гепатоцитами в виде растворимой в плазме крови форме фибриногена А. Под воздействием тромбина (протеолитическое дробление молекулы) превращается в нерастворимый белок – фибрин, который и образует основное вещество тромба.
Фактор II – протромбин. Эуглобулин (разновидность глобулинов) синтезируется гепатоцитами при участии витамина К, под воздействием протромбиназы превращается в a, b и g-тромбины. Наибольшей свертывающей активностью обладает a-тромбин.
Фактор III – тканевый тромбопластин (апопротеин С). В относительно больших количествах содержится в тканях мозга, легких, сердца, кишечника. В небольших количествах может синтезироваться в моноцитах. Участвует в одном из путей образования протромбиназы.
Фактор IV – ионы кальция (Са++). Играют ведущую роль в активации протромбиназы и превращении протромбина в тромбин, в ускорении превращения фибриногена в фибрин, ингибируют фибринолиз, участвуют в агрегагации тромбоцитов и ретракции кровяного сгустка.
Фактор V – проакселерин (Ас-глобулин). Участвует в образовании кровяной протромбиназы, активируя фактор Х свертывания крови, способствует превращению протромбина в тромбин.
Фактор VI – акселерин (сывороточный Ас-глобулин). Активная форма V фактора свертывания крови. Так как в настоящее время к плазменным факторам свертывания крови относятся только неактивные формы этих факторов, исключен из номенклатуры факторов свертывания.
Фактор VII – проконвертин (конвертин). Синтезируется в гепатоцитах в присутствии витамина К. В активную форму (конвертин, фактор VIIa) превращается под влиянием факторов XII, Xa, калликреина. Участвует в образовании протромбиназы и в превращении протромбина в тромбин. Наследственная недостаточность VII фактора приводит к развитию наследственной гипоконвертинемии – одному из петехиально-пятнистому типу кровоточивости.
Фактор VIII – антигемофильный глобулин А (плазменный тромбопластический фактор). Синтезируется в печени, селезенке, почках, эндотелии. В крови циркулирует в виде комплекса, состоящего из трех субединиц, из которых субединица VIII-фВ – фактор Виллебранда обеспечивает адгезию тромбоцитов к субэндотелию (коллагеновые волокна и микрофибриллы). Наследуемый недостаток субединицы VIII-ФВ приводит к развитию болезни Виллебранда – синячково-гематомного типа кровоточивости, а наследуемая недостаточность всего фактора VIII – к развитию гемофилии А.
Фактор IX – антигемофильный глобулин В (Кристмас-фактор). Синтезируется гепатоцитами, активируется с участием ионов кальция, при участии активированного VIII фактора и ионов кальция переводит Х фактор свертывания в активное состояние. Наследственная недостаточность IX фактора приводит к развитию гемофилии В (болезни Кристмаса).
Фактор Х – фактор Стюарта – Прауэра. Гликопротеин с массой 56 кДа. Синтезируется в гепатоцитах при участии витамина К. Врожденный недостаток Х фактора приводит к развитию болезни Стюарта – Прауэра (петехиально-пятнистый тип кровоточивости, редкое наследственное заболевание, характеризующиеся одновременным нарушением внешнего и внутреннего механизмов свертывания крови).
Фактор XI – плазменный предшественник тромбопластина. Гликопротеин с массой 160 кДа. Наследственная недостаточность XI фактора приводит к повышенной кровоточивости, особенно после травм и операций.
Фактор XII – фактор контакта Хагемана. Гликопротеин с массой 80 кДа, обеспечивает процесс внутрисосудистой коагуляции, активирует прекалликреины плазмы крови, превращая их в калликреиы, которые, в свою очередь, участвуют в образовании кининов. Одновременно с участием во внутрисосудистой коагуляции является активатором фибринолиза. Наследственная недостаточность XII фактора приводит к развитию болезни Хагемана – значительному увеличению времени свертывания крови без геморрагических проявлений.
Фактор XIII – фибринстабилизирующий фактор (фибриназа, фактор Лаки – Лоранда). Гликопротеин с массой 340 кДа, защищает кровяной сгусток от преждевременного лизиса.

Примечание: 1. Пунктирными стрелками обозначены активирующие влияния;
2. Символ «а» указывает на то, что фактор свертывания крови активирован;
3. Названия факторов свертывания см. в приводимой справке.
2.1.2. Внутренний механизм свертывания. Плазменные факторы свертывания.
Фактор Хагемана является активатором другого плазменного фактора свертывания – XI фактора (плазменного предшественника тромбопластина), который в активном состоянии обозначается как фактор XIa. Фактор XIa в присутствии ионов Са++ и фосфолипидов активирует фактор IX (активный Кристмас-фактор, IXa), который, образуя комплекс с VIII фактором (антигемофильным глобулином А) и ионами Са++, активирует Х фактор (фактор Стюарта-Прауэра). В свою очередь, активированный Х фактор (фактор Ха) благодаря объединению с V фактором (проакселерином), ионами Са++ и фосфолипидами образует активный фермент, преобразующий фактор II (протромбин) в тромбин (фактор IIа). Под действием тромбина в присутствии ионов Са++ от фибриногена (фактор I) отщепляются четыре полипептида, и он превращается в фибрин-мономер, который в дальнейшем, полимеризируясь, переходит в состояние фибрина-полимера. Эта форма фибрина без стабилизации может легко расщепляться протеиназами крови. Стабилизация фибрина осуществляется активированным XIII плазменным фактором свертывания (фибринстабилизирующим фактором), который становится активным (т. е. превращается в фактор XIIIa) под влиянием тромбина (фактора IIa) и ионов Са++. В результате сгусток (тромб) становится прочным, эластичным и устойчивым к действию протеаз, в частности, плазмина. В нитях стабилизированного фибрина, сцепленных между собою и прикрепленных к поврежденному участку сосуда, как в сети, запутываются форменные элементы крови – эритроциты и лейкоциты. Через некоторое время кровяной сгусток (тромб) сжимается (стадия «ретракции тромба»), выдавливая из себя жидкую составляющую. В ретракции тромба обязательное участие принимают тромбоциты, выделяющие сократительный белок – тромбостенин (актомиозиновый комплекс), который активируется при контакте с АТФ. Так завершается каскадный процесс внутреннего свертывания крови.
2.1.3. Внешний механизм свертывания крови.
Внешний механизм свертывания крови инициируется факторами свертывания, выделяющимися из поврежденных тканей. При этом, фактор III (тканевый тромбопластин), взаимодействуя с VII фактором (проконвертином) и ионами Са++, переводит фактор VII в активное состояние (т. е. в состояние VIIa), который, в свою очередь, активирует фактор Х (фактор Стюарта-Пауэра). Активный фактор Х (Ха) в комплексе с фактором V (проакселерином) и ионами Са++ образуют фермент, переводящий протромбин в тромбин.
Далее механизм внешнего свертывания крови следует по уже известному пути внутреннего свертывания вплоть до образования стабилизированного фибрина (Рис.1.).
3. Фибринолиз.
Важным механизмом гемостаза является фибринолитическая система крови. Основным звеном этой системы выступает плазминоген (профибринолизин), превращение которого в активный фермент плазмин (фибринолизин) происходит благодаря нескольким биохимическим механизмам (Рис.2.)

Рис. 2. Схема фибринолиза. Пояснения в тексте
Во-первых, активация плазминогена происходит за счет воздействия на него белка — тканевого активатора плазминогена, Который вырабатывается клетками многих тканей, в том числе – и эндотелиоцитами сосудистой стенки. Во-вторых, активатором плазминогена является калликреин плазмы крови, который образуется в кининовом цикле под воздействием фактора Хагемана (XII плазменный фактор свертывания крови). И, наконец, в третьих, активация плазминогена и превращение его в плазмин происходит при реализации урокиназного фибринолитического механизма. В этом случае проурокиназа, содержащаяся в плазме крови, а также в почках, становится активным ферментом урокиназой под влиянием уже образовавшегося плазмина или калликреина плазмы крови.
Фибринолитическая система крови может не только приходить в активное состояние и обеспечивать рассасывание образовавшихся тромбов или кровяных сгустков, но и ингибироваться несколькими путями.
Во-первых, это происходит благодаря ингибиторам плазмина, к которым относятся такие белки, как a2-антиплазмин (серпин), a2-макроглобулин, a1-антитрипсин и
антитромбин III.
Во-вторых, в плазме крови содержатся так называемые ингибиторы активаторов плазминогена (ИАП-1, ИАП-2, ИАП-3). Наиболее действенным из них является ИАП-1, который ингибирует тканевый активатор плазминогена. Важно, что оба эти механизма препятствует фибринолизу в месте образования тромба на стенке сосуда.
Из изложенного выше материала видно, что тромбообразование – это локальный процесс (в данном случае речь идет о внутреннем механизме свертывания крови), возникающий при очаговом повреждении сосудистого эндотелия. При этом, процесс тромбообразования, не смотря на каскадную активацию тромбоцитарных и плазменных факторов свертывания крови, не должен приводить к тотальному свертыванию крови во всей сосудистой сети1) .
4. Противосвертывающая система
Свертыванию крови вне зоны образования внутрисосудистого тромба препятствует ряд ингибиторов процесса свертывания, которые в целом образуют противосвертывающую систему крови, основным направлением деятельности которой является инактивация тромбина. Главную роль в этой системе играет антитромбин III – гликопротеин постоянно присутствующий в плазме крови. Соединяясь с активированным протромбином (т. е. с тромбином – плазменным фактором IIa – см. схему свертывания крови) он ингибирует активность тромбина, а также активность плазменных факторов свертывания IXa – Кристмас-фактора, Ха – фактора Стюарта-Прауэра и XIa – плазменного предшественника тромбопластина. Следует иметь в виду, что активность антитромбина III
резко повышается в том случае, если он вступает в соединение с гепарином – полисахари-
________________________________
1) Тотальное тромбообразование, к сожалению, так же возможно. Эта патология носит название «ДВС-синдром» — синдром диссеминированного внутрисосудистого свертывания. С ним мы познакомимся позднее.
дом, содержащимся практически во всех тканях организма, а также вырабатываемым тучными клетками. Помимо антитромбина III ингибитором тромбина является a2-макроглобулин (гликопротеин плазмы крови, о котором мы уже говорили при рассмотрении процесса фибринолиза) и белок тромбомодулин, являющийся рецептором эндотелиальных клеток и способный образовывать прочное соединение с молекулами тромбина, после чего последний теряет свою активность и уже не может превращать фибриноген в фибрин.
Образовавшийся комплекс тромбомодулин – тромбин, в свою очередь, в присутствии ио-
нов Са++ активирует белок плазмы крови протеин С, который способен инактивировать такие плазменные факторы свертывания как проакселерин (V фактор) и антигемофильный глобулин А (VIII фактор).
Помимо системного действия противосвертывающая система крови способна оказывать свое влияние и локально, то есть непосредственно в зоне образования внутрисосудистого тромба, замедляя процесс тромбообразования. В норме, свертывающая и противосвертывающая системы крови взаимно уравновешивают друг друга. Однако при определенной патологии, в частности, при альтерации или дисфункции сосудистого эндотелия, это равновесие может нарушаться, в результате чего сосудистый тромбоз становится причиной серьезный нарушений макро — и микроциркуляции крови.
5. Роль эндотелия сосудов в тромбообразовании.
Эндотелий кровеносных сосудов играет решающую роль как в предупреждении свертывания крови и образовании тромбов, так и, в случае его альтерации или дисфункции, в активации процесса тромбообразования. При этом, эндотелием выделяются биологически активные вещества, обладающие разнонаправленным действием не только на процесс свертывания крови, но и на сосудистый тонус. Так, биологически активные вещества, выделяемые эндотелием и препятствующие свертыванию крови, одновременно являются и вазодилататорами, а биологически активные вещества, способствующие тромбообразованию, способны спазмировать сосуды. Кроме того, как правило, антикоагулянты и вазодилататоры препятствуют пролиферации гладкомышечных клеток сосудов и некоторых других элементов сосудистой стенки, а коагулянты и вазоконстрикторы – стимулируют эти процессы.
Рассмотрим более подробно первую группу этих биологически активных веществ, а также некоторые другие факторы, препятствующие тромбообразованию в кровеносных сосудах, имеющих неповрежденный эндотелий.
В норме, неповрежденный эндотелий сосудов покрыт микроскопической слизистой пленкой (гликокаликсом), состоящей из гликопротеинов и обладающей антиадгезивными свойствами (то есть, препятствующей адгезии – прилипанию тромбоцитов к сосудистой стенке). Сдерживает адгезию тромбоцитов и положительный электрический заряд эндотелиоцитов, так как тромбоциты так же несут на себе положительные заряды и, следовательно, отталкиваются от эндотелия.
Выше мы уже упоминали о том, что очень важную роль в агрегации тромбоцитов и их адгезии к сосудистой стенке играют биологически активные вещества, вырабатываемые тромбоцитами при увеличении концентрации ионов Са++ в цитоплазме тромбоцитов. В норме эндотелиоцитами вырабатываются два биологически активных вещества, из которых одно – простагландин I2, активируя фермент аденилатциклазу, превращающую АТФ в цАМФ, способствует переходу ионов Са++ из цитоплазмы тромбоцитов в электронно-плотные гранулы, а второе – оксид азота (NO), активируя фермент гуанилатциклазу, способствует образованию цГМФ, который ингибирует переход ионов Са++ из крови в цитоплазму тромбоцитов. Таким образом, нормальный, неповрежденный эндотелий сосудов создает и поддерживает сложный механизм, препятствующий как тромбообразованию, так и непродуктивной вазоконстрикции. При этом, вазодилатация обеспечивается в основном благодаря действию на гладкомышечные клетки того же оксида азота (NO), выделение которого стимулируется такими биологически активными веществами как гистамин, брадикинин, ацетилхолин. Следует иметь в виду, что сосудорасширяющее действие ацетилхолина на коронарные сосуды и сосуды головного мозга реализуется не за счет прямого действия этого вещества на сосудистую стенку, но исключительно через продукцию оксида азота.
Ситуация радикально меняется в том случае, если эндотелий кровеносных сосудов поврежден каким либо патологическим процессом. Чаще всего – это атеросклероз. Как уже было описано выше, обнажившийся субэндотелий за счет активации адгезивных белков и появления соответствующих рецепторов тромбоцитов инициирует внутренний процесс свертывания крови, а выделяющиеся биологически активные вещества активируют и пролонгируют этот процесс. Спазм сосудов, провоцируемый симпатическими влияниями, а также веществами – вазоконстрикторами, усугубляет процесс тромбообразования. Внутреннему процессу тромбообразования способствуют и некоторые другие факторы. Среди них нужно выделить замедление кровотока и изменение физико-химических (агрегатных) свойств крови. Чем быстрее кровоток в сосуде, тем труднее форменным элементам (в частности, тромбоцитам) удерживаться около сосудистой стенки, даже несмотря на ее повреждение. Например, при выраженном атеросклерозе наиболее сильно повреждается стенка восходящей аорты. Однако в этой части аорты тромбы образуются очень редко, так как скорость кровотока здесь столь велика, что начинающий формироваться тромб все время отрывается от стенки и уносится током крови. Наиболее же часто тромбы образуются в венах, где кровоток резко замедлен. Поэтому любой фактор, вызывающий замедление кровотока в сосудах, будет способствовать тромбообразованию. С другой стороны, и изменение агрегатных свойств крови реально влияет на процессы тромбообразования. Например, при таком заболевании, как эритремия, при котором значительно увеличивается количество всех форменных элементов крови, в том числе и кровяных пластинок — тромбоцитов, и возрастает вязкость крови, очень часто возникает генерализованный тромбоз сосудов, от чего больной и погибает.
Однако оба указанных фактора остаются лишь условиями, способствующими тромбообразованию, но не более. Если нет повреждения сосудистой стенки, тромб не образуется, даже если в сосуде замедлился кровоток и изменились физико-химические свойства крови.
6. Исходы тромбоза.
Степень нарушения функции органов при тромбозе зависит от его исхода, который может быть следующим:
1. Организация тромба, то есть его прорастание соединительной тканью. В этом случае он прочно закрепляется в сосуде и в зависимости от величины тромба и диаметра просвета сосуда, в котором он образовался, тромб в той или иной степени нарушает движение крови по сосудам.
2. Отрыв тромба и его превращение в эмбол. В этом случае оторвавшийся тромб переносится током крови в другие регионы тела закупоривает сосуд, через который он не может пройти, и вызывает нарушения местного кровообращения в данной области.
3. Канализация тромба. Если тромб рыхлый, а напор крови в сосуде высок, то кровь может проделать в сосуде канал, и кровоток, таким образом, полностью или частично (это зависит от диаметра канала) восстановится.
4. Гнойное расплавление тромба. При инфицировании тромба в области, где он расположен, может начаться гнойное воспаление. От тромба станут отрываться кусочки и превращаться в эмболы. Помимо нарушений гемодинамики, которые эти эмболы вызовут, закупоривая мелкие сосуды, они будут способствовать диссеминации микроорганизмов в различные органы и ткани.
5. Рассасывание (лизис) тромба, приводящее к восстановлению кровотока в сосуде. В этом случае степень нарушения функции тканей будет зависеть от длительности процесса ишемии до момента полного рассасывания тромба.
7. Синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром).
Некоторые виды тромбоза являются особо опасными для организма. К таким видам в первую очередь относится ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания крови), который является одним из важнейших факторов в патогенезе и танатогенезе ряда заболеваний, а также терминальных состояний. ДВС — синдром проявляется в том, что за короткое время (часы) в мелких кровеносных сосудах образуются тромбы, причем в данном случае процесс не является локальным, а захватывает практически все сосудистое русло, приводя, таким образом, к генерализованным расстройствам гемодинамики.
Распространенность ДВС-синдрома столь велика, что это дало основание американскому ученому Дональду Мак-Кею высказать предположение о том, что этот процесс является промежуточным механизмом любого заболевания. Однако наиболее ярко этот синдром проявляется при эмболии околоплодными водами во время родов, отравлениях солями тяжелых металлов, повреждении форменных элементов крови в аппарате искусственного кровообращения, при поражении микроциркуляторного русла в динамике шоковых состояний, при анафилаксии, отторжении трансплантата, генерализованном поражении сосудистой стенки при сепсисе, риккетсиозах и т. д.
В динамике ДВС-синдрома различают следующие три стадии:
Первая стадия носит название коагуляционной и характеризуется резкой активацией процессов свертывания крови. Клиническая картина определяется расстройствами местного кровообращения, в зависимости от того, в каком сосудистом регионе наиболее активно образуются кровяные сгустки. В этот период происходит компенсаторная активация антисвертывающей системы крови, массивный выброс в кровь гепарина и стимуляция процессов фибринолиза. Если образование сгустков крови было кратковременным эпизодом, то гепарин затормозит процесс дальнейшей коагуляции, а фибринолитическая система растворит образовавшиеся кровяные сгустки и наступит выздоровление. Если же этого не произойдет, то либо больной погибнет от расстройств местного кровообращения, либо процесс перейдет во вторую стадию.
Вторая стадия этого синдрома носит название коагулопатии потребления и заключается в том, что на определенном этапе первой стадии происходит исчерпание запасов фибриногена и факторов свертывания крови. Вследствие этого процесс свертывания прекращается, но на фоне уже имеющихся микротромбов начинается массивное кровотечение, поскольку дефект любого травмированного сосуда (от аорты до капилляра) не прикрывается тромбом, так как нет фибриногена и других факторов свертывания. Если данная стадия ДВС-синдрома совпадает, например, с операцией или ранним послеоперационным периодом, то может возникнуть на первый взгляд парадоксальная ситуация: на фоне образования микротромбов больной погибает от профузного кровотечения из перерезанных сосудов. С другой стороны, прекращение тромбообразования приводит и к снижению активности фибринолитической системы, так что уже образовавшиеся микротромбы перестают растворяться.
Третья стадия — стадия фибринолиза — наступает в том случае, если фибринолиз не только не подавлен, но продолжает активироваться.
Предлагается выделить в ДВС-синдроме и четвертую стадию — стадию восстановления, клиническую картину которой определяют дистрофические изменения и множественные некрозы в органах. Естественно, эта стадия развивается лишь в том случае, если в течение первых трех стадий не наступила смерть больного.
При ДВС-синдроме различают пять видов микротромбов в зависимости от того, какие компоненты в тромбе преобладают: фибриновые, тромбоцитарные, эритроцитарные, лейкоцитарные и смешанные (перечисление идет в порядке снижения частоты образования тромбов).
Таковы основные физиологические и патологические механизмы тромбообразования.
Источник: pandia.ru
