Измерение кислорода в крови — далеко не новая функция, однако особый интерес к ней появился с выходом на рынок популярного фитнес-трекера Honor Band 5.
Что же такое сатурация крови кислородом (SpO2)? Нужно ли измерять этот параметр и можно ли вообще доверять показаниям фитнес-браслета или смарт-часов, которые, по сути, не являются медицинскими приборами?
В данной статье мы подробно ответим на все поставленные выше вопросы и разберемся, не является ли модная «фишка» современных трекеров очередным маркетинговым трюком для подогрева интереса к своим устройствам.
Читайте также:
- Вариабельность пульса в Apple Watch
- Что такое VO2 max на фитнес-трекерах
- Сон и фитнес-браслеты. Руководство для чайников
Что такое SpO2 и зачем нам нужен кислород?
Клеткам организма нужна энергия для того, чтобы двигаться, синтезировать белок и создавать другие химические вещества. Это основа любой жизни.
Представьте свой организм в виде двигателя автомобиля, внутри которого сжигается бензин и происходит движение поршней. Для того, чтобы произошло возгорание требуется воздух, а точнее кислород, содержащийся в нем.
Такой «бензин» (питательные вещества) + кислород нужны и нашим клеткам для окисления и получения молекул АТФ (это основной источник энергии в организме).
Но каким образом в клетки попадает кислород?
Кровь на 40% состоит из клеток, остальные 60% — это плазма (светлая жидкость из воды, солей и минералов). Подавляющее большинство клеток — это эритроциты, называемые еще красными кровяными тельцами. Они составляют 99% всех клеток крови (примерно 20-25 млрд штук):
В каждом таком эритроците содержится более 250 млн молекул гемоглобина. Именно эта молекула и способна связываться с кислородом для переноса его во все ткани организма.
Другими словами, гемоглобин — это, своего рода, «такси» для перевозки кислорода по всему организму. Когда кровь протекает через легкие, гемоглобин «выхватывает» оттуда молекулы кислорода и доставляет их к тканям, а оттуда, на обратном пути, забирает «отработанный материал» — углекислый газ.
Теперь, когда кровь снова будет протекать через легкие, гемоглобин оставит там «отработку» и заберет новую порцию кислорода. А мы, в свою очередь, сделаем очередной выдох и вдох, чтобы очистить легкие от углекислого газа и набрать свежего материала из воздуха.
И здесь следует сделать маленькое уточнение. Не каждая молекула гемоглобина — примерный водитель. Кто-то может просто не взять «пассажира» и проехаться по всему пути без кислорода, «налегке».
SpO2 как раз и показывает соотношение гемоглобина, содержащего кислород, к общему количеству гемоглобина в крови
Какая норма SpO2 (сатурации крови кислородом)?
Нормой SpO2 для здорового человека считается 96-99% оксигемоглобина (так называется гемоглобин, содержащий кислород). Другими словами, практически весь гемоглобин должен содержать кислород.
Кстати, именно кислород придает крови характерный цвет. Чем больше кислорода в гемоглобине — тем ярче будет цвет. Поэтому артериальная кровь, которая несет кислород к тканям, имеет ярко-красный цвет, а венозная кровь (оттекающая от тканей) — темно-красная, так как содержит уже на треть меньше кислорода.
Важно отметить тот факт, что уровень SpO2 может слегка падать при физических нагрузках и это совершенно нормально.
Если сатурация падает ниже 90%, наступает гипоксемия (недостаток кислорода в крови), которая может привести к гипоксии (низкий уровень кислорода в тканях организма).
При некоторых болезнях насыщение гемоглобина кислородом также снижено. К примеру, обострение бронхиальной астмы может привести до падения SpO2 ниже 90%, что требует незамедлительной госпитализации.
Каким образом фитнес-браслеты измеряют уровень кислорода в крови? Можно ли этим показателям доверять?
Ответ на второй вопрос будет кратким — да, доверять показателям фитнес-трекера можно.
Принцип измерения сатурации гемоглобина кислородом на фитнес-браслете ничем не отличается от принципа работы медицинского прибора пульсоксиметра и заключается в следующем:
Специальный датчик излучает свет, который проходит через ткани, отражается и попадает на фотодетектор. Определенное количество этого света поглощается кровью, а сколько именно — зависит от степени насыщения ее кислородом.
На основании того, сколько света было поглощено, и рассчитывается показатель SpO2.
Точно таким же образом работает и пульсометр любого фитнес-трекера. Типичный датчик, состоящий из фотодетектора и излучателей выглядит так:
Более того, даже многие смартфоны умеют измерять SpO2 и делают это достаточно точно. К примеру, большинство флагманов от Samsung (серии Galaxy S и Galaxy Note) замеряют уровень кислорода в крови без каких-либо дополнительных приборов. Датчик SpO2 у них находится сзади, в районе камеры:
Для этого необходимо открыть приложение Samsung Health и выбрать измерение SpO2 или измерение уровня стресса:
А теперь попробуем ответить на главный вопрос.
Зачем измерять SpO2? В чем смысл этой функции на фитнес-браслетах?
Есть ситуации, при которых измерение SpO2 имеет критически важное значение для жизни человека. Но, к сожалению, фитнес-браслеты не имеют к этим ситуациям никакого отношения:
- Контролировать SpO2 требуется, главным образом, при анестезии во время операции. Это одна из основных задач анестезиолога.
- Также бывает важно следить за уровнем кислорода в период восстановления после серьезных операций или перенесенных проблем со здоровьем, таких как инфаркт.
Но в текущей реализации, фитнес-браслеты не способны заменить специализированные устройства (подробнее об этом — в самом конце статьи). А вот для рядового пользователя измерять SpO2 особого смысла нет. Хотя, при желании, можно придумать несколько областей для применения такого «датчика кислорода»:
1. Профессиональный спорт
Как уже было сказано выше, уровень SpO2 падает при физических нагрузках. Отслеживая этот показатель во время интенсивных тренировок, можно узнать пределы своего организма и пытаться улучшить свои физические показатели.
С другой стороны, в профессиональном спорте более важен показатель VO2 max, который сегодня также пытаются измерять некоторые фитнес-трекеры и умные часы. Но это уже тема совершенно другого разговора.
2. Альпинизм
Как известно, воздух в горах разреженный, то есть, в нем содержится меньше кислорода. И при определенном снижении уровня кислорода, вы даже можете почувствовать себя лучше. Но если снижение продолжится, это может обернутся плохими последствиями.
Поэтому, контролируя SpO2 во время восхождения, можно снизить риск возникновения проблем и плохого самочувствия. К примеру, когда процент кислорода начнет сильно падать, необходимо снизить нагрузку — изменить скорость подъема, передохнуть или вообще пересмотреть свои планы.
Но…
Опять-таки, для каждой из этих задач есть гораздо более удобные инструменты.
Главная проблема фитнес-браслетов и умных часов на текущий момент заключается не в точности измерений, а в отсутствии режима непрерывного измерения SpO2.
Сегодня практически все браслеты делают разовые замеры в течение 15-30 секунд и не способны сигнализировать о падении уровня кислорода в крови. А это основная задача пульсоксиметров.
Источник: deep-review.com
МИОГЛОБИН И ГЕМОГЛОБИН. ТРАНСПОРТ КИСЛОРОДА
МИОГЛОБИН – сложный глобулярный белок, третьего уровня структурной организации, молекула которого состоит из 1 полипептидной цепи и содержит 153 аминокислоты. В миоглобине содержится железопорфириновая группа (гем), и он способен обратимо присоединять кислород.
Миоглобин содержится в клетках скелетных мышц. Пептидная цепь миоглобина напоминает длинную колбасу, причудливо скрученную. Было показано, что остов молекулы миоглобина состоит из 8 относительно прямолинейных отрезков, разделенных между собой местами сгибов. Каждый отрезок закручен в виде a-спирали. Все спирали являются правыми. 70 % аминокислотных остатков входят в состав спирализованных участков.
Свойства миоглобина:
1. молекула миоглобина компактна (внутри нее может уместиться 4Н2О);
2. все полярные R- группы аминокислотных остатков расположены на внешней поверхности молекулы и находятся в гидратированном состоянии, т.е. связаны с Н2О;
3. неполярные, или гидрофобные R- группы располагаются в глубине молекулы и защищены от соприкосновения с Н2О;
4. остатки пролина встречаются только в метах сгибов пептидной цепи (пролин нарушает a-спираль). В местах сгибов находятся и другие аминокислоты, которые неспособны легко образовывать a-спираль (изолейцин, серин), и аминокислоты, боковые цепи которых несут одинаковые заряды при рН7;
5. у миоглобинов, выделенных из разных млекопитающих, конформация пептидных цепей сходна (но они несколько отличаются по аминокислотному составу).
ГЕМ — комплекс порфирина и иона железа в степени окисления +2.
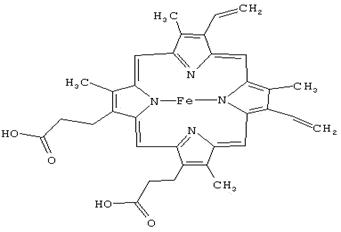
Ион железа встроен в кольцо порфирина таким образом, что четыре координационные связи из шести (в состоянии гибридизации sp3d2 связи у шестикоординационного железа направлены к вершинам октаэдра) затрачены на образование связей с атомами азота, еще одна связана с азотом имидазольного остатка ГИС полипептидной цепи (проксимальный Гистидин F8), а другая- также с имидазольным остатком другого ГИС (дистальный ГИС Е7).
лекула кислорода присоединяется между остатком дистального ГИС и железом. Изменения степени окисления железа при этом не происходит. Порфириновое кольцо (ГЕМ) не находится на плоскости молекулы белка, а частично погружено в него. Молекула кислорода присоединяется к гему, входя как бы через открывающуюся дверцу. Пока остается несным, дожидается молекула кислорода случайного открывания двери, или существует какой-то механизм, пускающий кислород к гему.
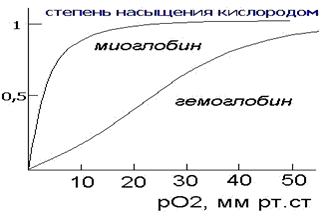
Миоглобин сосредоточен, главным образом, в мышцах и его главной функцией является хранение кислорода. Скорость насыщения миоглобина кислородом намного превышает таковую для гемоглобина. Миоглобин мало приспособлен для транспортировки кислорода из легких в ткани, поскольку скорость отдачи кислорода в тканях невелика (при давлении 1 мм рт. ст. примерно половина миоглобина все еще не отдает кислород).
Вопросы транспортировки кислорода решаются при участии белка четвертичной структуры — гемоглобина.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА ГЕМОГЛОБИНА.
em>При помощи рентгеноструктурного анализа Перутцем и его сотрудниками в Кембридже установлены третичная и четвертичная структуры гемоглобина. Гемоглобин содержится в эритроцитах и служит для переноса кислорода. Молекулярная масса гемоглобина 64500. Молекула состоит из 4 отдельных полипептидных цепей: 2 a-цепей (141 остаток аминокислот) и 2 b- цепей (146 остатков аминокислот в каждой), каждая из которых связана нековалентной связью с остатками гема. Каждая из 4 отдельных цепей гемоглобина свернута нерегулярным образом и состоит из ряда a- спиральных участков, разделенных местами сгибов.
a- и b- цепи гемоглобина примерно на 70 % состоят из a-спиральных участков. По своей третичной структуре a- и b-цепи очень сходны, они образованы из a- спиральных участков одинаковой длины, согнутых под одинаковыми углами и в одних и тех же направлениях. Третичная структура a- и b-цепей гемоглобина очень сходна с третичной структурой единственной цепи миоглобина. Сходная функция гемоглобина и миоглобина, обусловленная способностью обратимо связывать О2, объясняется сходством третичной структуры.
Согласно данным рентгеноструктурного анализа молекула гемоглобина по своей форме приближается к сфере диаметром ~ 5,5 нм. 4 полипептидные цепи уложены относительно друг друга приблизительно в виде тетраэдра, в результате чего возникает характерная четвертичная структура гемоглобина.
Это очень компактная структура. Большинство гидрофобных R- групп аминокислот находится внутри глобулы, а большинство гидрофильных R- групп – снаружи. В молекуле гемоглобина возникает небольшое число контактов между одинаковыми цепями (2 a- и 2 b- цепями) и множество контактов между a- и b- цепями. В образовании таких контактов принимают участие в основном гидрофобные R- группы аминокислотных остатков.
При присоединении к гемоглобину кислорода расстояние между 2 b- цепями гемоглобина уменьшается и изменяется четвертичная структура. Таким образом, гемоглобин и оксигемоглобин (насыщенный кислородом) различаются по своей четвертичной структуре.
Четвертичная структура олигомерных белков также определяется первичной аминокислотной последовательностью входящих в их состав отдельных полипептидных цепей. Олигомерные белки (гемоглобин) обнаруживают способность к самосборке.
Главное отличие гемоглобина от миоглобина заключается в проявлении особого рода эффектов — кооперативных, влияющих на скорости присоединения- отсоединения молекул кислорода. Каждая молекула гемоглобина способна присоединять и переносить четыре молекулы кислорода, при этом кооперативность проявляется в том, что как присоединение, так и отсоединение каждой последующей молекулы кислорода облегчается в результате структурных изменений в конформации молекулы, которых у гемоглобина имеется две основных- оксигенированная и дезоксигенированная. Промежуточные состояния нестабильны. Предполагается следующий механизм кооперативного эффекта.
исоединение первой молекулы кислорода приводит к тому, что атом железа смещается от своего места примерно на 0,4-0,6 ангстрем, вызывая изменения конформации субъединицы. Изменившаяся конформация по аллостерическому эффекту облегчает присоединение кислорода к другой субъединице и т.д. Это позволяет максимально ускорить процесс присоединения кислорода в легких (рО2 = 100 мм рт. ст.). При переносе оксигенированного гемоглобина в капилляры тканей (рО2 = 5 мм рт. ст.) отсоединение молекул кислорода протекает также быстро, по кооперативному эффекту. Известны, впрочем, и химические регуляторы скорости и полноты присоединения кислорода. К ним, в частности, относится 2,3- дифосфоглицериновая кислота. Она облегчает присоединение кислорода у организмов, обитающих в высокогорных районах.
Источник: studopedia.ru
3.1. Биологические функции белков.
Белки служат для запасания (примером является миоглобин) и переноса (гемоглобин) кислорода. Эта функция белков сходна с ферментативной, но отличается от нее тем, что молекулярный кислород не испытывает превращений в этих процессах. Специализированные белки высших организмов — гаммаглобулины — защищают организм от чужеродных биополимеров, выполняя тем самым иммунологическую функцию. Специальные (фибриллярные) белки входят в состав кожи, костей, волос, сухожилий и выполняют опорную функцию, обеспечивая не жесткую, но надежную взаимосвязь органов, а также их механическую целостность и защиту.
Реакция организма на большинство внешних воздействий любой природы сводится к перекодированию внешних сигналов на язык белковых взаимодействий.
3.2. Основные задачи биофизики белка
- Теоретические и экспериментальные исследования белковых молекул, а также надмолекулярных систем, которые ими образованы.
- Установление связей первичной структуры белка, т.е. последовательности аминокислотных остатков, и пространственного строения молекул белков.
- Изучение физических механизмов биосинтеза белка.
- Исследование физических процессов, лежащих в основе биологических функций белков.
3.3. Конформация полипептидной цепи.
Рассмотрим структуру пептидной связи.

Особенностью связи является то, что 4 атома N,H,C,O располагаются в одной плоскости (обведенная область на рисунке). Из химии известно, что вращение в молекуле вокруг ординарной связи приводит к появлению поворотных изомеров.
В белках вращение вокруг пептидной связи C-N затруднено (энергия активации 40 — 80 кДж/моль), т.к. эта связь имеет характер двойной связи и, кроме того, в пептидной группе имеет место водородная связь между группой С=O и атомом водорода группы N-H (с энергией активации 20-30 кДж/моль).

Поэтому белок можно рассматривать как цепь связанных друг с другом плоских пептидных звеньев. Вращение этих звеньев возможно лишь вокруг одинарных связей  -углерода и аминокислот (см. рис).
-углерода и аминокислот (см. рис).

Угол поворота вокруг связи С-С обозначается , вокруг cвязи С-N обозначается .
Нахождение наиболее устойчивой конформации белковой цепи требует минимизации ее полной энергии, включая энергию внутримолекулярных водородных связей. Полинг и Кюри установили 2 основных варианта структуры белковой цепи, которые называются -спираль и  -форма.
-форма.
| -спираль | -форма |
 |
 |
Рис.3.1. Ориентация водородных связей в структуре белка.
-спираль может быть правозакрученной ( =132 о ,
=132 о ,  =123 о ) и левозакрученной (=228 о , =237 о ). -формы бывают параллельные (=61 о , =239 о ) и антипараллельные (=380 о , =325 о ).
=123 о ) и левозакрученной (=228 о , =237 о ). -формы бывают параллельные (=61 о , =239 о ) и антипараллельные (=380 о , =325 о ).
Кроме того, в белках встречаются участки, не образующие никакой регулярной структуры. Например, в гемоглобине 75% аминокислот образуют правозакрученные -спирали, а остальные участки цепи вообще никак не упорядочены. Упорядоченные участки часто называют кристаллической частью белковой молекулы, а неупорядоченные участки — аморфной формой белка.
Аморфные участки — депо строительного материала, который в случае необходимости используется для построения упорядоченных участков.
3.4. Структура воды и гидрофобные взаимодействия.
Рассмотрим свойства воды более подробно. Молекула воды является диполем из-за своей асимметрии. В водном растворе атом О2 располагается как бы в центре тетраэдра, в двух вершинах которого находятся атомы Н.

Рис. 3.2. Тетраэдрические свойства полностью координированной воды.
Две пары электронов кислорода, не участвующие в образовании валентной связи, находятся на вытянутых орбиталях, оси которых направлены к двум вершинам тетраэдра. Эти электронные пары несут отрицательный заряд и притягивают атомы водорода двух соседних молекул, то есть образуют водородные связи. Благодаря этим взаимодействиям в жидкой воде формируются ассоциации молекул, называемые кластерами. Структура кластеров сходна со структурой льда. Однако эта кристаллическая решетка отличается определенной "рыхлостью" ( именно этим объясняется невысокая плотность льда). Вместе с тем, даже после полного таяния льда в жидкой фазе воды сохраняются льдоподобные структуры — кластеры (расчеты показывают, что если бы их не было, то плотность жидкой воды была бы =1.8 г/мл, вместо 1.0 г/мл). Наличие в воде кластеров подтверждается данными рентгенографических исследований. Между неструктурированной водой и кластерами постоянно осуществляется обмен молекулами, так что в среднем время жизни кластера составляет 10 -10 с. При 20 о С в воде доля несвязанных в кластеры молекул составляет 29.5%. С увеличением температуры средний размер кластера уменьшается, и доля несвязанных молекул возрастает (именно плавлением кластеров объясняется аномально высокая теплоемкость воды).
В воде хорошо растворяются такие органические соединения, которые содержат полярные группы и способны вступать в диполь-дипольное взаимодействие с молекулами воды или образовывать с ними водородные связи. Такими, в частности, являются группы:

Напротив, неполярные соединения плохо растворимы в воде. Физические причины этих явлений были выяснены после измерения термодинамических параметров процессов растворения. Было установлено, что в случае плохой растворимости углеводорода в воде изменение свободной энергии положительно, и, следовательно, энтропия системы уменьшается.

Что же означает уменьшение энтропии при растворении?
Прямыми физическими исследованиями было показано, что при этом происходит увеличение доли кластеров. При растворении молекулы углеводов втискиваются в полости внутри тетраэдрических ячеек кластеров и вытесняют оттуда неструктурированную воду. Последняя образует новые кластеры, и упорядоченность системы увеличивается, а значит, энтропия уменьшается. Поэтому гидрофобные взаимодействия являются результатом свойств воды, а не каких-то особых сил, связывающих неполярные группы друг с другом. Таким образом, ассоциация неполярных молекул в воде за счет гидрофобных взаимодействий определяется выталкивающим действием воды на неполярные соединения, что обусловлено тенденцией молекул воды к достижению состояния максимальной неупорядоченности.
3.5. Гидрофобные взаимодействия и структуры белков.
Степень гидрофобности остатка определяют по разности свободных энергий растворения аминокислоты в слабополярном растворителе и воде (обычно используют этиловый спирт).
Полученные таким образом величины разностей свободных энергий, приходящихся на белковую группу аминокислоты при переносе из спирта в воду, приведены в таблице:
Гидрофобные  F кДж/моль F кДж/моль |
Три | Иле | Тир | Фен | Про |
| 12.50 | 12.40 | 12.00 | 11.10 | 10.85 | |
| Гидрофобные F кДж/моль |
Лей | Вал | Лиз | Гис | Нет |
| 10.10 | 7.06 | 6.27 | 5.85 | 5.45 | |
| Гидрофильные F кДж/моль |
Ала | Арг | Цис | Глу | Асп |
| 3.05 | 3.05 | 2.71 | 2.50 | 2.26 | |
| Гидрофильные F кДж/моль |
Тре | Сер | Гли | Асн | Глн |
| 1.84 | 0.17 | 0.00 | -0.04 | -0.42 |
Названия остатков: глицил, аланил, валил, лейцил, изолейцил (иле), фенилаланил (фен), пролил, тритофонил (три), серил (сер), треонил (тре), метионил (мет), аспарагинил (асп), глутаминил (глн), цистинил, аспаргил, глутамил (глу), тирозил, гистидил (гис), лизил (лиз), аргинил (арг).
Гипотеза об определяющей роли гидрофобных взаимодействий была доказана в 1944 году. Идея состояла в том, что гибкая молекула белка в воде сворачивается в глобулу (поскольку полярные остатки белка стремятся к максимальному контакту с водным окружением, а неполярные — к минимальному контакту). Из геометрии известно, что минимальной поверхностью при заданном объеме обладает шар. Стремление неполярных остатков образовать внутри белковой части некое подобие шарообразной капли, а полярных — сосредоточиться на ее поверхности, и приводит к образованию компактного тела — глобулы с гидрофобным ядром и гидрофильной поверхностью.

1 — гидрофобное ядро
2 — гидрофильная оболочка
В 1964 году Фишер установил, что, зная общее число аминокислотных остатков в ядре и отношение полярных остатков к неполярным, можно предсказать форму глобулы. Для простоты будем считать, что все остатки имеют одинаковые объемы. Найдем отношение числа полярных остатков к неполярным, которое обозначим bs. Будем считать , что радиус глобулы r, и глобула покрыта мономолекулярным слоем полярных остатков толщиной d (Фишер считал, что d
4-5A). При сделанных допущениях отношение числа полярных и неполярных остатков равно отношению объемов сферического слоя и центрального ядра:

Следовательно, чем меньше r, тем больше должна быть относительная гидрофильность белка. На рисунке приведена теоретическая кривая (кривая Фишера) значений параметра b от объема глобулы (V=4/3r 3 ), а также экспериментальные значения.

Глобула может быть сферической, строго говоря, лишь при b=bs (соответствует кривой Фишера на графике). Если b>bs, то есть число полярных остатков в белке больше, чем необходимо для того, чтобы покрыть гидрофобное ядро гидрофильным слоем, то глобула вытягивается в виде эллипсоида и имеет большую поверхность, чем в случае сферы.

b>>bsвозникают фибриллярные структуры ( обозначено x на графике)

Таким образом, белки, для которых значения b лежат выше кривой Фишера, представляют собой эллипсоиды и фибриллы, значения лежат на кривой представляют собой глобулы. Под кривой располагаются белки, образующие надмолекулярную структуру. Формирование гидрофобного ядра в глобулярных белках имеет принципиальное значение для их функционирования. Белки при их огромной молекулярной массе обладают сравнительно компактной структурой прежде всего, благодаря гидрофобным взаимодействиям.
3.6. Связывание лигандов с макромолекулами.
Образование комплексов между малой молекулой (ионом, матаболитом, гормоном), именуемой лигандом L, и центрами связывания лиганда на макромолекуле М лежит в основе функционирования многих биополимеров. Образование комплекса ML можно рассматривать как кинетическую реакцию, константа равновесия которой равна К.
 |
(1), |
 |
(2) |
Обозначим через r концентрацию связанного лиганда, через с — концентрацию свободного лиганда в растворе, через N — концентрацию центров связывания лигандов на макромолекуле. Тогда концентрация незанятых лигандами центров связывания будет равна: 
В этих обозначениях выражение для константы равновесия:
 |
(3) |
При заполнении половины центров связывания из уравнения получаем:
 , ,  |
(4) |
Таким образом, k обратно пропорционально концентрации свободного лиганда в условиях 50% заполнения центров связывания.
На рисунке представлены данные по насыщению кислородом миоглобина и различных гемоглобинов человека. При построении графика удобно пользоваться не концентрацией О2, а его парциальным давлением (Y — степень связывания).

Кривые насыщения О2
2 — фитального гемоглобина
3 — нормального гемоглобина
4 — гемоглобина, больного серповидной анемией
 , ,  |
(5) |
Уравнение для кривой связывания можно получить, если решить уравнение (3) относительно r. Тогда получим уравнение (5). С увеличением концентрации лиганда доля занятых центров r стремиться к N. Из рисунка видно, что только связывание кислорода с миоглобином описывается гиперболой, а связывание с гемоглобином описывается S — образной зависимостью, которая обусловлена взаимодействием центров связывания между собой в процессе связывания.
В 1909 году Хиллом была предложена модель связывания кислорода с гемоглобином, которая описывает экспериментальные данные. Согласно этой модели центры связывания кислорода на молекулах гемоглобина не являются независимыми. А именно присоединение одной молекулы кислорода к одному из центров увеличивает сродство к кислороду других центров, а связывание двух молекул кислорода ещё более облегчает связывание с третьей. Такое связывание, при котором константы связывания идентичных центров изменяются по мере их заполнения, называется кооперативным связыванием. Хилл рассмотрел модель максимальной кооперативности, т.е. случай, когда связывание одного лиганда настолько увеличивает сродство остальных центров, что они заполняются почти мгновенно. Это значит, что в равновесном растворе лиганда N и макромолекулы, имеющих n идентичных центров связывания, присутствуют либо макромолекулы с незанятыми центрами связывания, либо комплексы лиганда с макромолекулой, у которых все центры связывания заполнены. Таким образом, модель максимальной кооперативности практически означает протекание такого кинетического процесса:
 |
(6) |
В последнем выражении [M], [Ln], [N] — концентрации комплексов, свободного лиганда и свободных центров связывания. Степень насыщения центров связывания Y определяется как отношение концентрации связанных макромолекул к общей концентрации макромолекул в растворе.
 Уравнение Хилла
Уравнение Хилла
Хотя это уравнение выведено для случая полной кооперативности, графиком Хилла пользуются и для анализа процессов, кооперативность которых не является полной. В этом случае кооперативность характеризуется коэффициентом Хилла h, который равен максимальному тангенсу наклона.
График Хилла для насыщенного гемоглобином кислорода:

Связывание кислорода с гемоглобином, имеющим 4 центра связи, характеризуется параметром Хилла h=2,9. Уравнение хорошо описывает связывание от 10 до 80% насыщения углеродом (прямолинейный участок на последнем графике). По коэффициенту Хилла судят о степени кооперативности процесса. Если h=1, то кооперативность отсутствует (как у миоглобина), если h

Уменьшение спина приводит к уменьшению ионного радиуса, и его структура становится более компактной. В результате происходит более плотная упаковка макромолекулы Нb(O2)4, в процессе которой затрачивается длинный фрагмент макромолекулы оксигенированного гемоглобина. Механизм оксигенации гемоглобина является примером электронно-конформационных взаимодействий (ЭКВ), характерных для большинства биополимеров. Суть концепции ЭКВ состоит в том, что в макромолекулах осуществляется сопряжение электронных процессов с конформационными (структурная перестройка).
3.7.Гемолиз
Среднее время жизни эритроцита 8-120 суток. У здорового человека в одном миллилитре
4-5 миллионов эритроцитов.
Типы гемолиза: осмотический; сдвиговый; поверхностный; механический
Краткая аннотация к перечисленным типам гемолиза.
- Осмотический гемозиз происходит если перепад осмотических давлений внутри и снаружи эритроцита превышает предел прочности мембраны на разрыв (локальная интоксикация, перенос в дисстиллят).
- Эритроцит в сдвиговом потоке испытывает вращающий и изгибающий моменты. Если механические напряжения превышают предел прочности, то происходит разрыв. (В районе клапанов скорость сдвига крови наибольшая).


- Искусственные материалы на своей поверхности адгезируют эритроциты. В пристеночных областях наибольшая скорость сдвига крови, и прилипший к стенке эритроцит деформируется и может быть разрушен.
- Механический гемолиз связан с механическим воздействием, как правило, со стороны инородных материалов и конструкций (искусственные клапаны, искусственные желудочки сердца в аппаратах ИС и ВК и т.д.). Он характерен для экстракорпоральных систем и определяется прямым механическим воздействием на мембрану эритроцита. Степень гемолиза определяется не только величиной механического воздействия, но и его длительностью.
changesconstructionchanpurbdchaozworldchapter7and13charge satcharlesterhunecharlestonforu
Миоглобин- сложный белок третьего уровня структурной организации. Состоит из одной полипептидной цепи (153 остатка). Третичная структура белка образована, главным образом, альфа-спиралями вторичной структуры, на которые приходится около 70 процентов АКО, остальные- на повороты и начальный и конечный участки. Белок содержит в себе так называемый ГЕМ- комплекс порфирина и иона железа в степени окисления +2.
   |
Ион железа встроен в кольцо порфирина таким образом, что четыре координационные связи из шести (в состоянии гибридизации sp3d2 связи у шестикоординационного железа направлены к вершинам октаэдра) затрачены на образование связей с атомами азота, еще одна связана с азотом имидазольного остатка ГИС полипептидной цепи (проксимальный Гистидин F8 ), а другая- также с имидазольным остатком другого ГИС (дистальный ГИС Е7). Молекула кислорода присоединяется между остатком дистального ГИС и железом. Изменения степени окисления железа при этом не происходит . Порфириновое кольцо (ГЕМ) не находится на плоскости молекулы белка, а частично погружено в него. Молекула кислорода присоединяется к гему, входя как бы через открывающуюся дверцу. Пока остается несным, дожидается молекула кислорода случайного открывания двери, или существует какой-то механизм, пускающий кислород к гему.
Миоглобин сосредоточен, главным образом, в мышцах и его главной функцией является хранение кислорода. Скорость насыщения миоглобина кислородом намного превышает таковую для гемоглобина. Миоглобин мало приспособлен для транспортировки кислорода из легких в ткани, поскольку скорость отдачи кислорода в тканях невелика (при давлении 1 мм рт. ст. примерно половина миоглобина все еще не отдает кислород).

Вопросы транспортировки кислорода решаются при участии белка четвертичной структуры- гемоглобина.
Гемоглобин представляет собой белок четвертичной структуры, состоящий из двух пар субъединиц альфа — (141 АКО) и бетта- (147 АКО- аминокислотных остатков). Субъединицы миоглобина и гемоглобина очень сходны между собой, как весьма сходна и третичная структура обоих белков.
Главное отличие гемоглобина от миоглобина заключается в проявлении особого рода эффектов- кооперативных, влияющих на скорости присоединения- отсоединения молекул кислорода. Каждая молекула гемоглобина способна присоединять и переносить четыре молекулы кислорода, при этом кооперативность проявляется в том, что как присоединение, так и отсоединение каждой последующей молекулы кислорода облегчается в результате структурных изменений в конформации молекулы, которых у гемоглобина имеется две основных- оксигенированная и дезоксигенированная. Промежуточные состояния нестабильны. Предполагается следующий механизм кооперативного эффекта. Присоединение первой молекулы кислорода приводит тому что атом железа смещается от своего места примерно на 0,4-0,6 ангстрем, вызывая изменения конформации субъединицы. Изменившаяся конформация по аллостерическому эффекту облегчает присоединение кислорода к другой субъединице и т.д. Это позволяет максимально ускорить процесс присоединения кислорода в легких (рО 2 = 100 мм рт. ст.). При переносе оксигенированного гемоглобина в капилляры тканей (рО 2 = 5 мм рт. ст.) отсоединение молекул кислорода протекает также быстро, по кооперативному эффекту. Известны , впрочем, и химические регуляторы скорости и полноты присоединения кислорода. К ним, в частности, относится 2,3- дифосфоглицериновая кислота. Она облегчает присоединение кислорода у организмов, обитающих в высокогорных районах.
ОКСИГЕМОГЛОБИН (HbO 2 ) — полностью оксигенированный гемоглобин, содержащий 4 молекулы О 2 . Из шести sp 3 d 2 гибридизованных орбиталей Fe 2+ ЧЕТЫРЕ связаны в комплексе с порфирином, ОДНА- с остатком His (внутрь молекулы), а ОДНА свободная- присоединяет О 2 или ПУСТА (дезокси-Нb ).
Hb-NH 2 + CO 2 —> Hb-NH-COO- + H+ (с N- концевыми остатками ПП-цепей).
Таким образом транспортируется только 32 % СО 2 , 60 % СО 2 — с венозной кровью, после превращения СО 2 в Н 2 СО 3 при помощи КАРБОАНГИДРАЗЫ, и лишь около 8 % транспортируется в эритроцитах в виде НСО 3 _ .
КАРБОКСИГЕМОГЛОБИН (HbCO ) — образуется в результате присоединения к гемоглобину окиси углерода СО, образуя светочувствительный НbСО синего цвета. Поскольку присоединение СО протекает в 200 раз быстрее, чем присоединение кислорода, достаточно незначительных концентраций СО в атмосфере, чтобы вызвать превращение значительной доли гемоглобина в HbCO. Смерть наступает при связывании >70 % Н b . Для снятия эффекта требуется увеличение парциального давления кислорода во вдыхаемом воздухе.
МЕТГЕМОГЛОБИН (Met-Hb ). Пероксиды, феррицианиды, окислы азота и хинон окисляют железо в геме до Fe3+, при этом нарушается транспорт О 2 и СО 2 . Однако, это нарушение обратимо и менее опасно, чем НbСО , поскольку железо легко превращается ферментами обратно в Fe2+.
1. Транспорт О 2 и СО 2 .
2. Создание буферной емкости крови и поддержание рН в строго определенных пределах (7,40+0,02).
Серповидноклеточная анемия— патология, вызванная наличием аномального гемоглобина, с измененной структурой белка глобина, а точнее- его b — цепи. Происходит это вследствие замены в мРНК кодона ГАГ (кодирует Глутаминовую кислоту ) на ГУГ (кодирует аминокислоту Валин ). В результате получается гемоглобин S , называемый HbS , с измененными свойствами зарядов на поверхности. Поскольку замена остатка глутаминовой кислоты по положению 6 в b — цепи на остаток с гидрофобным незаряженным боковым радикалом валина приводит к утрате отрицательного заряда и слипанию молекул гемоглобина, форма эритроцитов становится похожей на серп при рассматривании под микроскопом. Деформированные эритроциты отличаются плохой способностью присоединять кислород и проникать в тончайшие капилляры , что вызывает в ряде случаев кислородное голодание тканей.
Мутация является типичным примером эволюционного приспособления организма к возбудителям малярии. Гемоглобин S наиболее часто обнаруживается у выходцев из экваториальной Африки, где малярия широко распространена. Гетерозиготные по гемоглобину S люди невосприимчивы к малярии и к тому же у них не проявляются симптомы кислородного голодания, обнаруживаемые у гомозигот. Возбудитель малярии не выживает в эритроцитах, содержащих гемоглобин S.
Симптомы заболевания, вызываемое аномальным гемоглобином S, были впервые описаны в Чикаго в 1904 году при осмотре негра-выходца из Африки, однако причина болезни была установлена многими годами позднее. Впоследствии было выявлено множество других аномальных гемоглобинов, вызываемых заменой аминокислотных остатков. Подавляющее большинство из них, впрочем, никак не проявляется на состоянии человека. Аномальные гемоглобины получают название по замене аминокислотных остатков и местности, где аномалия впервые была обнаружена. Так, гемоглобин S еще имеет название Чикаго b -6 Глу—>Вал.
Клиническая диагностика осуществляется процедурой Southern Blot . Ген, кодирующий бетта-цепь нормального глобина, имеющего последовательность аминокислотных остатков 5-7 ( Про-Глу-Глу ) несет соответствующие триплеты кодонов ЦЦТ-ГАГ-ГАГ. У носящих дефектный ген эта последовательность имеет замену аденозинового нуклеотида (А) в среднем триплете на тимидиловый (Т). Рестрикционный энзим MstII узнает и расщепляет последовательность ЦЦТ-ГАГ-Г, но не узнает измененной последовательности в мутировавшей ДНК. Соответственно, обработка ДНК рестриктазой MstII с последующим анализом может обнаружить эти различия и выявить патологию еще до рождения плода, у эмбриона.
Гемоглобин выполняет, в организме важную роль переносчика кислорода и принимает участие в транспорте углекислоты. Гемоглобин представляет собой сложное химическое соединение (молекулярный вес 68 800). Он состоит из белка глобина и четырех молекул гема. Молекула гема, содержащая атом железа, обладает способностью соединять и отдавать молекулу кислорода. При этом валентность железа, к которому присоединяется кислород, не изменяется, т. е. железо остается двухвалентным.
Если обработать гемоглобин раствором соляной кислоты, то от глобина отщепляется гем. Вступая в соединение с соляной кислотой, он превращается в гемин (С 34 Н 32 N 4 O 4 FeCl), образующий кристаллы характерной формы. Проба на образование гемина производится для доказательства присутствия крови при судебномедицинских исследованиях.
В состав молекулы гема входят четыре пиррольных кольца (два из них имеют характер щелочи, а два — кислоты). Атом железа, содержащийся в геме, связывает гем с белковой частью глобином. Если гем теряет атом железа, а пирроловая его структура сохраняется, то получается гематопорфирин. Это вещество в больших количествах образуется в организме при некоторых отравлениях или нарушениях обмена и может выделяться с мочой.
Гем является активной, или так называемой простатической, группой гемоглобина, а глобин — белковым носителем гема. Гемоглобин, присоединивший кислород, превращается в оксигемоглобин (его обозначают символом НbO 2 ). Оксигемоглобин, отдавший кислород, называется восстановленным, или редуцированным, гемоглобином (Нb). Оксигемоглобин, гемоглобин и некоторые другие соединения и производные гемоглобина дают характерные полосы поглощения лучей спектра.
 |
Так, пропуская луч света через раствор оксигемоглобина, можно обнаружить две характерные темные полосы поглощения в желто-зеленой части спектра, между фрауэнгоферовыми линиями D и Е. Для восстановленного гемоглобина характерна одна широкая полоса поглощения в желто-зеленой части спектра ( рис. 5 ).
Рис. 5. Спектры поглощения оксигемоглобина (сверху) и гемоглобина.
Оксигемоглобин несколько отличается по цвету от гемоглобина, поэтому артериальная кровь, содержащая оксигемоглобин, имеет ярко-алый цвет, притом тем более яркий, чем полнее произошло ее насыщение кислородом. Венозная кровь, содержащая большое количество восстановленного гемоглобина, имеет темно-вишневый цвет.
Значительно большее поглощение световых лучей с длиной волны 620—680 ммк гемоглобином по сравнению с оксигемоглобином легло в основу методики измерения степени насыщения крови кислородом — оксигемометрии. При этой методике ушную раковину или кювету с кровью просвечивают небольшой электрической лампой и определяют с помощью фотоэлемента интенсивность светового потока указанной длины волны, проходящего через ткань уха или кювету с кровью. По показаниям фотоэлемента определяют степень насыщения гемоглобина кислородом.
Кровь взрослых людей содержит в среднем 14—15% гемоглобина (у мужчин 13,5—16%, у женщин 12,5—14,5%). Общее содержание гемоглобина равно примерно 700 г.
В эмбриональном периоде в крови человека имеются разные типы гемоглобина, отличающиеся способностью присоединять кислород в некоторыми другими химическими свойствами. Для определения и разделения разных типов гемоглобина применяют методику измерения оптической плотности растворов гемоглобина до и после денатурации его едкой щелочью. Разные типа гемоглобина условно обозначают НbA, HbF, НbР, Гемоглобин НbР встречается только в первые 7—12 недель внутриутробного развития зародыша. На 9-й неделе появляется в крови зародыша гемоглобин HbF и гемоглобин взрослых НbA. Существенно важным представляется тот факт, что эмбриональный гемоглобин HbF обладает более высоким сродством к кислороду и может насыщаться на 60% при таком напряжении кислорода, когда гемоглобин матери насыщается всего на 30%. У разных видов позвоночных животных имеются различия в структуре гемоглобина. Гем разных типов гемоглобина при этом одинаков, глобины же различаются по своему аминокислотному составу.
В организме постоянно происходит синтез и распад гемоглобина, связанные с образованием и разрушением эритроцитов. Синтез гемоглобина совершается в эритробластах красного костного мозга. При разрушении эритроцитов, которое происходит в ретикуло-эндотелиальной системе, главным образом в печени и селезенке, из красных кровяных клеток выходит гемоглобин. В результате отщепления железа от гема и последующего окисления образуется из гемоглобина пигмент билирубин, который затем с желчью выделяется в кишечник, где превращается в стеркобилин и уробилин, которые выводятся с калом и мочой. За сутки разрушается и превращается в желчные пигменты около 8 г гемоглобина, т. е. несколько более 1 %.
В организме человека и животных могут образовываться и другие соединения гемоглобина, при спектральном анализе которых обнаруживаются характерные спектры поглощения. К числу таких соединений гемоглобина относятся метгемоглобин и карбокенгемоглобин. Вещества эти образуются в результате некоторых отравлений.
Метгемоглобин (MetHb) представляет собой прочное соединение гемоглобина с кислородом; при образовании метгемоглобина меняется валентность железа: двухвалентное железо, входящее в молекулу гемоглобина, превращается в трехвалентное. В случае накопления в крови больших количеств метгемоглобина отдача кислорода тканям становится невозможной и наступает смерть от удушення.
Метгемоглобин отличается от гемоглобина коричневым цветом и наличием полосы поглощения в красной части спектра. Метгемоглобин образуется при действии сильных окислителей: феррицианида (красной кровяной соли), марганцовокислого калия, амил- и пропилнитрита, анилина, бертолетовой соли, фенацетина.
Карбоксигемоглобин (НbСО) представляет собой соединение железа гемоглобина с окисью углерода (СО) — угарным газом. Это соединение примерно в 150—300 раз прочнее, чем соединение гемоглобина с кислородом. Поэтому примесь даже 0,1 % угарного газа во вдыхаемом воздухе ведет к тому, что 80% гемоглобина оказываются связанными окисью углерода и не присоединяют кислород, что является опасным для жизни.
Слабое отравление угарным газом — обратимый процесс. Прп дыхании свежим воздухом СО постепенно отщепляется от карбоксигемоглобнна и выделяется.
Вдыхание чистого кислорода увеличивает скорость расщепления карбоксигемоглобина в 20 раз. В тяжелых случаях отравления необходимо искусственное дыхание (стр. 171) газовой смесью с 95% содержания 02 и 5% СО2, а также переливание крови.
Миоглобин . В скелетной и сердечной мышце находится мышечный гемоглобин, называемый миоглобином. Его простетическая группа — гем — идентична этой же группе молекулы гемоглобина, а белковая часть — глобин — обладает меньшим молекулярным весом, чем белок гемоглобина.
Миоглобин человека способен связывать до 14% от общего количества кислорода в организме. Это его свойство играет важную роль в снабжении кислородом работающих мышц. Если при сокращении мышцы кровеносные капилляры ее сжимаются и кровоток в некоторых участках мышцы прекращается, то все же благодаря наличию кислорода, связанного с миоглобином, в течение некоторого времепп сохраняется снабжение мышечных волокон кислородом.
Источник: volgograd-vrachi.ru
Источник: www.chem21.info
