Это направление хирургического лечения нарушений ритма. Сюда относят ряд методов, при которых очаг аритмии (патологические проводящие пути) разрушают (то есть, проводят его деструкцию) нагреванием с помощью воздействия электрическим током[1].
Суть метода[править | править код]
Радиочасто́тная кате́терная абляция (РЧА)[2] была внедрена в начале 1980-х годов и стала методом выбора для лечения аритмий (Синдрома WPW, Мерцательных аритмий). Радиочастотная катетерная абляция заменила многие хирургические операции на открытом сердце при лечении ряда видов аритмий и стала признанной альтернативой лекарственной терапии.
Суть операции[править | править код]
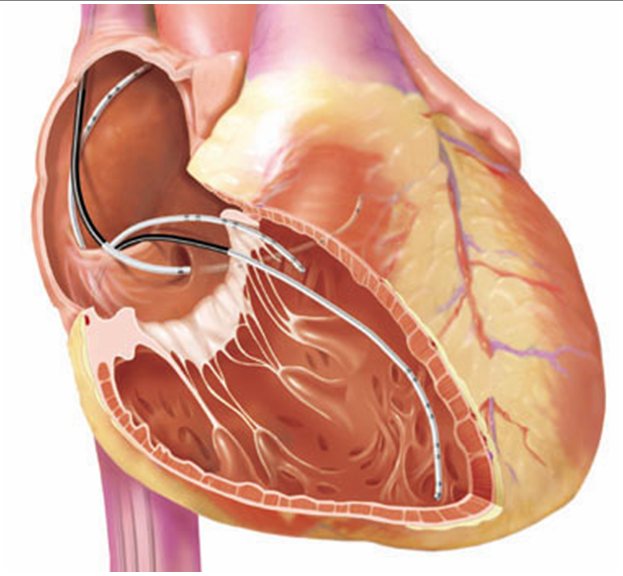
Операция обычно проводятся под местной анестезией. Пациенту пунктируют (прокалывают) бедренную вену либо артерию (зависит от отделов сердца на которых планируется вмешательство), подключичную вену. Это совершенно безболезненно, так как места пункций обрабатываются анестетиком. Через эти проколы с помощью специальных трубочек (интродьюсеров) под рентгеноскопическим контролем вводят электроды в полость сердца. Операцию может проводить врач-хирург и несколько ассистентов.
Первым этапом выполняют электрофизиологическое исследование (ЭФИ) сердца для обнаружения аритмогенных зон (дополнительных предсердно-желудочковых соединений, эктопии и т.п.). В процессе ЭФИ сердца электродов катетеров регистрируется внутрисердечная кардиограмма, которая передается на монитор компьютера, проводятся специальные тесты на провоцирование аритмий. При этом пациент может ощущать дискомфорт в грудной клетке, сердцебиения, небольшую болезненность. Бояться перебоев сердца, секундных остановок, ускорения или замедления ритма в этот момент не стоит, так как с помощью электрических импульсов, подаваемых непосредственно в сердце, врач полностью контролирует сердцебиение, провоцируя приступ тахикардии или прекращая его во время поиска аритмогенных участков.
При манипуляции катетером врачу требуется визуализация его положения в сердце по отношению к другим структурам. Ранее хирургам был доступен только рентгеноскопический метод визуализации катетеров[3].
Проблематичность ориентации катетера с использованием одно- или двухмерного изображения, получаемого при флюороскопии (рентгеноскопии) с применением традиционных технологий картирования представляют трудности для абляции ряда форм предсердных и желудочковых аритмий[4] [5] [6] [7] [8].
новным ограничением ныне существующих методов картирования является невозможность точного сопоставления данных интракардиальных электрограмм и пространственной анатомической ориентации катетера в режиме реального времени[5] [6] [7] [8] [9] [10] [11] [12]. Определение пространственного расположения зон сердца, из которых ведется регистрация электрограмм, страдает большой погрешностью и связана с большой дозой рентгеновского облучения, как пациента, так и медперсонала. Длительная лучевая экспозиция является фактором риска развития «радиационных» осложнений в отдаленном послеоперационном периоде (рентгеновское излучение является ионизирующим).[13]
Современные технологии электроанатомического картирования, которые объединяют анатомическую и электрофизиологическую информацию, позволяют хирургам создать трехмерную карту интересующей камеры сердца.[3]
Возможность комбинации трехмерной анатомической реконструкции камер сердца с изучением их электрической активности позволяет оценить роль тех или иных анатомических структур в генезе аритмий — это принципиально важно при эффективном проведении процедур катетерной абляции. Возможность управления катетером без помощи рентгена значительно уменьшает время рентгеновского облучения и общее время процедуры. [13]
В данное время в клинической практике широко используются несколько электрофизиологических нефлюороскопических навигационных систем:
- CARTO 3 (Biosense Webster, Израиль)
- Ensite Precision (St. Jude Medical, США)
- Rhythmia (Boston Scientific, США)[14][15][16]
Как только врач определился с аритмогенной зоной, на неё воздействуют радиочастотной энергией с помощью «лечебного» абляционного катетера.
сле чего в обязательном порядке (примерно через 20 минут) проводят еще раз ЭФИ для оценки эффективности воздействия. Если электрофизиологические показатели удовлетворяют врача, то операцию заканчивают. Удаляют катетеры. На места пункций накладывают гемостатические (давящие) повязки. Пациенту рекомендуют строгий постельный режим (после окончания операции пролежать на спине, не сгибая ноги в коленях, 12 часов). Это необходимо для предотвращения кровотечений из мест проколов и обеспечения быстрого заживления. Через 12 часов (по решению врача) уже разрешается вставать с кровати.
Осложнения операции[править | править код]
Осложнения при проведении эндо-ЭФИ и РЧА можно разделить на 4 группы:
- осложнения, обусловленные лучевой нагрузкой (примерно 1 миллизиверт)
- осложнения, связанные с пункцией и катетеризацией сосудов (гематома, тромбоз глубоких вен, перфорация артерий, артериовенозная фистула, пневмоторакс);
- осложнения при катетерных манипуляциях (повреждение клапанов сердца, микроэмболия, перфорация коронарного синуса или стенки миокарда, расслоение коронарной артерии, тромбоз);
- осложнения, обусловленные радиочастотным воздействием (атриовентрикулярная блокада, перфорация миокарда, спазм или окклюзия коронарных артерий, транзиторное нарушение мозгового кровообращения).
Данная операция относится к классу малоинвазивной хирургии.
Частота осложнений при катетерной абляции различных тахиаритмий зависит от типа катетерной процедуры.
В современной практике катетерной абляции различных видов тахиаритмий частота серьезных осложнений варьирует от 0,8 до 6,0% в зависимости от типа процедуры и характеристик самого пациента. Применение современных методик нефлюороскопического картирования направлено на уменьшение времени флюороскопии и улучшение визуализации, что позволяет повысить прецизионность абляции и снизить частоту осложнений.
В исследовании, которое выполнили M. Bohnen и соавторы [17], проанализированы 1676 процедур катетерной абляции различных аритмий. Во включенной в исследование когорте большие осложнения развились при проведении 64 (3,8%) процедур. Наименьшая частота осложнений выявлена при абляции наджелудочковых тахикардий – НЖТ (0,8%), наибольшая – при абляции фибрилляции предсердий – ФП (5,2%) и желудочковых тахикардий (ЖТ) в сочетании с органической сердечной патологией (6,0%; p< 0,01)
Cогласно результатам исследования абляции при фибрилляции предсердий в рамках Европейской научно-исследовательской программы (EURObservational Research Programme), в котором были изучены результаты 1391 пациентов из клиник [18], выполняющих не менее 50 абляций в год — частота тяжелых осложнений оказалось следующей: 0,6% для инсульта, 1,3% для тампонады, 1,3% для периферических сосудистых осложнений, и около 2% для перикардита [19] [20] [20] [21]. Сообщалось и о смертельных осложнениях, но крайне редко – менее 0,2% [22].
Где проводят эту операцию[править | править код]
Эта операция проводится во всех крупных медицинских центрах, где есть отделение нарушений ритма сердца. В Москве, Санкт-Петербурге и других крупных городах существует более одного такого центра.
Такие операции проводятся для всех россиян по квоте на высокотехнологичную медицинскую помощь (бесплатно).
В Москве операции по катетерной абляции аритмий проводят в следующих клиниках:
- ФГБУ «НМИЦ КАРДИОЛОГИИ им. А.Л. МЯСНИКОВА»
- ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России
- ФГБУ Институт хирургии им. А.В. Вишневского Минздрава России
- ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России
- ГКБ имени В.М. Буянова
- ФГБУ РНЦХ им. акад. Б.В. Петровского РАМН
В Санкт-Петербурге операции по катетерной абляции аритмий проводят в следующих клиниках:
- ФГБУ ФМИЦ им. В.А. Алмазова Минздрава России
- ФГБВОУ ВПО «Военно-медицинская академия имени С.М. Кирова»
- ФГБУ СПМЦ Минздрава России
- СПБ ГБУЗ «Городская больница №40 Курортного района»
В других городах России операции по катетерной абляции аритмий проводят в следующих клиниках:
- Хабаровск, ФГБУ «Федеральный центр сердечно-сосудистой хирургии»
- Калининград, ФГБУ «ФЦВМТ»
- Новосибирск, ФГБУ «НМИЦ им. ак. Е.Н. Мешалкина» Минздрава России
- Красноярск, ФГБУ «Федеральный центр сердечно-сосудистой хирургии»
- Пермь, ФГБУ «ФЦССХ им. С.Г. Суханова» Минздрава России
- Мурманск, Государственное областное бюджетное учреждение здравоохранения «Мурманская областная клиническая больница имени П. А. Баяндина» (ГОБУЗ «МОКБ им. П. А. Баяндина»)
В СНГ операции по катетерной абляции аритмий проводят в следующих клиниках:
- Казахстан, Астана, АО «Национальный научный медицинский центр»
- Казахстан, Астана, АО «Национальный научный кардиохирургический центр»
- Минск, Беларусь, РНПЦ «Кардиология»
- Ташкент, Узбекистан, «Научно-практический специализированный центр кардиологии»
- Украина, Киев , «Институт сердца»
- Украина, Киев, «Институт сердечно-сосудистой хирургии им. Н.М.Амосова»
См. также[править | править код]
- Автоволны
- Аритмия
- Биофизика сердца
- Малоинвазивная хирургия
- Сердце человека
- Тахикардия
Источник: ru.wikipedia.org
Историческая справка
Несмотря на то, что процедура ЭФИ на сердце начала применяться относительно недавно, сами эксперименты по электрофизиологическим методикам начали применяться еще в конце XVIII века знаменитым врачом Луиджи Гальвани. Он не добился особых результатов, однако на протяжении последующих лет его эксперименты продолжали развивать его ученики и последователи.
Новый виток начинается в 1970-х годах, когда группа ученых вновь открыла интерес к данному методу диагностики. Сейчас все большее количество врачей в своей деятельности пользуются методом ЭФИ сердца.
Суть методики
Сейчас исследования ЭФИ сердца проводится для проведения диагностики проводимости сердечной мышцы и нарушений ритма. В конечном итоге врач может сполна оценить состояние электрической сердечной системы, а с полученными знаниями оптимально подобрать принцип лечения.
Во время проведения ЭФИ сердца различные отделы сердца стимулируются, чтобы выявить имеющиеся нарушения сердечного ритма. Широко применяемые ЭКГ и суточное мониторирование электрокардиографии не позволяют добиться нужного результата в данной ситуации.
В медицине применяется два вида операций ЭФИ на сердце, каждый из которых в свою очередь делится на подвиды.
Инвазивное исследование
Подобное диагностирование проводится исключительно в стационарных условиях и разделяется на 3 подвида в зависимости от того, как ЭФИ сердца делается.
1. Эндокардиальное ЭФИ проводится при стимуляции внутренней оболочки самого сердца — эндокарда. Сама процедура не приводит к болевым ощущениям, поскольку здесь нет рецепторов боли, поэтому не требуется делать наркоз или давать медикаменты больному.
2. Эпикардиальное ЭФИ сердца стимулирует во время процедуры эпикард, поэтому применяется только в случаях операций на открытой сердечной мышце.
3. Комбинированное исследование применяет совместно оба способа.
Инвазивный метод ЭФИ имеет ряд преимуществ перед неинвазивным — в первую очередь подобным способом можно осуществить стимулирование любой из камер сердца, а всего их в теле четыре.
Неинвазивный метод
Данная методика более известна как чреспищеводное ЭФИ сердца или чреспищеводная электростимуляция. Распространена более широко, поскольку не требуется условий стационара. Проводиться процедура может и при простых амбулаторных условиях, поскольку стимулируется всего лишь 2 отдела сердца: левый желудочек и левое предсердие. Во время операции обязательно требуется применять наркоз, поскольку последствия ЭФИ сердца будут не только неприятны, но и весьма болезненны.
Все особенности проведения подобной процедуры обязательно предварительно решаются и обговариваются совместно с пациентом перед непосредственной отправкой. Но при этом всего одна проведенная процедура может полностью открыть картину на неясный диагноз и установить тактику лечения аритмии у больного.
Назначения врача
Из-за современного ритма жизни все чаще люди обращаются к врачам с проблемой аритмии, то есть нарушением сердечного ритма. Стандартно у здорового человека электрические сигналы проходят через сердце однообразно и очень четко. Но при этом повышенное давление, старение, сердечные приступы и многие иные причины могут привести к тому, что постепенно сердце начинает покрываться рубцами или кальциевыми отложениями. Все это сильно препятствует импульсам. Что и ведет к нарушениям сердечного ритма — будет ли это регулярность или последовательность пульса. Подобные нарушения и может выявить ЭФИ сердца.
Основные показания к инвазивной диагностике
В зависимости от методики исследования электрофизиологическая стимуляция сердца требует наличия следующих показаний.
Инвазивный ЭФИ проводится для установления диагноза при подобных сердечных нарушениях:
- мерцательной аритмии и узловой тахикардии, а также иных суправентрикулярных тахикардиях;
- брадиаритмии с приступами МАС;
- любой степени блокады антиовентрикулярной природы;
- пароксизмальной тахикардии желудочков со спонтанной фибрилляцией;
- блокадой Гиса с последующим переходом в блокаду, ведущую к смерти сердца;
- перед проведением операций по установлению кардиостимулятора, при проведении радиочастотной аблации и кардиоверсии.
Основные показания к неинвазивной стимуляции
Для проведения чреспищеводной стимуляции обязательно требуется наличие ряда следующих показаний:
- Частое замедление частоты сердечного пульса.
- Наджелудочковая тахикардия пароксизмальной природы.
- Одновременный синдром брадикардии и тахикардии.
- Решение вопроса о последующей установке кардиостимулятора в случаях, когда лечение медикаментозными препаратами не принесло успеха.
- Оценка эффективности антиаритмической терапии, которой подвергается больной.
Радиочастотная абляция
Для решения проблем с тахикардией, которая проявляется в ускоренном сердцебиении, используется ЭФИ РЧА сердца. Чаще всего это называется прижиганием, поскольку в данном случае полностью уничтожается небольшой участок сердца, в котором формируется патология частотного возбуждения. Тем, кто интересуется, как делается ЭФИ РЧА сердца, следует знать о воздействии на ткань радиочастотных сигналов, которые имеют эффект повреждения. Это препятствует появлению иных путей пульса. Но при этом не вредит нормальному сердцебиению, поэтому сердце продолжает функционировать в естественном состоянии.
Ряд противопоказаний
Несмотря на эффективность процедуры существует ряд противопоказаний, при наличии которых ни в коем случае нельзя проводить ЭФИ. В настоящее время к ним причисляются проблемы с внутренними органами, главным образом сердечно-сосудистые:
- длительная стенокардия на протяжении минимум месяца;
- острый инфаркт миокарда;
- аневризма в сердце или аорте;
- сердечные пороки с наличием сердечной недостаточности;
- тромбоэмболия;
- инсульт — геморрагический или ишемический;
- повышенная температура тела;
- нарушения кровообращения вместе с кардиомиопатией;
- воспаления пищеварительной системы;
- опухоли и стриктуры пищевода.
Предварительная подготовка
Назначение процедуры начинается с обязательного изучения истории болезни. Вся процедура обговаривается с пациентом, поскольку обязательно требуется наличие подписанного согласия. В зависимости от типа процедуры она проводится в стационарных или амбулаторных условиях.
При проведении ее амбулаторно больной обязан прибыть в клинику непосредственно за несколько часов до самой процедуры, поскольку часто требуется провести предварительный анализ крови. Врач в обязательном порядке обязан ознакомить больного с планом питания, однако лучше всего не пить и ничего не есть как минимум за 8 часов до самой процедуры, хотя этот промежуток может быть и дольше.
Также может понадобиться принять ряд лекарственных средств — они назначаются исключительно врачом и предназначаются для сужения сосудов и нормализации сердечного ритма. Может понадобиться прекратить прием некоторых медикаментов за несколько дней до процедуры, поэтому предварительно следует рассказать врачу обо всех препаратах, которые больной принимает для избегания осложнений.
После этого перед процедурой обязательно ставится капельница для седатации и обезболивания. Часто она остается на весь промежуток операции и даже после самого исследования.
Особенности проведения ЭФИ
Согласно отзывам, ЭФИ сердца не является приятной процедурой, но нельзя отрицать, что она позволяет эффективно диагностировать имеющиеся проблемы с нарушениями сердечного ритма.
Для осуществления процедуры инвазивной ЭФИ врач вставляет в кровеносный сосуд, обычно им выступает бедренная вена, тончайшую трубку, называемую катетером. Этот сосуд обязательно должен двигаться к сердечной мышце. Находящийся на катетере электрод периодически позволяет посылать сигналы, но при этом и осуществлять запись собственной электрической активности сердца. Обычно проводится процедура под седацией (легким наркозом), или когда пациент находится в сознании.
Для проведения процедуры требуются условия стационара, поэтому больной ложится в больницу минимум на 2 дня. Сама процедура стандартно не занимает более 45 минут.
Неинвазивное исследование проводится иным методом, поскольку не требуется доступа к сосудам. Сама процедура очень неприятна, поэтому о появившихся неудобствах следует немедленно уведомить врача. Для получения результата предварительно записывается нормальная электрокардиограмма, а затем в рот или нос вставляется зонд с электродом, который постепенно вводится в пищевод. Его останавливают поблизости от сердца, а затем сравнивают полученные результаты.
Подобное ЭФИ может продлиться от часа до четырех часов. Оно может сопровождаться болями в груди или рвотным рефлексом, что сильно осложняет проведение исследования.
Побочные эффекты
Во время проведения операции часто проявляются хоть и не опасные, но неприятные побочные эффекты. К ним относятся:
- Сердечная аритмия, которая часто приводит к сильному головокружению и даже обморокам. Это считается вполне нормальной ситуацией, поэтому врач не прерывает ЭФИ сердца, а просто отправляет небольшой электрический разряд для последующего восстановления сердечного ритма.
- Кровяные сгустки на конце вводимого катетера. Временами они могут отрываться, а потому блокировать другие кровеносные сосуды. Для избегания подобных ситуаций во время ЭФИ вводятся препараты для разжижения крови на основе гепарина.
- В областях, куда непосредственно вводится катетер, могут начать появляться кровоподтеки или кровотечения. Также имеется возможность подхватить инфекцию, поэтому следует внимательно прислушиваться к советам врачей.
Последствия ЭФИ
После непосредственного окончания процедуры больной должен отдыхать в лежачем положении еще от часа до трех часов. Во время этого промежутка отдыха следует соблюдать следующие рекомендации: ни в коем случае не двигаться, пока не разрешит медсестра. Использованную в процедуре конечность следует держать в расслабленном состоянии.
Некоторое время после процедуры за состоянием пациента обязательно следит медсестра, чтобы сразу же выявить появившееся кровотечение или припухлости. После того, как пациент отойдет от наркоза, врач разъясняет результаты полученного исследования, а затем отпускает домой или через день.
Перед выпиской врач также обязательно дает инструкцию по дальнейшему лечению, которую необходимо исполнять. Прием пищи и лекарств обычно разрешается уже через 4 часа после диагностики. К нормальной жизни человек может вернуться уже спустя сутки. В течение нескольких дней место прокола будет неприятно болеть, может появиться синяк или кровоподтек — это вполне нормальное явление.
Возможные осложнения
В некоторых ситуациях обязательно следует вызвать скорую помощь:
- сильное и внезапное усиление припухлости в месте прокола;
- невозможность остановить кровотечение, несмотря на все рекомендации;
- онемение или покалывание конечности, через которую врач проводил исследование;
- рука или нога начинают менять цвет или ощущать холод;
- синяк или кровоподтек начинает становиться больше, распространяясь по разным сторонам;
- на месте прокола имеются выделения, или он отекает.
На самом деле, ЭФИ считается процедурой с малой степенью риска, поэтому осложнения бывают крайне редки. Правильно проведенная процедура с дезинфекцией и всеми аппаратами не приводит к осложнениям, зато позволяет точно установить диагноз. Неприятные ощущения, возникающие при процедуре, перетерпеть вполне возможно, но все же обо всех изменениях необходимо уведомлять врача.
Источник: FB.ru
Показания для электрофизиологического исследования
Чрезпищеводное электрофизиологическое исследование сердца может быть назначено при следующих заболеваниях:
— брадиаритмии, причиной которых является дисфункция синусового узла, — пароксизмальные наджелудочковые тахиаритмии, — синдром тахикардии – брадикардии, вызванный синдромом слабости синусового узла (в основном мерцательная аритмия), — контроль эффективности антиаритмической медикаментозной терапии, — выявление аритмогенного действия (провоцирующего возникновение аритмии) принимаемых лекарств, — определение показаний для установки кардиостимулятора при неэффективности медикаментозной терапии.
Инвазивное электрофизиологическое исследование назначается в ситуациях, когда у пациента имеются сложные нарушения ритма или аритмии, сопровождающиеся выраженными клиническими проявлениями и способные вызвать летальный исход:
— брадиаритмии, сопровождающиеся потерей сознания (приступы МЭС – Морганьи-Эдемса-Стокса), — наджелудочковые тахикардии (мерцательная аритмия, ВПВ – синдром (синдром Вольфа-Паркинсона-Уайта), тахикардии из предсердно – желудочкового соединения – АВ – соединения), — пароксизмальные желудочковые тахикардии различных форм (могут приводить к спонтанному развитию фибрилляции желудочков, что равнозначно внезапной сердечной смерти), — атриовентрикулярные блокады различных степеней, — блокады ножек пучка Гиса (особенно бифасцикулярная – поражение двух ветвей из трех, так как может привести к быстрому развитию трифасцикулярной блокады, а это состояние является жизнеугрожающим и может вызвать внезапную сердечную смерть), — определение показаний к кардиоверсии (восстановлению синусового ритма с помощью кардиовертера – аппарата, способного изменить ритм сердечных сокращений посредством электроимпульсов определенной мощности), к имплантации искусственного кардиостимулятора или к радиочастотной аблации дополнительных путей проведения в сердце при отсутствии эффекта от медикаментозной терапии.
Электрофизиология сердца
Предыдущая | Содержание | следующая Трансмембранный потенциал покоя. В
состоянии покоя внутренняя по верхность мембраны мышечного волокна имеет отрицательный заряд по отношению к наружной. Этот отрицательный внутриклеточный потенци ал, или
потенциал покоя
(ПП), обусловлен различиями концентрации К+, Na + , а также Са2+ во внутри- и внеклеточном пространстве. Концен трация К+ внутри клетки составляет около 140 ммоль/л и значительно превышает его внеклеточную концентрацию (4 ммоль/л), тогда как Na + , наоборот, преобладает во внеклеточной среде (140 против 10 ммоль/л).
Эти градиенты концентраций связаны с различной мембранной прони цаемостью для этих ионов и поддерживаются работой K + — Na + -насоса сарколеммы, который затрачивает энергию для выведения К+ и Na + про тив их электрохимических градиентов. Насос расположен в клеточной мем бране и, возможно, также в Т-трубочках и сопрягает перенос Na + из
клетки с введением внутрь К+. Его движущим механизмом является мем бранная К+— Na + —АТФ-аза, для активации которой необходимы К+, Na + , а также Mg 2+ . Коэффициент сопряжения удаляемых Na + и поступающих К+ может варьировать от 3:3 до 3:3 и 3:1. Чаще всего он равен 3:2, в результате чего работа насоса приводит к возникновению некоторой транс мембранной разности потенциалов.
В состоянии покоя из всех ионов клеточная мембрана наиболее про ницаема для К+, который по градиенту концентрации переходит во вне клеточную среду. Так как он имеет положительный заряд, а белковые анионы остаются в клетке, ее внутренняя поверхность приобретает от рицательный заряд. При этом достигается равновесие между электрическими силами, стремящимися задержать К+ в клетке, и тенденцией к диффузии во внеклеточную среду по градиенту концентрации. Посколь ку мембрана значительно менее проницаема для Na + , диффузия этого иона протекает значительно медленнее, чем К+, в результате чего за ПП несут ответственность преимущественно К+, и его величина при мерно равна калиевому равновесному потенциалу. При расчете равно весного потенциала для этого иона с помощью уравнения Нернста ока залось, что его величина составляет примерно -95 мВ.
ПП клеток сократительного миокарда и проводящей системы сердца составляет от —80 до —90 мВ. Небольшое отличие этой величины от расчетного равновесного потенциала для К+ обусловлено токами утечки дру гих ионов. Определенное значение имеет также коэффициент сопряже ния удаляемых из клетки Na + и транспортируемых внутрь ее Са2+ в Na + — Са2+-обменном механизме, который обычно равен 3:1, что обусловлива ет небольшую деполяризацию внутренней стороны клеточной мембраны.
ПП клеток синоатриального узла и атриовентрикулярного соединения находится в пределах -60 … -70 мВ.
Потенциал действия (ПД).
При стимуляции мышечного волокна под воздействием химического, электрического или механического раздра жителя внутриклеточный электрод регистрирует потенциал действия. Он возникает в результате последовательных, быстро сменяющих друг друга изменений физико-химических свойств клеточной мембраны, которые приводят к нарушению ее проницаемости для различных ионов и их переносу, что вызывает изменения мембранного потенциала (так называе мая ионная гипотеза Hodgkin — Huxley .
ПД состоит из двух основных фаз: деполяризации и реполяризации (рис. 9).
Деполяризация,
или нулевая фаза ПД, характеризуется уменьшением электроотрицательности внутренней поверхности клеточной мембраны до определенного, так называемого порогового, уровня, после чего ее отрицательный потенциал резко уменьшается, стремясь к 0, и в течение доли миллисекунды сменяется на положительный, величиной 10 — 25 мВ (овершут, или реверсия). При этом с наружной стороны мембраны обра зуется такой же величины отрицательный потенциал — импульс воз-
буждения (в остальное время внеклеточная среда нейтральна). Им пульс вызывает деполяризацию соседних возбудимых структур с разви тием цепной реакции — волны возбуждения , которая охватывает миокард.
Для всех волокон миокарда, кроме клеток синоатриального узла и атрио- вентрикулярного соединения, пороговый потенциал составляет от -60 мВ до —70 мВ. В клетках синоатриального и атриовентрикулярного узлов он ра вен -30… -40 мВ.
Быстрая деполяризация внутренней поверхности клеточной мембраны при возникновении ПД в клетках рабочего миокарда и проводящей системы сер дца, подобно нерву и скелетной мышце, обусловлена кратковременным повышением мембранной проницаемости для Na + . Возникает так называемый быстрый входящий ток Na + по электрохимическому градиенту через «быстрые» Na -каналы, управляемые потенциалзависимыми и зависимыми от времени активационными и инактивационными воротами (см. ниже).
К концу деполяризации повышается мембранная проницаемость для К+. Это обстоятельство, а также уменьшение электроотрицательности внутри клеточного потенциала позволяют К+ по своему электрохимическому гра диенту быстро покидать клетку.
Вслед за овершутом сразу начинается реполяризация
, которая имеет три фазы.
В 1-ю фазу,или фазу ранней быстрой реполяризации, мембранный потенциал уменьшается почти до 0 вследствие изменения на правления ионного тока с входящего на выходящее. Это обусловлено:
1) уменьшением мембранной проницаемости для Na + и инактивацией быстрых Ма+-каналов;
2) проходящим повышением мембранной проницаемости для СГ с появлением входящего тока этого иона, который прекращается, как только мембранный потенциал достигает 0 (этот факт сейчас пересматривает ся);
3) транзиторным выходящим током большой амплитуды с малой постоян ной времени, который, по-видимому, представляет собой выходящий ток К+ вследствие кратковременной активации его потенциалзависимых кана лов.
Во 2-ю фазу ПД, или фазу плато, мембранный потенциал поддерживается на практически неизменном уровне благодаря тонкому ба лансу между небольшими по величине входящими и выходящими тока ми. Лишь к концу фазы равновесие нарушается в пользу выходящего тока положительно заряженных ионов с внутренней поверхности мембраны к наружной, что обусловливает продолжение процесса реполяризации.
В основе фазы плато лежат следующие перемещения ионов:
1) медленные входящие токи Са2+ и в меньшей степени Na + , возни кающие при активации соответствующих медленных потенциалзависи мых каналов — селективных Са2+ и Na + и неселективных Са2+ и Na + ;
2) небольшой выходящий ток К+ через активированные в данном ди апазоне потенциалов неселективные каналы, который состоит из двух компонентов — с малой и большой постоянной времени. Последнее обес печивает его участие в завершении процесса реполяризации.
Медленный входящий ток Са2+ имеет важное физиологическое значение, поскольку: 1) обеспечивает сопряжение возбуждения клеточной мем браны с активацией сократительных белков, то есть сокращением; 2) обес печивает однонаправленное проведение импульса возбуждения по сердцу. В то же время этот ток может играть важную роль в возникновении аритмий.
В 3-ю фазу, или фазу поздней реполяризации , наблюдается полное восстановление отрицательного внутриклеточного потенциала за счет массового выхода К+. В конце 3-й фазы системы активного транспорта К+— Na + — и Са2+-насосы обеспечивают поступление К+ внутрь клетки и удаление Na + , то есть восстановление исходного распределения ионов между цитоплазмой кардиоциоцита и внеклеточной жидкостью, о 4-ю фазу, соответствующую ГТП в клетках рабочего миокарда и системы Гиса-Пуркинье, восстанавливается мембранная проницаемость для К+.
Возникновение ионных токов обусловлено изменением проводимости соответствующих ионных каналов. Такой канал представляет собой осо бый белок, плавающий в липидном бислойном матриксе клеточной мембраны. В этом белке имеется заполненный водой центральный канал для транспорта ионов. Во время прохождения через такой ион-селективный канал по направлению электрохимического, то есть электрического плюс концентрационного, градиента катион, по-видимому, связывается с отрицательно заряженными участками.
Потенциал зависимые быстрые натриевые и медленные кальциевые и натриевые каналы имеют активационные ворота (А) в центральной час-
ти канала и инактивационные ( I ) на внутренней поверхнос ти мембраны (рис. 10).
Деполяризация до уровня порогового потенциала, который для разных каналов имеет различную величину, переводит канал в активированное состояние: А-ворота открываются, а I -ворота не успевают закрыться. При достиже нии мембранным потенциалом определенной величины и по прошествии определенного времени активированный канал спонтанно инактивиру-ется в результате закрытия I -ворот. После реполяризации мембраны ка нал реактивируется, то есть переходит в состояние .покоя, которое ха рактеризуется закрытыми А-воротами при открытых I -воротах. Впослед ствии он может быть снова активирован.
Медленные каналы кардиомиоцитов получают возможность активи роваться при деполяризации лишь при фосфорилировании мембранного белка, входящего в состав медленного канала, или связанного с ним регуляторного белка. Это обеспечивается цАМФ-зависимой протеинки- назой, использующей энергию АТФ, которая активируется при увеличе нии внутриклеточного уровня цАМФ. Фосфорилирование вызывает кон- формационное изменение белков, которое позволяет А-воротам открыться в ответ на изменение мембранного потенциала.
Благодаря таким особым свойствам медленных каналов поступление Са2+ в кардиомиоцит, а следовательно, и сила его сокращения могут регулироваться: 1) внешними факторами — стимуляцией симпатической части вегетативной нервной системы циркулирующими катехоламина-ми, гистамином, метилксантинами; 2) внутренними факторами — уровнем энергетического обмена в клетке, то есть запасами АТФ, рН, содер жанием цАМФ.
Вследствие блокады Са2+-каналов при уменьшении запасов макроэргов и рН в условиях кратковременной локальной ишемии снижается сила сокращений и работа клетки, что способствует сохранению минимального уровня АТФ и предотвращает необратимое повреждение клетки.
Другие отличия медленных каналов от быстрого Ыа+-канала: 1) более медленная кинетика открытия и закрытия ворот; 2) менее отрицательные потенциалы активации (—35 мВ против —55 мВ) и инактивации; 3) спо собность блокироваться различными химическими веществами.
В участках, деполяризованных вследствие повышения содержания К+ во внеклеточной среде, вызванного ишемией, «быстрые» ПД могут за-
пускать «медленные». При этом низкая скорость распространения «мед ленных» ПД создает условия для развития аритмий типа ри-энтри.
Электрофизиологические свойства миокарда
включают возбудимость,
автоматизм и
проводимость:
1) возбудимость —
способность клеток развивать ответ на раздражение (стимул, импульс). В миокарде это свойство Проявляется в форме: а) про ведения импульса; б) сокращения мышечных волокон. В различные пе риоды сердечного цикла возбудимость неодинакова, что обусловлено нео динаковой рефрактерностью.
Рефрактерный период — это часть сердечного цикла, в течение которой сердце не возбуждается или возбуждение его нарушено.
Различают абсолютный и относительный рефрактерные периоды. Абсолютный рефрактерный период представляет собой часть сердечного цикла, когда другой раздражитель, независимо от его силы, не способен вызвать повторное возбуждение, то есть образование ПД, возбужденного предыдущим стимулом участка, мышцы. Он охватывает ну левую, 1-ю, 2-ю и начало 3-й фазы ПД (см. вис. 9).
Относительный рефрактерный период — это часть сердечного кардиоцикла, в которую деполяризацию (ПД) удается вызвать лишь с помощью очень сильного раздражителя, более сильного, чем тот, который вызывает ПД в состоянии покоя При наличии ПП.
При этом величина вызываемого ПД и скорость его проведения уменьшены. Отно сительный рефрактерный период занимает значительную часть 3-й фазы. Следует отметить, что электрическая возбудимость восстанавливается раньше, чем сократительная активность.
За относительным рефрактерным периодом следует период супер нормальности, характеризующийся снижением порога возбудимости, когда подпороговый раздражитель способен вызвать деполяризацию. Соответствует конечной части 3-й фазы.
Рефрактерный период кардиоцикла миокарда
значительно длиннее, чем скелетной
мышцы
и нерва, что защищает миокард от тетанического сокращения и обеспечивает чередование периодов сокращения и расслабления, необходимых для надежного обеспечения нормального кро вообращения.
Длительность рефрактерного периода прямо пропорциональна продолжи тельности предшествовавшего сердечного цикла и силе предшествовавшего
СОКраЩСНИИ.
Ионной основой рефрактерности являются: а) инактивация мембран ных потенциалзависимых №+-каналов в условиях деполяризации; б) стой кое повышение мембранной проводимости для К+;
2) автоматизм,
или пейсмекерная активность, — способность клетки генерировать ПД, то есть импульс возбуждения. Определяется способно стью к спонтанной медленной диастолической деполяризации в 4-ю фазу ПД, которая следует сразу же за 3-й фазой (рис. 11). Пейсмекерный ток обусловлен постепенным уменьшением проницаемости мембраны для К+. По мере увеличения мембранного потенциала, то есть уменьшения вели чины ее отрицательного заряда, калиевые каналы, управляемые ворота ми, постепенно переходят из открытого состояния в закрытое. Динамика этого процесса определяет скорость, с которой уменьшается суммарный выходящий трансмембранный ток, которая, в свою очередь, определяет угол наклона кривой пейсмекерной деполяризации. Спонтанная диасто- лическая деполяризация, вероятно, частично обусловлена также зависи мым от времени входящим током Na + в результате медленного увеличе ния проницаемости для этого иона. Кроме того, некоторые вещества, например, норадреналин, способны усиливать фоновые входящие токи (так называемые токи утечки) Na + и Са2+, что также увеличивает кру тизну пейсмекерного потенциала.
Выраженность автоматизма, то есть частота импульсов, генерируемых пейсмекерными клетками, зависит от: 1) скорости спонтанной диастоли ческой деполяризации, то есть наклона кривой в 4-ю фазу; увеличение наклона кривой приводит к повышению ЧСС и наоборот; 2) величины поро гового потенциала; 3) величины максимального диастолического потенциа ла, достигнутой к концу реполяризации.
Приоритет центров (водителей) автоматизма в сердце определяется при сущей их клеткам скорости спонтанной диастолической деполяризации. В норме водителем ритма 1-го порядка является синоатриальный узел, 2-го порядка — атриовентрикулярное соединение (зона NH ). Клетки системы Гиса—Пуркинье являются латентными пейсмекерами, в которых спонтан ная диастолическая деполяризация в норме не регистрируется, так как высокочастотная стимуляция главного водителя ритма угнетает их автома тизм, возбуждая эти клетки с более высокой частотой. В клетках рабочего миокарда предсердий и желудочков автоматизм развивается только в ус ловиях патологии, например при локальной ишемии (см. рис. 11);
3) проводимость —
свойство клеток рабочего миокарда и проводящей
системы сердца распространять импульс возбуждения на окружающие клетки. Она обусловлена возникновением разности потенциалов вдоль поверхности волокна между деполяризованным участком и участками, которые находятся в состоянии покоя. Эта разность потенциалов приво дит в движение ионы (в основном К+), которые перемещаются от актив ного участка к пассивным, давая начало локальным токам, распростра няющим деполяризацию вдоль поверхности клетки.
Скорость проведения возбуждения в разных отделах сердца неодина кова. Она максимальна в волокнах Пуркин^е (2—4 м/с) и минимальна в атриовентрикулярном соединении (0,1-0,2 м/с), где задержка проведе ния в зоне N играет важную физиологическую роль. В сократительном миокарде предсердий импульс проводится со скоростью 0,4-0,8 м/с, в миокарде желудочков — 0,3—0,4 м/с.
Проводимость, то есть скорость проведения возбуждения, зависит от:
А. Анатомических факторов:
1) диаметра мышечных волокон (прямая зависимость), наибольшего в волокнах Пуркинье (100 мкм против 10-15 мкм у рабочих кардиомиоцитов);
2) геометрического расположения мышечных волокон (скорость про ведения вдоль мышечного волокна больше, чем поперек).
Б. Фмзм&лсгмчесхт фахтсров:
1) амплитуды ПД (прямая зависимость);
2) скорости деполяризации в нулевую фазу (прямая зависимость);
3) амплитуды ПП (уменьшение его отрицательной величины в результа те частичной деполяризации замедляет проведение);
4) возбудимости мышечных волокон, по которым проводится импульс.
Доказана возможность неоднородности проведения возбуждения в физио логических условиях в атриовентрикулярном соединении, пучке Гиса и его ножках. Эта так называемая продольная функциональная диссоциация, как и уменьшение скорости проведения в отдельных участках миокарда, имеет важное значение для возникновения нарушений сердечного ритма.
Противопоказания для электрофизиологического исследования сердца
К противопоказаниям для инвазивного электрофизиологического исследования сердца относятся такие состояния, как: — острый инфаркт миокарда — острый коронарный синдром — впервые выявленная и прогрессирующая стенокардия — аневризма сердца или аорты — пороки сердца, кардиомиопатии с выраженным нарушением кровообращения — выраженная хроническая сердечная недостаточность — острая сердечная недостаточность — тромбоэмболии, ишемический или геморрагический инсульт и другие острые сосудистые катастрофы — лихорадочные состояния
К противопоказаниям для проведения чрезпищеводного исследования, помимо перечисленных выше, относятся поражения пищевода, такие как дивертикулы, опухоли, стриктуры (сращения), острые и хронические в стадии обострения воспалительные процессы в стенке пищевода.
Зачем и как часто надо проходить процедуру
Исследование проводят, чтобы сделать точную диагностику вида аритмии. У пациента может быть несколько видов аритмии. Изучение проводимости сердца позволяет выяснить, на каком участке происходит сбой.
Если у пациента есть необходимость протестировать действия препаратов, то с помощью этого исследования можно с большой точностью подобрать лекарство, которое подойдёт больному и определиться с дозой. Выполнять процедуру надо так часто, как это диктует необходимость.
Далее мы поговорим о современных методах электрофизиологического исследования деятельности сердца.
Подготовка к ЭФИ для пациента
Пациент может быть направлен на исследование из поликлиники или из профильного отделения больницы, в котором он получает лечебно-диагностическую помощь врачами кардиологом, аритмологом или кардиохирургом. И чрезпищеводное, и инвазивное исследование проводятся строго натощак. Накануне процедуры не стоит злоупотреблять кофе, сигаретами и алкоголем, а также необходимо отменить все лекарственные препараты, оказывающие воздействие на сердце и сосуды, но только по согласованию с лечащим врачом.
Прежде чем направить пациента для проведения процедуры, лечащий врач должен полностью обследовать пациента. Пациенту необходимо на руках иметь результаты ЭКГ, суточного (по Холтеру) мониторирования ЭКГ, Эхо – КГ (УЗИ сердца), нагрузочных проб (тредмил или велоэргометрия). Также могут понадобиться заключения ЭЭГ (электроэнцефалограммы), или МРТ головного мозга (по назначению невропатолога, для исключения неврологической природы обморочных состояний) и консультации врачей других специальностей (невролога, эндокринолога, сосудистого хирурга и других).
Предварительная подготовка
Назначение процедуры начинается с обязательного изучения истории болезни. Вся процедура обговаривается с пациентом, поскольку обязательно требуется наличие подписанного согласия. В зависимости от типа процедуры она проводится в стационарных или амбулаторных условиях.
При проведении ее амбулаторно больной обязан прибыть в клинику непосредственно за несколько часов до самой процедуры, поскольку часто требуется провести предварительный анализ крови. Врач в обязательном порядке обязан ознакомить больного с планом питания, однако лучше всего не пить и ничего не есть как минимум за 8 часов до самой процедуры, хотя этот промежуток может быть и дольше.
Также может понадобиться принять ряд лекарственных средств – они назначаются исключительно врачом и предназначаются для сужения сосудов и нормализации сердечного ритма. Может понадобиться прекратить прием некоторых медикаментов за несколько дней до процедуры, поэтому предварительно следует рассказать врачу обо всех препаратах, которые больной принимает для избегания осложнений.
После этого перед процедурой обязательно ставится капельница для седатации и обезболивания. Часто она остается на весь промежуток операции и даже после самого исследования.
Как проводится электрофизиологическое исследование сердца?
Неинвазивное ЭФИ
Чрезпищеводное исследование проводится в отделении функциональной диагностики. Пациент утром приходит в отделение, его приглашают в кабинет ЧпЭФИ и укладывают на кушетку, где измеряют артериальное давление и записывают обычную ЭКГ. Далее врач, владеющий данной методикой, разъясняет пациенту суть процедуры и приступает к ее выполнению.
Через нос или рот (реже) в пищевод вводится зонд, на кончике которого находится миниатюрный электрод, позволяющий записать электрограмму. Также с помощью этого датчика осуществляется стимуляция левого предсердия посредством передачи коротких электрических импульсов определенной силы тока (10- 20 мА). После успешного введения зонд присоединяется к аппарату, осуществляющему стимуляцию и анализ полученных электрограмм.
После стимуляции производится запись электрограммы, на которой возможно появление искомых нарушений ритма. Далее зонд извлекается, врачом осуществляется анализ полученных данных с помощью компьютера, и результат выдается на руки пациенту или передается в отделение лечащему врачу. Вызванная тахиаритмия в большинстве случаев, проходит самостоятельно или с помощью лекарственных препаратов. В целом длительность процедуры составляет от 30 до 60 минут, вызывая у пациента лишь небольшое чувство жжения за грудиной, что не является патологией в контексте данной методики.
Инвазивное ЭФИ
Инвазивное электрофизиологическое иссследование проводится в отделении рентгенхирургических методов диагностики.
Введенные в полость сердца электроды

Проведение процедуры инвазивного ЭФИ
Пациент доставляется на каталке из профильного отделения в кабинет после премедикации (внутривенное введение обезболивающего и седативного препарата), укладывается на операционный стол, где измеряется артериальное давление и записывается стандартная ЭКГ. Далее врач, выполняющий исследование, прокалывает кожу в проекции бедренной (чаще всего) или подключичной вены (редко) для того, чтобы сделать инъекцию местного анестетика (например, ультракаина), после чего выполняет пункцию самой вены. Это единственный неприятный момент, могущий вызвать небольшой дискомфорт у пациента, так как в целом процедура безболезненна.
Далее через прокол посредством специального проводника (интродьюсера) в вену вводится тонкий гибкий катетер, под контролем рентгеноскопии продвигающийся в полость сердца. На конце его располагаются от трех до пяти миниатюрных электродов, выполняющих аналогичные по сравнению с ЧпЭФИ функции – запись электрограммы до и после электростимуляции и саму стимуляцию. Полученные данные обрабатываются соответствующей аппаратурой, и выводится результат.
Процедура длится более часа, а если было принято решение о проведении радиочастотной аблации в качестве следующего этапа операции, то время процедуры удлиняется. После проведения исследования катетеры извлекаются, на область пунктированной вены накладывается давящая повязка, и пациент доставляется в отделение интенсивной терапии на несколько часов или на сутки под наблюдение врачей. Спустя указанное время он переводится в отделение, в которое был госпитализирован до этого.
Виды процедуры
Выделяют два электрофизиологических метода исследования:
- инвазивный,
- неинвазивный.
Инвазивный метод исследования выполняется двумя способами. Первый – путем введения через бедренную вену специального электрода. Второй – эпикардиальная стимуляция. Этот способ применяется только во время других плановых кардиологических операций на открытом сердце.
Неиванзивное исследование по-другому называют чреспищеводным электрофизиологическим обследованием. Пациенту через нос или через рот вводится специальный электрод примерно на 40 см. В итоге передатчик оказывается примерно на уровне сердца, близко от него.

Чреспищеводное исследование сердечной мышцы проводится намного чаще, чем инвазивное. Данная методика менее травматична для пациента, а ее себестоимость намного ниже. К тому же для проведения эндокардиального обследования требуется больше специального оборудования, которое есть не во всех центрах.
Проведение инвазивного исследования не всегда рекомендуется, к нему есть ряд противопоказаний. К тому же такое вмешательство в некоторых случаях вызывало осложнения у тяжелых пациентов.

Внимание! Инвазивный метод имеет и свои преимущества. При чреспищеводном введении зонда стимуляции поддается только левое предсердие. При инвазивном простимулировать на предмет развития аритмий можно все отделы органа, в том числе и оба желудочка.
Расшифровка результатов ЭФИ
В норме в заключении электрофизиологического исследования должно быть указано, что всеми типами стимуляции спровоцированных аритмий выявлено не было.
При выявлении нарушений ритма и проводимости дается полная характеристика каждого вида аритмии. Также параллельно оценивается сегмент ST на электрограмме (депрессия или подъем) для получения информации о наличии ишемии миокарда, спровоцированной тахикардией.
Полученные результаты должны быть тщательно интерпретированы врачом аритмологом с целью определения дальнейшей тактики ведения пациента и коррекции лечения.
Особенности проведения ЭФИ
Согласно отзывам, ЭФИ сердца не является приятной процедурой, но нельзя отрицать, что она позволяет эффективно диагностировать имеющиеся проблемы с нарушениями сердечного ритма.
Для осуществления процедуры инвазивной ЭФИ врач вставляет в кровеносный сосуд, обычно им выступает бедренная вена, тончайшую трубку, называемую катетером. Этот сосуд обязательно должен двигаться к сердечной мышце. Находящийся на катетере электрод периодически позволяет посылать сигналы, но при этом и осуществлять запись собственной электрической активности сердца. Обычно проводится процедура под седацией (легким наркозом), или когда пациент находится в сознании.
Для проведения процедуры требуются условия стационара, поэтому больной ложится в больницу минимум на 2 дня. Сама процедура стандартно не занимает более 45 минут.
Неинвазивное исследование проводится иным методом, поскольку не требуется доступа к сосудам. Сама процедура очень неприятна, поэтому о появившихся неудобствах следует немедленно уведомить врача. Для получения результата предварительно записывается нормальная электрокардиограмма, а затем в рот или нос вставляется зонд с электродом, который постепенно вводится в пищевод. Его останавливают поблизости от сердца, а затем сравнивают полученные результаты.
Подобное ЭФИ может продлиться от часа до четырех часов. Оно может сопровождаться болями в груди или рвотным рефлексом, что сильно осложняет проведение исследования.
Осложнения при проведении электрофизиологического исследования
Осложнения при проведении электростимуляции возникают крайне редко, так как за годы исследований, проведенных в этой области, достигнуты наиболее физиологические протоколы стимуляции, не приводящие к развитию жизнеугрожающих заболеваний. Но все-таки врачи, проводящие исследование, должны быть осведомлены о риске возникновения реанимационных состояний, таких как острая сердечная недостаточность, фибрилляция желудочков, внезапная сердечная смерть, и владеть навыками проведения неотложной помощи и сердечно – легочной реанимации.
Врач терапевт Сазыкина О.Ю.
Безопасна ли методика
Исследование относят к манипуляциям с небольшой степенью риска. Возможны такие нарушения после проведения процедуры:
- приступ стенокардии,
- травмирование сосудов,
- развитие инфаркта,
- аритмии сердца,
- инфекционный процесс,
- тромбозы,
- гипотония.
Реабилитация после рча сердца что нельзя делать
На самом деле количество сердечных сокращений в минуту имеет широкий диапазон. Если же частота биения сердца слишком высокая или низкая, отмечаются преждевременные сокращения, а также электрические импульсы задерживаются или воспроизводятся через патологические пути, то тогда речь идет об аритмии. Какого бы типа не была аритмия, она имеет определенные причины, которые могут быть схожи между собой. Заболевание может быть спровоцировано:. Довольно распространенной причиной является органическое заболевание сердца, например ишемия, сердечная недостаточность и болезнь клапанов. Клинические проявления нехарактерного сердцебиения бывают разнообразны.
О том, как как делается процедура, и какие отзывы об ощущениях тех, кто делал ЭФИ сердца, рассказано далее. Как проходит сеанс Инвазивный метод.
Основные показания к неинвазивной стимуляции
Для проведения чреспищеводной стимуляции обязательно требуется наличие ряда следующих показаний:
- Частое замедление частоты сердечного пульса.
- Наджелудочковая тахикардия пароксизмальной природы.
- Одновременный синдром брадикардии и тахикардии.
- Решение вопроса о последующей установке кардиостимулятора в случаях, когда лечение медикаментозными препаратами не принесло успеха.
- Оценка эффективности антиаритмической терапии, которой подвергается больной.
Рча сердца в москве
Радиочастотная абляция сердца известна не более двух столетий, но уже приобрела широкую популярность в детской и взрослой интервенционной аритмологии. Это современная малоинвазивная операция, помогающая избавиться от различных аритмий, которые невозможно убрать лекарственным способом. Катетерная абляция сердца заключается в использовании переменного тока радиочастотной энергии мощностью от до кГц. Под его воздействием происходит разрушение определенных участков сердца.
Способы исследования работы сердца с каждым годом совершенствуются.
Источник: medbur.ru

