Введение[править | править код]
Эта статья посвящена фармакологическому действию инсулина, глюкагона, соматостатина и пероральных сахаропонижающих средств. Открытие инсулина в 1921 г. произвело переворот в медицине, дав средство для лечения инсулинозависимого сахарного диабета (сахарного диабета типа I) — болезни, которая считалась неизлечимой. В первой части главы описаны физиологические эффекты инсулина и механизмы его действия; тем самым обоснована роль этого гормона в лечении сахарного диабета. В следующей части дана фармакодинамика и фармакокинетика препаратов инсулина, рассмотрены преимущества интенсивной инсулинотерапии и ее роль в предупреждении хронических осложнений сахарного диабета. Далее описаны фармакологические свойства пероральных сахаропонижающих средств, без которых немыслимо лечение инсулинонезависимого сахарного диабета (сахарного диабета типа II) — самой распространенной формы заболевания. В конце главы рассказывается о физиологии и фармакологии глюкагона и соматостатина. Особое внимание уделено все более широкому применению аналогов соматостатина в клинической практике.
Инсулин[править | править код]
Историческая справка[править | править код]
Открытие инсулина — одно из самых ярких в медицине. Честь открытия принадлежит Бантингу и Бесту, но без предшествующих трудов многих исследователей оно было бы немыслимым. В 1869 г. немецкий студент-медик Пауль Лангерганс обратил внимание, что поджелудочная железа состоит из двух групп клеток — ацинозных, секретируюших пищеварительные ферменты, и иных, собранных в так называемые островки. Лангерганс предположил, что островковые клетки выполняют какую-то особую функцию. О том, какова эта функция, догадались только в 1889 г., когда Оскар Минковски и Йозеф фон Меринг описали у подвергнутых панкреатэктомии собак синдром, похожий на сахарный диабет (Minkowski, 1989).
Затем последовало множество попыток выделить из поджелудочной железы вещество, регулирующее уровень глюкозы в крови. В начале 1900-х гг. немецкий терапевт Георг Людвиг Цюльцер решился ввести вытяжку из поджелудочной железы умирающему от сахарного диабета больному. Больному стало лучше, но ненадолго: когда запасы вытяжки закончились, он впал в кому и скончался. Еще одна попытка найти антидиабетический фактор была предпринята в 1911 г. Э. Л. Скоттом, студентом Чикагского университета. Он лечил собак с экспериментальным сахарным диабетом с помощью спиртового экстракта поджелудочной железы (кстати, почти такого же, какой впоследствии использовали Бантинг и Бест).
нако научный руководитель Скотта счел эти эксперименты неубедительными, поскольку тот не проводил измерений уровня глюкозы в крови. С 1916 по 1920 г. румынский физиолог Николае Паулеску поставил серию опытов, в которых показал, что введение вытяжки из поджелудочной железы собакам с экспериментальным сахарным диабетом снижает содержание глюкозы и кетоновых тел в моче. Несмотря на то что эти результаты были опубликованы, работу Паулеску оценили по достоинству только много лет спустя.
Не подозревая о работах своих предшественников, молодой канадский хирург из Торонто Фредерик Г. Бантингв 1921г.упросил профессора физиологии Джона Дж. Р. Маклеода пустить его в лабораторию для выделения антидиабетического фактора из поджелудочной железы. Бантинг предположил, что секретируемый островковыми клетками гормон (инсулин) быстро разрушается протеазами — во время экстракции или еще до нее. Вместе с Чарльзом Г. Бестом, студентом-медиком четвертого курса, он стал перевязывать протоки поджелудочной железы чтобы избежать протеолиза. После перевязки ацинозные клетки подвергались дегенерации, а островки оставались интактны-ми, и из них с помощью этанола и кислоты был экстрагирован антидиабетический фактор. Полученный экстракт снижал уровень глюкозы в крови у собак с экспериментальным сахарным диабетом.
Первым больным, получившим экстракт Бантинга и Беста, был четырнадцатилетний Леонард Томпсон (Banting et al., 1922), госпитализированный в Торонтскую городскую больницу с уровнем глюкозы в крови 500 мг% (28 ммоль/л) и суточным диурезом 3—5 л.
смотря на строгую диету (450 ккал/сут), глюкозурия нарастала, и без инсулина мальчик бы погиб через несколько месяцев. Пробное введение экстракта поджелудочной железы привело к снижению уровней глюкозы в крови и моче. Тогда исследователи стали вводить мальчику зкстракг ежедневно, вслед за чем последовало немедленное улучшение. Суточная экскреция глюкозы снизилась со 100 до 7,5 г. Кроме того, «мальчик повеселел, окреп и сказал, что чувствует себя значительно лучше». Таким образом, заместительная терапия новым гормоном — инсулином — позволила предотвратить неизбежную смерть от сахарного диабета (Banting et al., 1922). В последующий год Бантинга и Беста преследовали неудачи. Им никак не удавалось добиться воспроизводимости результатов, то есть раз от раза получать акти вн ые экстракты поджелудочной железы. К решению этой проблемы подключился Маклеод, и, кроме того, Бантинг обратился за помощью к Джеймсу Б. Кол-липу — химику, прославившемуся выделением и очисткой адреналина. Вскоре методика экстрагирования была отлажена, и больные в Северной Америке получили возможность лечиться инсулином, выделенным из поджелудочных желез свиней и крупного рогатого скота. В настоящее время сахарный диабет лечат человеческим инсулином, получаемым методами генной инженерии.
В 1923 г., с удивительной быстротой, Бантинг и Маклеод были удостоены Нобелевской премии по физиологии и медицине, и сразу же вокруг нее закипели страсти. Бантинг заявил, что свою половину премии он разделит с Бестом. Маклеод поделился с Колл и пом. История открытия инсулина подробно описана Блиссом (Bliss, 1982).
Строение инсулина[править | править код]
Несколько лет спустя Абель получил чистый кристаллический инсулин, но аминокислотная последовательность этого гормона была расшифрована Сэнгером только в I960 г. В 1963 г. был синтезирован искусственный инсулин, а в 1972 г. Ходжкин с коллегами установил его пространственную структуру. Инсулин был первым гормоном, который стали определять с помощью РИА (Yalow, 1978).
Бета-клетки островков поджелудочной железы синтезируют инсулин из препроинсулина — одноцепочечного белка-предшественника, состоящего из 110 аминокислотных остатков. После переноса через мембрану шероховатого эндоплазматического ретикулума от препроинсулина отщепляется кислый N-концевой сигнальный пептид из 24 аминокислотных остатков, и образуется проинсулин (рис. 61.1)
. На этом этапе образуются дисульфидные связи, и молекула приобретает третичную структуру. В аппарате Гольджи от человеческого проинсулина протеазы отщепляют четыре основных аминокислотных остатка и соединительное звено — С-пептид. В результате получаются две пептидные цепи (А и В), вместе составляющие молекулу инсулина. Каждая из цепей содержит по одной дисульфидной связи, между собой они соединены еще двумя.
цепь обычно содержит 21 аминокислотный остаток, В-цепь — 30; молекулярная масса инсулина равна 5734. Аминокислотная послеловательность инсулина считается консервативной, но в ходе эволюции с ней происходили существенные изменения, отразившиеся на биологической активности и иммуногенности этого гормона (De Meyts, 1994). У большинства видов имеется один ген инсулина, кодирующий один белок. Исключение составляют крысы и мыши, имеющие по два гена инсулина. У них образуются по два инсулина, различающихся двумя аминокислотными остатками В-цепи.
Кристаллическая структура инсулина к настоящему времени изучена с разрешением 0,15 нм. Обе цепи гормона имеют весьма упорядоченную структуру с несколькими а-спиральными участками. По отдельности цепи инсулина биологической активностью не обладают. В растворе инсулин может существовать как мономер, димер или гексамер. Гексамер образуется с участием двух ионов Zn +; полагают, что именно в этой форме инсулин хранится в секреторных гранулах β-клеток. По-видимому, Zn + играет ведущую роль в формировании кристаллов инсулина, а кристаллизация ускоряет процесс превращения проинсулина в инсулин и облегчает хранение гормона. Большинство препаратов инсулина содержат высококонцентрированный раствор гексамеров гормона. После того как препарат инсулина всосался и его концентрация упала до физиологической (наномолярной), гормон распадается на мономеры, которые и обладают биологической активностью. В последнее время появились препараты инсулина, содержащие мономеры гормона.
Значительная часть наших знаний о взаимосвязи структуры и активности инсулина получена при изучении инсулинов различных видов животных, а также путем химических модификаций молекулы гормона. Инвариантные аминокислотные остатки (Гли Глу Глн5, Тир1’*, Асн21 в A-цепи и Вал12, Тир16, Гли23, Фен24, Фен и Тир26 в В-цепи) образуют структуру, которая взаимодействует с рецептором инсулина (рис. 61.2). Некоторые из этих остатков участвуют и в димеризации инсулина (de Meyts, 1994). Лей13 A-цепи и Лей17 В-цепи, по-видимому, формируют второй участок связывания (de Meyts, 1994). Инсулин связывается с N-концевым и С-концевым участками а-субъеди-ницы рецептора. Полагают, что в связывании участвует и богатый цистеином фрагмент а-субъединицы рецептора. Как правило, сродство инсулина к своему рецептору коррелирует со способностью гормона влиять на метаболизм глюкозы. Бычий и свиной инсулины обладают биологической активностью, равной активности человеческого инсулина, инсулин морских свинок значительно менее активен, а некоторые птичьи инсулины по активности превосходят человеческий.
Инсулин входит в семейство пептидов, называемых инсулиноподобными факторами роста — ИФР. Два из них (ИФР-I и ИФР-П) имеют молекулярную массу около 7500 и по структуре сходны с проинсулином (Cohick and Clemmons, 1993). В молекуле ИФР сохранены участки, тождественные С-пептиду проинсулина. В отличие от инсулина, ИФР продуцируются многими тканями и участвуют в первую очередь в регуляции роста, а не метаболизма. Полагают, что эти пептиды, особенно ИФР-1, опосредуют действие СТГ (раньше их даже называли соматомединами). Не исключено, что релаксин — гормон, секретируемый желтым телом во время беременности, находится в отдаленном родстве с ИФР.
Рецепторы инсулина и ИФР-I тоже сходны по структуре (Duronio and Jacobs, 1988). Поэтому инсулин хоть и с низким сродством, но связывается с рецептором ИФР-I, а ИФР-1 — с рецептором инсулина. Полагают, что стимулирующее действие инсулина на пролиферацию клеток, по крайней мере отчасти, опосредовано рецептором ИФР-I. Метаболическая и митогенная активность аналогов инсулина не всегда коррелируют. Например, метаболическая активность проинсулина в 50 раз меньше, чем инсулина, а митогенная — всего в 2 раза меньше (King and Kahn, 1981). Это нужно учитывать при выборе препарата инсулина, поскольку стимулирующее действие на пролиферацию клеток повышает риск атеросклероза.
Метаболизм инсулина[править | править код]
Синтез и секреция[править | править код]
Синтез, запасание и секреция инсулина β-клетками, а также инактивация гормона в тканях-мишенях подробно изучены на клеточном и молекулярном уровнях. Более того, эти сведения послужили основой для изучения секреторной активности других островковых клеток (Orci, 1986). Островки поджелудочной железы содержат клетки четырех типов, которые синтезируют и секретируют разные пептидные гормоны: β-клетки — инсулин, а-клетки — глюкагон, 5-клетки — соматостатин, а РР-клетки (они же F-клетки) — панкреатический полипептид. На долю β-клеток приходится 60—80% массы островка, они составляют его ядро. Альфа-, 8- и РР-клетки формируют вокруг ядра мантию толщиной в 1—3 клетки.
Островковые клетки соединены между собой щелевыми контактами, которые пропускают небольшие молекулы и обеспечивают координацию работы клеток (Orci, 1986). Артериола, входя в островок, ветвится и образует в его ядре похожую на клубочек капиллярную структуру. Капилляры выходят в мантию и сливаются там в собирательный сегмент венулы (Вопner-Weir and Orci, 1982). Кровь в островке течет от р-клеток к а-и 5-клеткам (Samols et al., 1986). Таким образом, β-клетки первыми воспринимают концентрацию глюкозы в крови, а остальные типы клеток подвергаются действию чрезвычайно высоких концентраций инсулина.
Как уже говорилось, инсулин образуется из одноцепочечного предшественника, в котором А- и В-цепи соединены С-пеп-тидом. В процессе трансляции возникает препроинсулин, содержащий дополнительно сигнальную последовательность из 24 гидрофобных аминокислотных остатков на N-конце В-цепи. Сигнальная последовательность нужна для проникновения образующегося препроинсулина в просвет шероховатого эндо-плазматического ретикулума, где сигнальная последовательность сразу же отщепляется, а проинсулин в мелких везикулах транспортируется в аппарат Гольджи. Здесь он упаковывается в секреторные гранулы вместе с ферментами, необходимыми для его превращения в инсулин (Orci, 1986).
Превращение проинсулина в инсулин начинается в аппарате Гольджи и продолжается в секреторных гранулах, практически завершаясь к моменту секреции. Таким образом, в кровоток попадают эквимолярные количества С-пептида и инсулина. Какие биологические функции выполняет С-пептид, пока не известно, однако он служит надежным маркером секреции инсулина (Polonsky and Rubenstein, 1986). Кроме того, из β-клеток высвобождаются малые количества проинсулина и дез-31,32-проинсулина. Это может объясняться либо экзоцитозом гранул, в которых превращение проинсулина в инсулин еще не завершилось, либо наличием дополнительного механизма секреции. Поскольку Я проинсулина в кровотоке намного больше, чем Т1/2 инсулина, до 20% иммунореактивного инсулина плазмы на самом деле представляют собой проинсулин и промежуточные продукты его превращения в инсулин.
Превращение проинсулина в инсулин осуществляют две Са2+-зависимые эндопептидазы, обнаруженные в секреторных гранулах островковых и других нейроэндокринных клеток. Эти эндопептидазы — прогормон-конвертазы 2 и 3 — имеют активный центр, сходный с таковым субтилизина, и расщепляют связи Лиз—Apr и Apr—Apr (Steiner et al., 1992). Прогормон-конвертаза 2 расщепляет только место соединения С-пептида с A-цепью. Прогормон-конвертаза 3 расщепляет преимущественно место соединения С-пептида с В-цепью, но может также действовать на точку приложения прогормон-конвертазы 2. Хотя данное семейство эндопротеаз включает в себя как минимум еще два белка (прогормон-конвертазу 1 и фурин), за превращение проинсулина в инсулин ответственны, очевидно, только прогормон-конвертазы 2 и 3.
Регуляция секреции инсулина[править | править код]
Секреция инсулина регулируется настолько четко и слаженно, что и натощак, и во время еды в крови поддерживается постоянный уровень глюкозы. В регуляции участвуют питательные вещества, гормоны, вырабатываемые поджелудочной железой и ЖКТ, а также медиаторы вегетативной нервной системы. Глюкоза, аминокислоты, жирные кислоты и кетоновые тела стимулируют секрецию инсулина. Островки поджелудочной железы имеют богатую адренергическую и холинергическую иннервацию. Стимуляция а2-адренорецепторов ведет к подавлению секреции инсулина, а стимуляция β2-адре-норецепторов и блуждающего нерва — к усилению. Любое воздействие, повышающее симпатический тонус (гипоксия, переохлаждение, хирургическое вмешательство, ожоги), сопровождается снижением секреции инсулина за счет активации а2-адренорецепторов. Соответственно, а2-адреноблокаторы увеличивают базальный уровень инсулина в плазме, а β2-адреноблокаторы уменьшают его (Porte and Halter, 1981).
Главным стимулятором секреции инсулина служит глюкоза, ее присутствие необходимо и для действия других стимуляторов (Matschinsky, 1996). Глюкоза сильнее стимулирует секрецию инсулина, когда ее принимают внутрь, чем при в/в введении. Действительно, прием пиши (и в ее составе — глюкозы) ведет к выбросу гормонов ЖКТ и активации блуждающего нерва (Malaisse, 1986; Brelje and Sorenson, 1988). Среди гормонов ЖКТ, стимулирующих секрецию инсулина, ведущая роль принадлежит гастроингибирующему пептиду и глюкагоноподобному пептиду типа 1; менее сильные стимуляторы — гастрин, секретин, хо-лецистокинин, ВИП, гастрин-высвобождающий пептид и оксинтомодулин (Ebert and Creutzfeldt, 1987).
Секреция инсулина, возникающая под действием глюкозы, носит двухфазный характер. Первая фаза достигает максимума через I —2 мин и длится недолго, вторая начинается не сразу, но продолжается длительное время. Механизм, посредством которого глюкоза вызывает секрецию инсулина, до конца не изучен. Первым делом глюкоза должна попасть внутрь β-клеток и метаболизироваться (Matschinsky, 1996).
Глюкоза транспортируется в β-клетки путем облегченной диффузии, в которой участвует мембранный белок — переносчик глюкозы GLUT2 (см. ниже). Внутри клеток глюкоза фосфорилирустся глюкокиназой. В отличие от других гексокиназ, глюкокиназа (гексокиназа типа IV) экспрессируется только в тех клетках, которые участвуют в регуляции метаболизма глюкозы, в частности в гепатоцитах и β-клетках островков поджелудочной железы. Благодаря довольно высокой константе Михаэлиса (10—20 ммоль/л) этот фермент играет важнейшую роль в поддержании нормальной концентрации глюкозы в организме. Способность моно- и дисахаридов подвергаться фосфори-лированию и, следовательно, гликолизу коррелирует с их способностью стимулировать секрецию инсулина. Этот факт позволил предположить, что на самом деле стимулятором секреции инсулина является некий промежуточный продукт гликолиза либо какой-то кофермент (Matschinsky, 1996). Обнаружение мутаций гена глюкокиназы у больных с относительно редкой формой сахарного диабета — юношеским инсулинонезависимым сахарным диабетом типа 2 (MODY2; см. ниже) упрочило гипотезу о том, что глюкокиназа служит своеобразным датчиком концентрации глюкозы. Данные мутации приводят к нарушению способности глюкокиназы фосфорилировать глюкозу и таким образом увеличивают минимальную концентрацию глюкозы, при которой усиливается секреция инсулина (Gidh-Jain et al., 1993).
В конечном счете скорость секреции инсулина определяется внутриклеточной концентрацией Са2+ (Wolfet al., 1988). Метазолизм глюкозы, который начинается с фосфорилирования глюкокиназой, приводит к уменьшению отношения концентраций АТФ и АДФ в клетке. В результате ингибируются АТФ-чувст-вительные калиевые каналы и мембрана β-клетки деполяризуется. Последующее открывание потенциалзависимых кальциевых каналов приводит ко входу Са2+ в клетку. Кальций активирует фосфолипазы А2 и С, и в результате образуются арахидоно-вая кислота, инозитолполифосфаты и ДАГ. ИФ3 способствует мобилизации Са2+ из структур, подобных эндоплазматическому ретикулуму, что вызывает дальнейший подъем внутриклеточной концентрации Са . Ионы кальция непосредственно стимулируют секрецию инсулина.
Подъем внутриклеточной концентрации Са наблюдается также при активации фосфолипазы С ацетилхолином, холецистокинином и гормонами, увеличивающими внутриклеточную концентрацию цАМФ (Ebert and Creutzfeldt, 1987). Глюкагон, гастроингибирующий пептид и глюкагоноподобный пептид типа 1 активируют аденилатциклазу β-клеток (фермент, под действием которого образуется цАМФ), а соматостатин и а2-адреностимуляторы ингибируют ее (Fleischer and Erlichman, 1989).
Большинство питательных веществ и гормонов, стимулирующих секрецию инсулина, усиливают и биосинтез этого гормона (Gold et al., 1982). Хотя синтез и секреция инсулина тесно связаны между собой, существуют факторы, которые влияют на один процесс, не затрагивая другой. Примером может служить снижение внутриклеточной концентрации Са2+, которое ингибирует секрецию, но не влияет на синтез инсулина.
Скорости секреции инсулина и глюкагона осгровковыми клетками обычно находятся в обратной зависимости друг от друга (Unger, 1985). Это связано с действием на а-клетки инсулина, а также глюкозы и других веществ (см. ниже). Кроме того, секрецию и инсулина, и глюкагона модулирует соматостатин — третий островковый гормон (см. ниже). Глюкагон вызывает выброс соматостатина, а соматостатин подавляет секрецию инсулина, что в физиологических условиях большой роли не играет. Кровь в островках течет от р-клеточного ядра к а- и 5-клеткам (Samols et al., 1986), поэтому инсулин может паракринно ингибировать секрецию глюкагона, а вот соматостатин, чтобы попасть к а- и β-клеткам, должен пройти оба круга кровообращения. Таким образом, инсулин регулирует секрецию глюкагона и панкреатического полипептида, тогда как роль соматосгатина остается неясной.
Распределение и инактивация[править | править код]
В крови инсулин находится в виде ни с чем не связанного мономера, и его объем распределения приближается к объему внеклеточной жидкости. Натощак из поджелудочной железы в воротную вену поступает около 40 мкг (1 ед) инсулина в час. При этом в воротной вене концентрация инсулина составляет 2—4 нг/мл (50—100 мкед/мл), а в периферической крови — 0,5 нг/мл (12 мкед/мл), или примерно 0,1 нмоль/л. После приема пиши концентрация инсулина в воротной вене быстро возрастает, вслед за чем наблюдается параллельный, но меньший по амплитуде подъем концентрации инсулина в периферической крови. Задача инсулинотерапии — воспроизвести эту картину, однако с помощью п/к инъекций гормона добиться этого очень и очень трудно.
Т1/2 инсулина в плазме у здоровых людей и больных с неосложненным сахарным диабетом составляет 5—6 мин (Sodoyez et al„ 1983). У больных сахарным диабетом, имеющих антитела к инсулину, эта цифра бывает несколько выше. Т,/2 проинсулина дольше и составляет примерно 17 мин; на долю проинсулина приходится около 10% всего иммунореактивного инсулина плазмы (Robbins et al., 1984). У больных с инсулиномой доля проинсулина в крови обычно увеличена и достигает 80% иммунореактивного инсулина плазмы. Поскольку биологическая активность проинсулина составляет около 2% активности инсулина, истинная концентрация гормона всегда несколько ниже той, которую дают неспецифичные РИА и иммуноферментный анализ. С-пептид секретируется вместе с инсулином в эквимолярных количествах, но его молярная концентрация в плазме выше концентрации инсулина — за счет меньшего печеночного клиренса и длительного Т1/2 (около 30 мин) (Robbins et al., 1984). По концентрации С-пептида в крови судят о стимулированной секреции инсулина.
Инактивация инсулина осуществляется преимущественно в печени, почках и мышцах (Duckworth, 1988). Примерно половина инсулина, достигающего печени через воротную вену, разрушается гепатоцитами и не попадает в системный кровоток. Инсулин фильтруется в почечных клубочках и реабсорбируется в почечных канальцах, что тоже приводит к его разрушению. Тяжелая почечная недостаточность влияет на ТЦ инсулина даже в большей степени, чем заболевания печени (Rabkin et al., 1984). Дело в том, что гепатоциты и в норме инактивируют инсулин с максимальной скоростью, поэтому возможности скомпенсировать утраченную функцию почек у них нет. Прием глюкозы внутрь, похоже, приводит к снижению поглощения инсулина печенью (Hanks et al.,1984). Периферические ткани, в частности жировая, тоже инактивируют инсулин, но в малых количествах.
Протеолиз инсулина в печени происходит главным образом внутри гепатоцитов (после интернализации гормон-рецепторного комплекса), и лишь малая часть инсулина расщепляется на поверхности клеток (Berman et al., 1980). Интернализация гормон-рецепторного комплекса осуществляется путем эндоцитоза, во время которого комплекс попадает в мелкие везикулы, называемые эндо-сомами. В них и начинается разрушение инсулина (Duckworth, 1988). Некоторое количество гормона разрушается в лизосомах.
Доля инсулина, разрушаемого после интернализации, зависит от типа клеток. Так, в гепатоцитах расщепляется более 50% попавшего внутрь клеток инсулина, а эндотелиальные клетки высвобождают неизмененным почти весь поглощенный ими гормон. По-видимому, инсулин просто транспортируется эндотелиальными клетками из крови во внеклеточное пространство (King and Johnson,1985). Там, где эндотелиальные клетки соединены между собой плотными контактами (в частности, в мышечной и жировой ткани), такой транспорт, называемый трансцитозом, играет важнейшую роль в доставке инсулина к клеткам-мишеням.
В расщеплении инсулина участвуют несколько ферментов. Главный из них — цистеиновая металлопротеиназа, содержащаяся в гепатоцитах (Shii and Roth, 1986). Иммунологически сходные с ней белки обнаружены в мышцах, почках и головном мозге (Duckworth, 1988). Наибольшую активность по расщеплению инсулина проявляет цитозоль, поэтому возникает вопрос, каким же образом цитозольный фермент действует на заключенный в везикулы инсулин. В то же время эта активность обнаружена и в эндосомах (Hamel et al., 1991). Описан и другой фермент, расщепляющий инсулин (Authieret al., 1994). Распределение ролей между двумя ферментами остается под вопросом. Не исключено, что оба они участвуют в инактивации и других гормонов, в частности глюкагона.
Механизмы действия инсулина[править | править код]
Читайте отдельную статью: Механизмы действия инсулина
Источник: sportwiki.to
Типы ферментов поджелудочной железы
Поджелудочная железа синтезирует много разных видов биологически активных веществ. От других составляющих человеческого организма она отличается тем, что способна к эндокринной и экзокринной секреции одновременно. Первый секреционный тип характеризуется выбросом гормонов непосредственно в кровяное русло, при втором типе все вещества выделяются в область тонкого кишечника.
Экзокринная составляющая занимает больше 95% объема всей поджелудочной. До 3% приходится на панкреатические островки (так же их называют островками Лангерганса), в которых синтезируются:
- Глюкагон;
- Инсулин;
- С-пептиды.
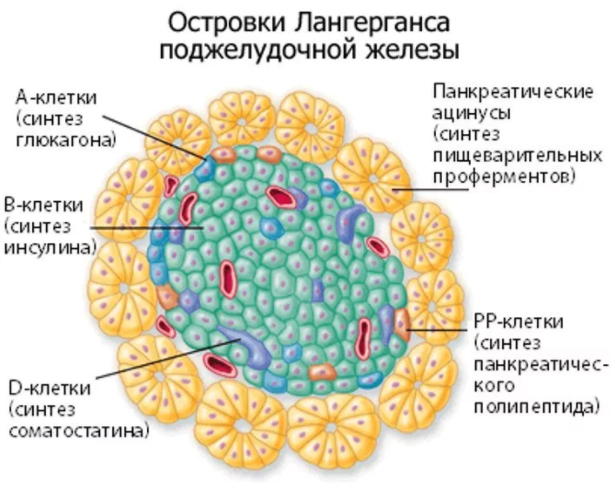
Гормоны, которые вырабатываются в них, оказывают влияние почти на все процессы метаболизма в организме.
Инсулин
Это гормон белковой природы. Он регулирует обмен веществ практически на всех уровнях жизнедеятельности. Первоочередно его действие направлено на поддержание углеводного баланса. Это происходит за счет усиления глюкозного транспорта сквозь клеточную мембрану клетки. Происходит запуск инсулинового рецептора и специального механизма, который регулирует количество и интенсивность деятельности мембранных белков. Именно эти составляющие переносят молекулы глюкозы в клетку и тем самым варьируют её концентрацию.
 Транспорт глюкозы посредством инсулина больше всего важен для мышечной и жировой тканей, так как они являются инсулинозависимыми. Именно они составляют около 75% клеточной массы организма и осуществляют такие важные задачи как запасание и дальнейшее выделение энергии, движение, дыхание и другие.
Транспорт глюкозы посредством инсулина больше всего важен для мышечной и жировой тканей, так как они являются инсулинозависимыми. Именно они составляют около 75% клеточной массы организма и осуществляют такие важные задачи как запасание и дальнейшее выделение энергии, движение, дыхание и другие.
Регулирование глюкозного уровня
Действие инсулина на обменные процессы энергии и питательных компонентов достаточно сложное. Реализация большинства эффектов от него зависит от способности инсулина влиять на активность некоторых ферментов. Инсулин является единственным гормоном, который регулирует уровень сахара в крови. Это его базовая функция. Она производится посредством:
- Активирования работы ферментов, поддерживающих гликолиз (окисление молекулы глюкозы с получением из неё двух молекул пировиноградной кислоты);
- Подавление гликогенеза — выработки глюкозы и других компонентов в клетках печени;
- Усиление абсорбции молекул сахара;
- Стимулирование продуцирования гликогена — инсулиновый гормон, который ускоряет полимеризацию молекул глюкозы в гликоген мышечными и печеночными клетками.
Действие инсулина происходит за счет белка-рецептора. Он представляет собой сложный мембранный белок интегрального типа. Белок построен из субъединиц а и b, которые образованы посредством полипептидной цепи. Инсулин состыковывается с частицей а, при соединении её конформация меняется. В этот момент частица b становится тирозинкиназно активной. После этого запускается целая цепь реакций с активацией разных ферментов.
Ученые ещё не до конца изучили процесс взаимодействия инсулина и рецептора. Известно, что в промежуточном периоде синтезируются диацилглицеролы и инозитолтрифосфат, которые активируют протеинкиназу С. Эти вещества стимулируют включение в мембрану цитоплазматических везикул с белком-переносчиком сахара в составе. Из-за увеличения свободных переносчиков глюкозы в клетку поступает больше.
Как можно понять, регуляция глюкозного уровня — это многоэтапный и технически сложный процесс. На него влияет слаженная работа всего организма и множество других факторов. Гормональная регуляция — одна из самых важных в этом динамическом равновесии. В норме уровень сахара должен составлять от 2,6 до 8,4 ммоль/литр крови. В поддерживании этого уровня (помимо гипогликемических гормонов) так же принимают участие гормоны роста, глюкагон и адреналин. Они относятся у гипергликемическим гормонам.
Когда уровень глюкозы становится критически низким, начинают высвобождаться гормоны гипергликемического типа (их так же называют контринсулярными). Они стабилизируют глюкозный баланс. Очень маленький % сахара в крови называется гипогликемией. Такое состояние очень опасно для организма из-за сильного недостатка энергии и питательных веществ, которые нужны для деятельности всего организма. Крайняя степень гипогликемии — гипогликемическая кома.

Эти вещества стимулируют выделение сахара из клеточного запаса. Гормоны стресса и адреналин в том числе тормозят выброс инсулина в кровь. Таким образом и поддерживается оптимальный баланс.
Другие функции инсулина
Помимо глюкозного регулирования инсулин имеет ряд анаболических и антикатаболических эффектов;
| Анаболические | Антикатаболические |
|
|
Анаболические эффекты помогают ускорить создание и обновление некоторых клеток, тканей или мышечных структур. Благодаря им поддерживается объем мышечной массы в организме человека, контролируется энергетический баланс. Антикатаболический эффект направляется на торможение белкового распада и зажирения крови. Это так же влияет на рост мышц и % жира в организме.
Что происходит с организмом, если нет инсулина
Во-первых — нарушается транспорт глюкозы. При отсутствии инсулина не происходит активация белков, которые переносят сахар. В итоге глюкозные молекулы остаются в крови. Происходит двухстороннее негативное влияние на:
- Состояние крови. Из-за чрезмерного количества сахара она начинает загущаться. Вследствие этого могут образовываться тромбы, они преграждают кровяной поток, полезные вещества и кислород не попадают во все структуры организма. Начинается голодание и последующее отмирание клеток и тканей. Тромбоз может привести к таким серьезным заболеваниям как варикоз (в разных отделах тела), лейкоз и другим серьезным патологиям. В некоторых случаях тромбы могут создавать такое большое давление внутри сосуда, что последний разрывается.
- Обменные процессы в клетке. Глюкоза — это основной источник энергии для организма. Если её не хватает, все внутриклеточные процессы начинают тормозиться. Таким образом клетка начинает деградировать, не обновляется, не растет. Кроме того глюкоза перестает превращаться в энергетический запас и в случае недостатка энергии будут идти в расход не жировые ткани, а мышечные. Человек начнет стремительно терять вес, станет слабым и дистрофичным.
Во-вторых, нарушатся процессы анаболизма. Аминокислоты в организме начнут усваиваться хуже и из-за их недостатка будет отсутствовать плацдарм для синтеза белков и репликации ДНК. Ионы разных элементов станут поступать в клетки в недостаточном количестве, вследствие этого энергетический обмен притупится. Особенно плохо это скажется на состоянии мышечных клеток. Жир в организме плохо будет расщепляться, поэтому человек станет набирать лишний вес.
Липолиз обеспечивает самую большую выработку АТФ (энергия), когда он ингибируется — жирные кислоты превращаются не в энергию, а в жир. Так же усиливается белковый гидролиз, вследствие которого распадается белок. Его недостаток негативно сказывается на состоянии мышц.
 Эти процессы клеточного уровня практически сразу сказываются на общем состоянии организма. Человеку становится сложнее делать повседневные задачи, он ощущает головные боли и головокружения, тошноту, может терять сознание. При сильной потере веса он чувствует животный голод.
Эти процессы клеточного уровня практически сразу сказываются на общем состоянии организма. Человеку становится сложнее делать повседневные задачи, он ощущает головные боли и головокружения, тошноту, может терять сознание. При сильной потере веса он чувствует животный голод.
Недостаток инсулина может быть причиной серьезных заболеваний.
Какие болезни вызывает инсулиновый дисбаланс
Самой частой болезнью, связанной с нарушением уровня инсулина, считается сахарный диабет. Его разделяют на два типа:
- Инсулинозависимый. Причиной становится нарушение функции поджелудочной железы, она вырабатывает инсулина слишком мало или не продуцирует его вообще. В организме начинаются уже описанные процессы. Пациентам с сахарным диабетом 1 типа назначается ввод инсулина извне. Это делается посредством специальных инсулин содержащих препаратов. В них может быть инсулин животной или синтетической природы. Все эти средства представлены в виде растворов для инъекций. Чаще всего уколы ставят в область живота, плеча, лопаток или передней поверхности бедер.
- Инсулиннезависимый. Этот тип диабета характеризуется тем, что поджелудочная синтезирует достаточно инсулина, при этом ткани являются резистентными к этому веществу. Они теряют чувствительность к инсулину, вследствие чего у больного наблюдается хроническая гипергликемия. В такой ситуации регулирование уровня сахара осуществляется контролем питания. Уменьшается потребление углеводов и учитывается гликемический индекс всех потребляемых продуктов. Пациенту разрешается есть продукты только с медленными углеводами.
Существуют и другие патологии, при которых диагностируется дисбаланс природного инсулина:
- Заболевания печени (гепатиты всех типов, цирроз и другие);
- Синдром Кушинга (хронический избыток гормонов, которые продуцирует кора надпочечников);
- Избыточный вес (в том числе разные степени ожирения);
- Инсулинома (опухоль, которая непроизвольно выбрасывает в кровь лишний инсулин);
- Миотония (заболевание нервно-мышечного комплекса, при котором происходят непроизвольные движения и спазмы в мышцах);
- Избыток гормонов роста;
- Инсулинорезистентность;
- Нарушение функционирования гипофиза;
- Опухоли в области надпочечников (нарушается синтез адреналина, регулирующего уровень сахара);
- Другие заболевания поджелудочной железы (опухоли, панкреатит, воспалительные процессы, наследственные болезни и прочее).
Вызывать нарушение концентрации инсулина так же могут физические и психические истощения. Такие явления обосновываются тем, что во время этих состояний организм тратит много резервных запасов для восстановления гомеостаза. Так же причиной может быть пассивный образ жизни, разные хронические и инфекционные болезни. В запущенных случаях, связанных с неправильным функционированием инсулина, у человека может возникнуть инсулиновый шок или синдром Сомоджи (хроническая инсулиновая передозировка).
Терапия этих патологий направляется на стабилизацию уровня инсулина. Чаще всего врачи назначают препараты с животным или искусственным инсулином. Если патологическое состояние было обусловлено чрезмерным поступлением сахара в организм — назначается специальная диета. В некоторых случаях назначается гормональная терпия. Если у пациента была выявлена миома — больного направляют на операцию и курс химиотерапии.
Вывод
Инсулин — многопрофильный гормон пептидной группы, которы влияет как на клеточные, так и на генерализированные процессы. Основная его задача — регулирование углеводного баланса. Так же он контролирует энергетический и вещественный обмен в разных структурах организма. Его недостаток чреват нарушением всех этих процессов.
Дисбаланс инсулина может вызвать появление сахарного диабета и ряда других опасных патологий. Некоторые из них не поддаются лечению и остаются с человеком на всю жизнь. Сильный недостаток и избыток этого вещества в некоторых случаях может привести к летальному исходу.
Источник: PriDiabete.ru
рТЙ ЗЙРЕТЮХЧУФЧЙФЕМШОПУФЙ Л ЙОУХМЙОХ ЦЙЧПФОЩИ УМЕДХЕФ ЙУРЩФБФШ РЕТЕОПУЙНПУФШ ЙОУХМЙОБ У РПНПЭША ЛПЦОЩИ ФЕУФПЧ (Ч/Л ЧЧЕДЕОЙЕ). еУМЙ Ч/Л ФЕУФЙТПЧБОЙЕ РПДФЧЕТДЙФ ЧЩТБЦЕООХА ЗЙРЕТЮХЧУФЧЙФЕМШОПУФШ Л ЙОУХМЙОХ (БММЕТЗЙЮЕУЛБС ТЕБЛГЙС ОЕНЕДМЕООПЗП ФЙРБ — ЖЕОПНЕО бТФАУБ), ДБМШОЕКЫЕЕ МЕЮЕОЙЕ ДПМЦОП РТПЧПДЙФШУС ФПМШЛП РПД ЛМЙОЙЮЕУЛЙН ЛПОФТПМЕН. рЕТЕЧПД ВПМШОПЗП Ч УМХЮБЕ ЗЙРЕТЮХЧУФЧЙФЕМШОПУФЙ Л ЙОУХМЙОХ ЦЙЧПФОЩИ ОБ ЙОУХМЙО ЮЕМПЧЕЛБ ОЕТЕДЛП ЪБФТХДОСЕФУС ЙЪ-ЪБ ОБМЙЮЙС РЕТЕЛТЕУФОПК БММЕТЗЙЙ НЕЦДХ ЙОУХМЙОПН ЮЕМПЧЕЛБ Й ЦЙЧПФОЩИ.
рЕТЕД ЧЪСФЙЕН ЙОУХМЙОБ ЙЪ ЖМБЛПОБ ОЕПВИПДЙНП РТПЧЕТЙФШ РТПЪТБЮОПУФШ ТБУФЧПТБ. рТЙ РПСЧМЕОЙЙ ЙОПТПДОЩИ ФЕМ, РПНХФОЕОЙЙ ЙМЙ ЧЩРБДЕОЙЙ Ч ПУБДПЛ УХВУФБОГЙЙ ОБ УФЕЛМЕ ЖМБЛПОБ РТЕРБТБФ ЙУРПМШЪПЧБФШУС ОЕ НПЦЕФ.
фЕНРЕТБФХТБ ЧЧПДЙНПЗП ЙОУХМЙОБ ДПМЦОБ УППФЧЕФУФЧПЧБФШ ЛПНОБФОПК. дПЪХ ЙОУХМЙОБ ОЕПВИПДЙНП ЛПТТЕЛФЙТПЧБФШ Ч УМХЮБСИ ЙОЖЕЛГЙПООЩИ ЪБВПМЕЧБОЙК, РТЙ ОБТХЫЕОЙЙ ЖХОЛГЙЙ ЭЙФПЧЙДОПК ЦЕМЕЪЩ, ВПМЕЪОЙ бДДЙУПОБ, ЗЙРПРЙФХЙФБТЙЪНЕ, иро Й УБИБТОПН ДЙБВЕФЕ Х МЙГ УФБТЫЕ 65 МЕФ.
рТЙЮЙОБНЙ ЗЙРПЗМЙЛЕНЙЙ НПЗХФ ВЩФШ: РЕТЕДПЪЙТПЧЛБ ЙОУХМЙОБ, ЪБНЕОБ РТЕРБТБФБ, РТПРХУЛ РТЙЕНБ РЙЭЙ, ТЧПФБ, ДЙБТЕС, ЖЙЪЙЮЕУЛПЕ ОБРТСЦЕОЙЕ; ЪБВПМЕЧБОЙС, УОЙЦБАЭЙЕ РПФТЕВОПУФШ Ч ЙОУХМЙОЕ (ДБМЕЛП ЪБЫЕДЫЙЕ ЪБВПМЕЧБОЙС РПЮЕЛ Й РЕЮЕОЙ, Б ФБЛЦЕ ЗЙРПЖХОЛГЙС ЛПТЩ ОБДРПЮЕЮОЙЛПЧ, ЗЙРПЖЙЪБ ЙМЙ ЭЙФПЧЙДОПК ЦЕМЕЪЩ), УНЕОБ НЕУФБ ЙОЯЕЛГЙЙ (ОБРТЙНЕТ ЛПЦБ ОБ ЦЙЧПФЕ, РМЕЮП, ВЕДТП), Б ФБЛЦЕ ЧЪБЙНПДЕКУФЧЙЕ У ДТ. му. чПЪНПЦОП УОЙЦЕОЙЕ ЛПОГЕОФТБГЙЙ ЗМАЛПЪЩ Ч ЛТПЧЙ РТЙ РЕТЕЧПДЕ ВПМШОПЗП У ЙОУХМЙОБ ЦЙЧПФОЩИ ОБ ЙОУХМЙО ЮЕМПЧЕЛБ.
рЕТЕЧПД ВПМШОПЗП ОБ ЙОУХМЙО ЮЕМПЧЕЛБ ДПМЦЕО ВЩФШ ЧУЕЗДБ НЕДЙГЙОУЛЙ ПВПУОПЧБО Й РТПЧПДЙФШУС ФПМШЛП РПД ЛПОФТПМЕН ЧТБЮБ. уЛМПООПУФШ Л ТБЪЧЙФЙА ЗЙРПЗМЙЛЕНЙЙ НПЦЕФ ХИХДЫБФШ УРПУПВОПУФШ ВПМШОЩИ Л БЛФЙЧОПНХ ХЮБУФЙА Ч ДПТПЦОПН ДЧЙЦЕОЙЙ, Б ФБЛЦЕ Л ПВУМХЦЙЧБОЙА НБЫЙО Й НЕИБОЙЪНПЧ.
вПМШОЩЕ УБИБТОЩН ДЙБВЕФПН НПЗХФ ЛХРЙТПЧБФШ ПЭХЭБЕНХА ЙНЙ УБНЙНЙ МЕЗЛХА ЗЙРПЗМЙЛЕНЙА У РПНПЭША РТЙЕНБ УБИБТБ ЙМЙ РЙЭЙ У ЧЩУПЛЙН УПДЕТЦБОЙЕН ХЗМЕЧПДПЧ (ТЕЛПНЕОДХЕФУС ЧУЕЗДБ ЙНЕФШ У УПВПК ОЕ НЕОЕЕ 20 З УБИБТБ). п РЕТЕОЕУЕООПК ЗЙРПЗМЙЛЕНЙЙ ОЕПВИПДЙНП ЙОЖПТНЙТПЧБФШ МЕЮБЭЕЗП ЧТБЮБ ДМС ТЕЫЕОЙС ЧПРТПУБ П ОЕПВИПДЙНПУФЙ ЛПТТЕЛГЙЙ МЕЮЕОЙС.
рТЙ МЕЮЕОЙЙ ЙОУХМЙОПН ЛПТПФЛПЗП ДЕКУФЧЙС Ч ЕДЙОЙЮОЩИ УМХЮБСИ ЧПЪНПЦОП ХНЕОШЫЕОЙЕ ЙМЙ ХЧЕМЙЮЕОЙЕ ПВЯЕНБ ЦЙТПЧПК ФЛБОЙ (МЙРПДЙУФТПЖЙС) Ч ПВМБУФЙ ЙОЯЕЛГЙЙ. ьФЙИ СЧМЕОЙК Ч ЪОБЮЙФЕМШОПК УФЕРЕОЙ ХДБЕФУС ЙЪВЕЦБФШ РХФЕН РПУФПСООПК УНЕОЩ НЕУФБ ЙОЯЕЛГЙЙ. ч РЕТЙПД ВЕТЕНЕООПУФЙ ОЕПВИПДЙНП ХЮЙФЩЧБФШ УОЙЦЕОЙЕ (I ФТЙНЕУФТ) ЙМЙ ХЧЕМЙЮЕОЙЕ (II-III ФТЙНЕУФТЩ) РПФТЕВОПУФЙ Ч ЙОУХМЙОЕ. чП ЧТЕНС ТПДПЧ Й ОЕРПУТЕДУФЧЕООП РПУМЕ ОЙИ РПФТЕВОПУФШ Ч ЙОУХМЙОЕ НПЦЕФ ТЕЪЛП УОЙЪЙФШУС. ч РЕТЙПД МБЛФБГЙЙ ОЕПВИПДЙНП ЕЦЕДОЕЧОПЕ ОБВМАДЕОЙЕ Ч ФЕЮЕОЙЕ ОЕУЛПМШЛЙИ НЕУСГЕЧ (ДП УФБВЙМЙЪБГЙЙ РПФТЕВОПУФЙ Ч ЙОУХМЙОЕ).
вПМШОЩЕ, РПМХЮБАЭЙЕ ВПМЕЕ 100 ед ЙОУХМЙОБ Ч УХФЛЙ, РТЙ УНЕОЕ РТЕРБТБФБ ФТЕВХАФ ЗПУРЙФБМЙЪБГЙЙ.
Источник: www.webapteka.ru
Почему поджелудочная перестает вырабатывать инсулин?
Иммунная система помогает человеку бороться с вирусами, микробами, уничтожает чужеродные клетки, в том числе и раковые, которые могут образовываться в процессе жизни человека. Происходит постоянное обновление клеток в разных органах: старые гибнут, а новые образуются, замещая их.

Это касается и бетта-клеток поджелудочной железы. Иммунитет в норме хорошо различает «свои» клетки от «чужеродных».
У пациентов с диабетом 1 типа происходит «поломка» в иммунитете, и организм начинает воспринимать собственные клетки как чужие, и убивает их.
Наследственность и действие окружающей среды (чаще всего вирусы) изменяют свойства β-клеток.
Выделяют ряд причин, почему поджелудочная железа не вырабатывает инсулин.

Происходят следующие процессы:
- Выделяются аутоантигены.
- Клетки иммунной системы (макрофаги МФ, дендритные клетки ДК) передают переработанные аутоантигены Т-лимфоцитам, которые, в свою очередь, начинают воспринимать их как чужеродные.
- Часть Т-лимфоцитов, превратившихся в специфические цитотоксические аутоагрессивные лимфоциты (ЦТЛ).
- Развивается воспаление поджелудочной железы и разрушение β-клетки.
Этот процесс длительный и протекает с различной скоростью: от нескольких месяцев у маленьких детей до нескольких лет у взрослых.

По данным научных исследований, у людей с наследственной предрасположенностью к сахарному диабету 1 типа уже за несколько лет до начала заболевания в крови определяются специфические антитела (IAA, ICA, GADA, IA-2β), которые, не разрушая β-клетку, являются ранними маркерами риска развития СД 1 типа.
К сожалению, в иммунной системе сохраняется память к антигенам β-клеток, поэтому процесс их разрушения очень трудно остановить.
Учёные считают, что при диабете 1 типа бетта-клетки могут восстанавливаться. Даже при гибели 90 % процентов всех бетта-клеток из оставшихся 10 % может произойти восстановление. Однако для этого необходимо остановить «агрессивную» реакцию иммунной системы. Только тогда станет возможным излечение от этой болезни.

Только введение инсулина может быть настоящим лечением сахарного диабета 1 типа.
Некоторые исследования были направлены на изучение возможности остановить «агрессивное поведение» иммунной системы по отношению к бетта-клеткам путём применения нескольких групп препаратов. Однако достоверных положительных результатов получено не было.
Большую надежду учёные связывают с возможностью применения моноклональных антител, способных изменить агрессивный иммунитет в благоприятную сторону, т. е. снизить аутоиммунную реакцию в поджелудочной железе.
Эти исследования являются очень перспективными, поскольку в случае отсутствия контроля над иммунитетом даже пересадка островков Ларгенганса и применение стволовых клеток будут бессмысленны.
Работа инсулина
Основная функция гормона заключается в том, что он связывается с рецептором на клетке (специальный датчик узнавания). Если узнавание произошло («ключ подошел к замку»), то клетка становится проницаемой для глюкозы.

Выработка инсулина начинается уже тогда, когда мы видим еду и ощущаем ее запах. По мере переваривания пищи, высвобождения из нее глюкозы и попадания ее в кровь, бетта-клетки увеличивают выработку инсулина, поэтому, у здоровых людей уровень сахара крови всегда сохраняется в пределах нормы и не зависит от того, сколько сладкого они съели.
Инсулин отвечает за попадание глюкозы в так называемые «инсулинозависимые ткани»: печень, мышцы, жировая ткань.
Организму необходимо немного инсулина даже в ночное время и в периоды голода, чтобы обеспечить усвоение глюкозы, образующейся в печени. Такой инсулин называют базальным или фоновым.

Существует еще болюсный инсулин. Это то количество гормона, которое вырабатывается в ответ на прием пищи.
Помните, необходимо научиться рассчитывать и вводить себе дозу инсулина в зависимости от количества принятой пищи. Поэтому так важно обучение при сахарном диабете 1 типа. Без знаний о своей болезни и правилах поведения адекватное лечение практически невозможно.
Очень важно также оценивать потребность в инсулине. У человека без диабета вырабатывается приблизительно 0,5 ЕД инсулина на кг массы тела каждый день. Для взрослого с массой тела 70 кг получаем 70*0,5=35 ЕД в сутки.
| Период | Доза инсулина |
|---|---|
| Дети до полового созревания | 0,7–1,0 ЕД/кг/день (Обычно ближе к 1 ЕД/кг/день) |
| Период полового созревания | Мальчики – 1,1–1,4 ЕД/кг/день (иногда даже больше)
Девочки – 1,0–1,2 ЕД/кг/день |
| Подростки | Девушки – меньше 1 ЕД/кг/день
Юноши – примерно 1 ЕД/кг/день |
| Взрослые | 0,7 – 0,8 ЕД/кг/день |
У большинства пациентов через 1–3 года от момента возникновения потребность в инсулине стабилизируется и составляет 0,7–1,0 ЕД/кг.
Чувствительность к инсулину
Чувствительность организма к гормону важна для определения того, насколько конкретная доза инсулина снизит уровень сахара крови. К сожалению, одна и та же доза инсулина не всегда оказывает одинаковый эффект на снижение глюкозы крови.
Определенные факторы повышают чувствительность к инсулину, другие причины – уменьшают.

Инсулинорезистентность означает, что требуется большее количество инсулина, чтобы поучить такой же эффект снижения сахара крови. Другими словами, происходит уменьшение чувствительности к инсулину.
Давно известно, какая железа вырабатывает инсулин. Но что еще, кроме поджелудочной железы, вырабатывает инсулин в организме человека?
В последние годы пристальный интерес вызываю вещества инкретины – это гормоны, секретируемы клетками желудочно-кишечного тракта и стимулирующие действие инсулина.
Наиболее изучены:
- Глюкагоноподобный пептид-1 (ГПП-1);
- Глюкозозависимый инсулиноподобный пептид (ГИП).
Последнее вещество оказывает эффект, сравнимый с действием инсулина.
Основные эффекты инкретинов:
- увеличивают синтез инсулина после еды;
- улучшают потребление глюкозы клетками, что приводит к снижению сахара крови.
Существуют данные, что у пациентов с диабетом данное вещество продолжает синтезироваться в прежних количествах, в то время, как бетта-клетки гибнут. Проблема состоит в том, что инкретины очень быстро распадаются под действием собственных ферментов организма.
Источник: clinica-opora.ru
Инсулиновый препарат это что?
Что такое вещество инсулин? Инсулин это важный гормон. В медицине гормонами называются вещества, их молекулы, которые выполняют в организме функции связи между органами, способствуют обмену веществ. Как правило, вырабатываются эти молекулы различными железами.
Инсулин у человека, зачем он нужен? Роль инсулина в организме человека весьма существенна. В нашем организме все продумано до мелочей. Многие органы выполняют сразу несколько функций. Каждое вещество выполняет важные задачи. Без любого из них нарушается самочувствие и здоровье человека. Гормон инсулин поддерживает нормальное содержание глюкозы. Глюкоза необходима человеку. Она является основным источником энергии, обеспечивает возможность человека совершать физическую и умственную работу, дает возможность органам тела выполнять свои задачи. Исчерпывается ли функция инсулина в нашем организме только этим? Давайте разбираться.
Основанием гормона является белок. Химическая формула гормона определяет, на какие органы он будет влиять. По кровеносной системе гормоны проникают в нужный орган.
Строение инсулина основано на том, что это пептидный гормон, состоящий из аминокислот. Молекула включает в себя 2 полипептидные цепи — A и B. У цепи A аминокислотный остаток 21, у цепи B — 30. Знание структуры гормона позволило ученым создать искусственный препарат для борьбы с диабетом.

Где вырабатывается гормон?
Какой орган вырабатывает инсулин? Выработка человеческого гормона инсулина осуществляется поджелудочной железой. Та часть железы, которая ответственна за гормоны, называется островками Лангерганса-Соболева. Эту железу включают в пищеварительную систему. В поджелудочной железе вырабатывается пищеварительный сок, который участвует в переработке жиров, белков и углеводов. Работа железы состоит в:
- выработке ферментов, с помощью которых усваивается пища;
- нейтрализации кислот, содержащихся в перевариваемой пище;
- снабжении организма необходимыми веществами (внутренняя секреция);
- переработке углеводов.
Поджелудочная железа самая крупная из всех желез человека. По функциям она делится на 2 части — большая часть и островки. Большая часть участвует в пищеварительном процессе, островками вырабатываются описываемый гормон. Так же островками кроме искомого вещества вырабатывается глюкагон, который тоже регулирует поступление глюкозы в кровь. Но если инсулин ограничивает сахаросодержание, то гормоны глюкагон, адреналин и соматотропин увеличивают его. Искомое вещество в медицине называют гипогликемическим. Это иммунореактивный инсулин (ИРИ). Теперь понятно, где вырабатывается инсулин.

Работа гормона в организме
Поджелудочная железа направляет инсулин в кровь. Инсулин человеческий снабжает клетки организма калием, рядом аминокислот и глюкозой. Он регулирует углеводный обмен, снабжает все наши клетки необходимым питанием. Влияя на углеводный обмен, он регулирует и метаболизм белков и жиров, поскольку при нарушении метаболизма углеводов страдают и другие обменные процессы.
Как действует инсулин? Действия инсулина на наш организм заключаются в том, что он влияет на большинство вырабатываемых организмом ферментов. Но все же, основная его функция — поддержка уровня глюкозы в пределах нормы. Глюкоза является источником энергии человека и отдельных его органов. Иммунореактивный инсулин помогает ей усвоиться и преобразоваться в энергию. Функции инсулина можно определить следующим перечнем:
- Он содействует проникновению глюкозы в клетки мышц и жировых тканей и аккумулированию глюкозы на клеточном уровне.
- Он увеличивает пропускаемость мембран клеток, что способствует проникновению в клетки нужных веществ. Молекулы, которые наносят вред клетке, выводятся через мембрану.
- Благодаря этому гормону в клетках печени и в мышцах появляется гликоген.
- Гормон поджелудочной железы способствует процессу, в котором образуется белок и накапливает их в организме.
- Он способствует жировым тканям в получении глюкозы и преобразовании ее в запасы жира.
- Помогает ферментам усилить разрушение молекул глюкозы.
- Мешает другим ферментам, которые стремятся разложить жиры и полезный организму гликоген.
- Способствует синтезу рибонуклеиновой кислоты.
- Помогает образованию гормона роста.
- Препятствует образованию кетоновых тел.
- Подавляет расщепление липидов.
Действие инсулина распространяется на каждый обменный процесс организма. Основные эффекты инсулина заключаются в том, что он один противостоит гипергликемическим гормонам, которых у человека намного больше.
Как происходит образование гормона
Механизм действия инсулина следующий. Инсулин вырабатывается при повышении концентрации в крови углеводов. Любая съеденная нами пища, попав в пищеварительную систему, запускает выработку гормона. Это может быть белковая или жировая пища, а не только углеводная. Если человек плотно покушал, содержание вещества повышается. После голодания его уровень падает.
Еще инсулин в организме человека вырабатывается благодаря другим гормонам, а также некоторым веществам. К ним относятся калий и необходимый для здоровья костей кальций. Ряд жирных аминокислот тоже стимулируют выработку гормона. Обратное действие оказывает соматотропин, который способствует росту человека, и в какой-то степени соматостатин.
Достаточно ли у человека инсулина, это можно определить, сделав анализ венозной крови на количество глюкозы. В моче глюкозы быть не должно, иные результаты говорят о заболевании.

Нормальный уровень глюкозы, его превышение и снижение
Кровь «на сахар», как повелось говорить, сдают утром натощак. Нормой количества глюкозы считается от 4,1 до 5,9 ммоль/л. У малышей она ниже — от 3,3 до 5,6 ммоль/л. У пожилых людей сахара больше — от 4,6 до 6,7 ммоль/л.
Чувствительность к инсулину у всех разная. Но, как правило, превышение уровня сахара свидетельствует о недостатке вещества или о других патологиях эндокринной системы, печени, почек, о том, что не в порядке поджелудочная железа. Его содержание увеличено при инфаркте и инсульте.
О патологиях перечисленных органов может говорить и снижение показателя. Мало глюкозы бывает у пациентов, злоупотребляющих алкоголем, у подвергающихся слишком большим физическим нагрузкам, у увлекающихся диетами, у голодающих людей. Снижение содержания глюкозы может говорить о нарушении обмена веществ.

Недостаток гормона можно определить до обследования по характерному запаху ацетона изо рта, который возникает из-за кетоновых тел, не подвергающихся подавлению с помощью этого вещества.
Уровень гормона в организме
Инсулин в крови по количеству не отличается у детей и взрослых. Но на нее оказывает влияние прием разнообразной пищи. Если пациент ест много углеводных продуктов, содержание гормона увеличивается. Поэтому анализ на инсулин в крови лаборант делает после не менее 8-часового воздержания от приема пищи пациентом. Перед анализом нельзя колоть себе гормон, иначе исследование будет не объективно. Тем более, что чувствительность к инсулину может подвести пациента.
Повышенное содержание гормона
Действие инсулина на человека зависит от его количества в крови. Превышение гормоном нормы может говорить о:
- Наличии инсулиномы — новообразования на островках поджелудочной железы. Значение наличия глюкозы в этом случае понижено.
- Заболевании инсулиннезависимым сахарным диабетом. В этом случае постепенно начинается уменьшение уровня гормона. А количество сахара — расти.
- Ожирении пациента. Тут трудно отличить причину от следствия. Вначале повышенный гормон способствует откладыванию жиров. Он повышает аппетит. Затем ожирение способствует повышению содержания вещества.
- Заболевание акромегалией. Оно заключается в нарушении функций передней доли гипофиза. Если человек здоров, то понижение содержания гормона вызывает рост содержания соматотропина. При акромегалии такого не происходит. Хотя надо делать скидку на разную чувствительность к инсулину.
- Появление синдрома Иценко-Кушинга. Это состояние, при котором отмечается повышение содержания в организме глюкокортикоидных гормонов надпочечников. При нем увеличивается пигментация кожи, усиливаются белковый и углеводный обмены, снижается жировой обмен. При этом из организма выводится калий. Повышается артериальное давление и происходит множество других неприятностей.
- Проявлении дистрофии мышц.
- Беременности, протекающей с повышением аппетита.
- Непереносимость фруктозы и галактозы.
- Болезни печени.
Снижение гормона в крови говорит о сахарном диабете 1 или 2 типа:
- 1-ый тип диабета — выработка инсулина в организме понижена, уровень глюкозы повышен, наблюдается присутствие сахара в моче.
- 2-ой тип — гормон повышен, глюкоза в крови тоже выше нормы. Это происходит, когда организм теряет чувствительность к инсулину, как бы не замечает его присутствия.

Сахарный диабет — грозное заболевание, когда у человека нет энергии для функционирования всех органов в штатном режиме. Болезнь распознать просто. Врач обычно назначает комплексное лечение — лечит поджелудочную железу, которая не справляется со своими функциями, и одновременно искусственно повышает уровень гормона в крови с помощью инъекций.
При диабете 2-го типа падает чувствительность к инсулину, а повышенный показатель может привести к образованию холестериновых бляшек в сосудах ног, сердца и мозга. При нем повреждаются нервные волокна. Человеку грозит слепота, инсульт, инфаркт, почечная недостаточность, необходимость ампутировать ногу или руку.

Виды гормона
Влияние инсулина на организм используется при врачевании. Лечение при сахарном диабете назначает врач после исследования. Какой тип диабета поразил больного, какие у него есть личные особенности, аллергия и непереносимость лекарственных препаратов. Зачем нужен инсулин при диабете, понятно — снизить уровень глюкозы.
Типы инсулинового гормона, которые назначают при диабете:
- Быстродействующий инсулин. Его действие начинается через 5 минут после инъекции, но быстро заканчивается.
- Короткий. Что это такое за гормон? Он начинает действовать позже — через полчаса. Но помогает в течение более длительного времени.
- Средней длительности. Определяется по воздействию на больного сроком около полусуток. Часто его вводят вместе с быстрым, чтобы больной сразу почувствовал облегчение.
- Длинного действия. Этот гормон действует в течение суток. Его вводят с утра на голодный желудок. Тоже часто применяют вместе с гормоном быстрого действия.
- Смешанный. Он получается путем перемешивания гормона быстрого действия и среднего действия. Предназначен для людей, которые затрудняются сами смешать 2 гормона разного действия в нужной дозировке.
Как работает инсулин, мы рассмотрели. Каждый человек по-разному реагирует на его инъекцию. Это зависит от системы питания, занятий физкультурой, от возраста, пола, сопутствующих заболеваний. Поэтому больной сахарным диабетом должен находиться под непрерывным наблюдением врача.
Источник: GormonyTela.ru
