
Говоря об учёных XIX – начала XX веков, я неизменно поражаюсь тому, насколько обширны были области их исследовательских интересов и притязаний. Тем не менее каждый из великих мира сего имел определённые заслуги, благодаря которым человечество особенно выиграло и шагнуло вперёд в понимании тех или иных законов природы. И вот, когда речь заходит о великом русском физиологе (иммунологе, биологе, эмбриологе и далее по списку) Илье Мечникове, я каждый раз невольно представляю его себе воином на коне, ведущим за собой армию макрофагов, ибо именно этот человек первым осознал роль данных клеток, присущих всем организмам от эхинодермы до позвоночных. Позднее, в 1960-х годах, уже ван Фурт и Кон определили систему мононуклеарных фагоцитов как общность агранулярных миелоидных клеток, которые, как нам теперь известно, играют важнейшую роль в обновлении тканей, поддержании гомеостаза и стимуляции и регуляции как врождённого, так и приобретённого иммунитета. Вообще в систему мононуклеарных фагоцитов входят клетки трёх типов: полностью дифференцированные макрофаги и дендритные клетки (которые, в свою очередь, тоже подразделяются на множество субпопуляций), а также моноциты.
Под, собственно, моноцитами понимают циркулирующие клетки крови, составляющие около 10% всех лейкоцитов периферической крови человека. В кровеносное русло моноциты поступают из костного мозга, где и развиваются из общей для агранулоцитов и гранулоцитов миелоидной клетки-предшественницы. Не в последнюю очередь по причине непродолжительности пребывания моноцитов в циркулирующей крови (около 3-х суток у человека) данная среда считается резервуаром миелоидных предшественников, обеспечивающих постоянное обновление пула тканевых макрофагов и, в частности, короткоживущих дендритных клеток.

Изначально моноциты, циркулирующие с кровью, пытались классифицировать, основываясь на клеточной морфологии и их удельной плотности. Однако данные характеристики довольно разнородны и не обладают должной специфичностью, поэтому различать моноциты исключительно по гистологическим признакам весьма затруднительно. Первые мысли о том, что, вероятно, моноциты могут быть подразделены на подтипы, которым присущи различные физиологические признаки, закрались тогда, когда были выявлены две первые субпопуляции моноцитов, отличающихся как по морфологии, так и по дифференциальной экспрессии антигенных маркеров – CD14 и CD16.
етки с фенотипом CD14hi CD16 относят к классическим моноцитам, поскольку высокий уровень экспрессии CD14 и экспрессия CD16 были характерны для впервые описанных моноцитов. Второй основной подтип моноцитов характеризуется, помимо экспрессии CD14 и CD16 (обозначаются как CD14+ CD16+), повышенным уровнем молекул главного комплекса гистосовместимости II класса и CD32 (также известен как FcγRII), в связи с чем было высказано предположение, что данные клетки похожи на зрелые тканевые макрофаги. Помимо различий в степени экспрессии основных антигенных маркеров, оба вышеописанных подтипа моноцитов проявляют различия относительно экспрессии хемокиновых рецепторов (например, моноциты CD14hi CD16 экспрессируют С-С рецептор хемокина 5 (CCR5), тогда как для CD14+ CD16+ характерна экспрессия CCR2). Тем не менее при культивировании обоих подтипов моноцитов в присутствии GM-CSF и IL-4 и те, и другие дифференцируются до дендритных клеток. А в экспериментах in vitro с использованием модели трансэндотелиальной миграции мононуклеарные клетки, изолированные из периферической крови при инкубации с монослоем эндотелиальных клеток пупочной вены человека на коллагеновой матрице, мигрировали, минуя эндотелиальный барьер, и дифференцировались в макрофаги, которые оставались в субэндотелиальном матриксе либо превращались в дендритные клетки, мигрирующие обратно сквозь слой эндотелиоцитов.
Моноциты крови берут свои истоки в костном мозге, образуясь из гемопоэтических стволовых клеток путём последовательного коммитирования и дифференцировки предшественников. Первейшими клетками, с которых начинается путь дифференцировки до моноцитов, являются общая миелоидная клетка-предшественница и гранулоцитарно-макрофагальный предшественник. Кроме того, в 2006 году были описаны специфические клоногенные предшественники, обнаруженные в костном мозге, которые, в отличие от гранулоцитарно-макрофагальных предшественников, не дают начало гранулоцитарному, лимфоидному, эритроидному или мегакариоцитарному росткам, а обеспечивают прирост лишь нескольких подвидов макрофагов и резидентных дендритных клеток. Сообразно тому, каким клеткам дают начало такие предшественники, они и были названы предшественниками макрофагальных и дендритных клеток (MDP), всё просто. Микроокружение костного мозга потенцирует MDP к дифференцировке в моноциты, которые впоследствии выходят в кровь.
С точки зрения эволюции, система приобретённого иммунитета млекопитающих представляет собой венец всевозможных иммунных реакций с позиции её сложности и молекулярной специфичности. В отличие от клеток, относящихся к системе врождённого иммунитета и распознающих типичные мотивы, ассоциированные с широким спектром патогенов, за счёт рецепторов, кодируемых множественными зародышевыми генами, клетки системы приобретённого иммунитета могут быть обеспечены практически неиссякаемым разнообразием антиген-распознающих рецепторов, что происходит благодаря одному из механизмов соматической рекомбинации (V(D)J-рекомбинация), который, кроме прочего, является основой существования иммунологической памяти у клеток за счёт дифференцировки, распространения и поддержания персистенции долгоживущих антиген-специфических лимфоцитов.
ляясь прямыми эффекторами системы иммунитета и реализуя цитотоксические свойства, а также продуцируя антитела, лимфоциты в то же время выполняют и роль ключевого регулятора иммунного ответа, усиливая или ослабляя его, оказывая влияние на различные типы клеток по механизму положительной или отрицательной обратной связи.
Разберём чуть подробнее механизм рекомбинации, благодаря которому становится возможным разнообразие антиген-распознающих рецепторов у лимфоцитов. V(D)J-рекомбинация служит основой разнообразия В-клеточных рецепторов вследствие того, что в формирующихся В-клетках гены, кодирующие тяжёлые и лёгкие цепи иммуноглобулинов, составляются из нескольких различных генных сегментов. Развитие В-лимфоцитов начинается в печени у плода с дифференцировки плюрипотентных гемопоэтических стволовых клеток (ГСК) и происходит впоследствии в костном мозге.
ГСК дифференцируются до прогениторных В-клеток, которые при помощи фактора транскрипции Pax5 достигают стадии зрелых В-клеток и приобретают поверхностный маркер c-kit, а также CD19, характерный для всех стадий дифференцировки В-лимфоцитов, кроме плазматических клеток.
енно на стадии прогениторных В-клеток осуществляется соматическая рекомбинация ДНК в локусе тяжёлой цепи иммуноглобулинов (IgH-локус), что заключается в образовании функционального VDJ-экзона, состоящего из V- (variable), D- (diversity) и J- (joining) сегментов. Данный экзон кодирует V-регион тяжёлой цепи иммуноглобулина и образует совместно с V-регионом лёгкой цепи антигенсвязывающий участок мембраносвязанных В-клеточных рецепторов. V(D)J-рекомбинация в IgH-локусе протекает в 2 этапа, для чего данный участок ДНК прежде претерпевает модификационные преобразования хроматина и только потом становится доступным для изменений: сначала на этапе ранних прогениторных клеток в обоих аллелях путём негомологичной рекомбинации объединяются D и JH-сегменты, а затем, уже в поздних прогениторах В-клеток, становится доступным для взаимодействия VH-сегмент, расположенный сразу после вышеупомянутых участков, и при сокращении локуса VH-сегмент присоединяется к уже реаранжированным сегментам D и J. Безусловно, сложный процесс V(D)J-рекомбинации требует участия многочисленных ферментов, среди которых стоит назвать RAG1 и RAG2 (Recombination-activating Genes 1 and 2), специфичные для лимфоцитов, а также присущие всем клеткам ферменты и системы репарации двойных разрывов ДНК, такие как Ku70, Ku80, XRCC4, ДНК-лигаза IV, ДНК-зависимые протеинкиназы (DNA-PK), Artemis.
RAG распознают специфические рекомбинационные сигнальные последовательности (RSS – recombination signal sequences), окружающие сегменты генов иммуноглобулинов, и инициируют V(D)J-рекомбинацию, разрывая обе цепочки ДНК между сегментами генов Ig и находящимися по соседству от них RSS.
ободные 3’-OH концы сегментов связываются с комплементарными цепями, образуя шпилечные структуры (их называют кодирующими соединениями, Coding Joint), а RSS соединяются своими свободными концами и формируют сигнальные соединения – Signal Joint. Получившиеся шпилечные структуры снова раскрываются с помощью эндонуклеазы Artemis за счёт разрыва одной из цепей, а после процессинга экзонуклеолитические свойства Artemis и полимераз обеспечивают соединение генных сегментов друг с другом с формированием тупых концов ДНК. Важно обратить внимание на тот момент, что шпилечные структуры не должны раскрываться в тех же самых местах (на уровне тех же оснований), где изначально произошло их объединение, а потому лежащая между ними нуклеотидная последовательность может быть отзеркалена, в результате чего образуются палиндромные нуклеотиды (Р-нуклеотиды).
Разнообразие возможных сочетаний сегментов (помимо рекомбинаторного разнообразия) увеличивается как раз за счёт Р-нуклеотидов, а также за счёт случайным образом добавляемых терминальной дезоксинуклеотидилтрансферазой нешаблонных нуклеотидов. Чтобы обеспечить непосредственно рекомбинацию V и D / D и J сегментов, RSS задействованных в рекомбинации участков различаются. Между относительно консервативными гепта- и нонамерными последовательностями (CACAGTG и ACAAAAACC соответственно), встречающимися во всех RSS, располагаются спейсерные последовательности, которые у RSS сегментов V и J составляют 23 пары оснований, а в пределах RSS, ограничивающих с двух сторон сегмент D, спейсеры охватывают 12 пар оснований.
ким образом, за счёт наличия спейсеров предотвращается прямое взаимодействие между сегментами V и J в IgH-локусе, поскольку V(D)J-рекомбинация осуществляется по большому счёту почти исключительно между RSS со спейсерами различной длины (правило 12/23).
После перестройки сегментов гена, ответственных за структуру тяжёлой цепи иммуноглобулина, происходит непосредственно её синтез. Получившиеся тяжёлые цепи связываются с суррогатными лёгкими цепями, состоящими из белков VpreB и λ-подобного белка, и сигнальными молекулами Igα и Igβ, формируя вместе рецепторный комплекс пре-В. Данный комплекс перемещается на поверхность клетки, где он способен воспринимать и проводить сигналы, способствующие дифференцировке клеток в ранние пре-В-лимфоциты и их клональной экспансии. Кроме того, сигналы, проводимые посредством пре-В комплекса, ингибируют рекомбинацию в IgH-локусе.

Рис. 2. RAG-опосредованные перестройки генных сегментов.
Иногда же V(D)J-рекомбинация не обходится без ошибок и бывает так, что происходит смещение рамки считывания вследствие дополнительно встроенных Р- или N-нуклеотидов или, наоборот, из-за их выпадения. В таких случаях получившийся VDJ-экзон оказывается нефункционален, и рекомбинация продолжается во втором аллеле гена. Если и вторая перестройка не удаётся, то в таком про-В-лимфоците не осуществляется проведения сигналов, позволяющих клетке жить и продолжать дифференцировку, и запускается её апоптоз.
Но вернёмся к нормальным клеткам, для которых рекомбинация в IgH-локусе завершилась образованием продуктивного VDJ-экзона и синтезом способной к связыванию тяжёлой цепи. Экспрессия рецепторного комплекса пре-В неизменно означает для такой клетки переход к стадии раннего прекурсора В-лимфоцитов, что сопровождается потерей клеткой маркера c-kit и прекращением экспрессии терминальной дезоксинуклеотидилтрансферазы. Кроме того, активность RAG1 и RAG2 временно прекращается. Вместо этого ранние пре-В-лимфоциты экспрессируют CD25 и вступают в непродолжительную пролиферационную фазу, охватывающую 4-6 циклов клеточного деления, цель которой состоит в увеличении количества пре-В-лимфоцитов, обладающих функционально активными IgH-цепями, способными формировать комплексы с IgL-цепями. Подобная селективная клональная экспансия пре-В-клеток вносит существенный вклад в расширение спектра Ig, поскольку каждая новая клеточка-предшественница будущего В-лимфоцита имеет свою собственную, не похожую на другие L-цепь, а следовательно, приобретает и Ig-рецептор с новой, характерной только данной клетке специфичностью.
Если быть совсем точным, то клональная экспансия ранних прекурсоров ведёт к их дифференцировке в мелкие покоящиеся пре-В-лимфоциты, в которых по аналогии с перестановками в IgH-локусе передислоцируются κ- и λ-локусы лёгких цепей иммуноглобулинов; после перестройки гена IgL синтезируется IgL-цепь, которая, объединяясь с IgH-цепью, становится частью В-клеточного рецептора, необходимого для перехода клетки на стадию незрелого В-лимфоцита. После того, как полный В-клеточный рецептор экспрессируется на поверхности клетки, незрелые В-лимфоциты подвергаются негативной селекции, в ходе которой их рецепторы проходят проверку на аутоагрессию. Выявленные клетки с аутоагрессивными свойствами могут быть апоптотически уничтожены, а могут и избавиться от аутореактивных рецепторов, будучи вовлечёнными в процесс вторичной перестройки Ig-локусов их рецепторов.
Итак, ткани и органы лимфатической системы, находясь в тесной взаимосвязи между собой, обеспечивают организму защиту от чужеродных агентов. Говоря непосредственно о системе приобретённого иммунитета, первое, о чём стоит упомянуть, это антигенпрезентирующие клетки, которые мигрируют из очага инфекции в ближайшие регионарные лимфоузлы, где презентируют микробные антигены интактным Т-клеткам. Сталкиваясь с «распознанным» антигенпрезентирующими клетками антигеном, интактные Т-клетки начинают активно делиться, в результате чего в течение нескольких дней происходит дифференцировка как эффекторных Т-лимфоцитов, которые направляются в очаг инфекции и занимаются элиминацией чужеродных агентов, так и Т-клеток памяти, которые, персистируя в кровеносном русле, готовы поддержать иммунный ответ на вторичную инфекцию.
Собственно, поэтому лимфоциты, как правило, рассматривают как клетки, характерные для лимфоидных органов и циркулирующие в крови, однако, не стоит забывать, что существуют также резидентные типы лимфоцитов, присутствующие в нелимфоидных тканях (особенно это касается кожи и слизистых оболочек). К специализированным резидентным тканевым лимфоцитам относятся лимфоидные клетки врождённого иммунного ответа (innate lymphoid cells; ILC), тканевые Т-клетки памяти (tissue-resident memory T cells; TRM), а также особые типы Т-лимфоцитов, такие как инвариантные естественные киллеры (iNKT), инвариантные Т-лимфоциты, ассоциированные со слизистыми (MAIT-клетки), γδ T-клетки и интраэпителиальные лимфоциты (IEL) CD8aa+.

Рис. 3. Тканевые и циркулирующие лимфоциты и их функции.
Чтобы яснее представлять себе роль тканерезидентных лимфоцитов, обратимся к тому, чем же эти клетки отличны от тех, что циркулируют с током крови. Первое, что стоит упомянуть – это их способность к самообновлению вне зависимости от циркулирующих прекурсоров. Значительная часть пула тканевых лимфоцитов концентрируется в барьерных тканях. Также важным свойством данных клеток является широкий спектр микробных антигенов и сигналов от других клеток организма, которые они способны распознавать и воспринимать, получая тем самым информацию о воспалении, развитии инфекционного процесса и повреждении тканей.
Активация тканевых лимфоцитов осуществляется при помощи полуинвариантных антигенных рецепторов, NK-активирующих рецепторов и рецепторов аларминов и цитокинов. Полуинвариантные рецепторы, присущие iNKT-клеткам, напоминают паттерн-распознающие рецепторы и узнают гликолипиды, обладающие α-аномерной гликозидной связью, кои нередко характерны для патогенных бактерий и могут непосредственно запускать сигнальные внутриклеточные реакции после связывания с данными рецепторами. Тем не менее даже в отсутствие мощных микробных антигенов Т-лимфоциты могут быть активированы низкоаффинными эндогенными лигандами, конкурентно стимулируемыми цитокинами, как правило, IL-12 и IL-18. Это наталкивает на размышления о том, что активация iNKT не обязательно сопровождает инфекционные процессы, а может быть вызвана также в ответ на метаболический стресс, характеризующийся нарушением синтеза и обмена гликолипидов.
Для некоторых субпопуляций интраэпителиальных лимфоцитов также характерна реакция на эндогенные лиганды, сопряжённые с нарушением обменных процессов в тканях. И наконец, заключительной особенностью тканерезидентных лимфоцитов является их способность к быстрой реакции на активирующие сигналы, что выражается в массированной секреции антимикробных факторов (цитокинов, цитолитических молекул, факторов роста). Не меньшее значение имеет и экспрессия тканевыми лимфоцитами некоторых транскрипционных факторов, например, PLZF. В экспериментах на мышах у тех особей, у которых наблюдался дефицит экспрессии PLZF, было отмечено резкое снижение количества iNKT и MAIT-клеток, а имеющиеся клетки проявляли нарушения функций и локализации.


Рис. 5. Обобщенное представление об эффекторных функциях тканерезидентных лимфоцитов.
На этом завершим наш небольшой обзор агранулоцитов. Их сложные взаимоотношения и многогранный вклад в развитие иммунных реакций, разумеется, все еще вызывают у вас немало вопросов, на которые, надеюсь, вы тут же отправитесь искать ответы.
Источники:
- Xiying Fan, Alexander Y. Rudensky Hallmarks of Tissue-Resident Lymphocytes, Cell, 2016
- Siamon Gordon, Philip R. Taylor Monocyte and macrophage heterogeneity, Nature Reviews Immunology, 2005
- Simon Yona, Steffen Jung Monocytes: subsets, origins, fates and functions, Current opinion in hematology, 2010
- Bassing, C. H., W. Swat, et al. The mechanism and regulation of chromosomal V(D)J recombination, Cell, 2002
Источник: medach.pro
Два вида лейкоцитов
Все лейкоциты делятся на зернистые (их ещё называют гранулоциты) и гладкие (они же — агранулоциты).
Зернистые лейкоциты таскают в себе кучу «зёрен». Каждое зерно содержит в себе множество агрессивных биологически активных веществ. Представьте себе солдата со связкой бомб, каждая из которых начинена серной кислотой — вот примерно так и выглядят гранулоциты. «Бомбы» гранулоцитов не содержат серную кислоту, однако там немало других агрессивных веществ и ферментов, буквально разъедающих органику.
Совсем другое дело — гладкие лейкоциты. По-научному их называют «агранулоциты», то есть «клетки без гранул». Они не таскают на себе каких-либо снарядов, однако, они также отлично умеют воевать, просто действуют более изощренно и хитро. Об этом мы также поговорим.
А пока что рисуем главное разделение лейкоцитов:
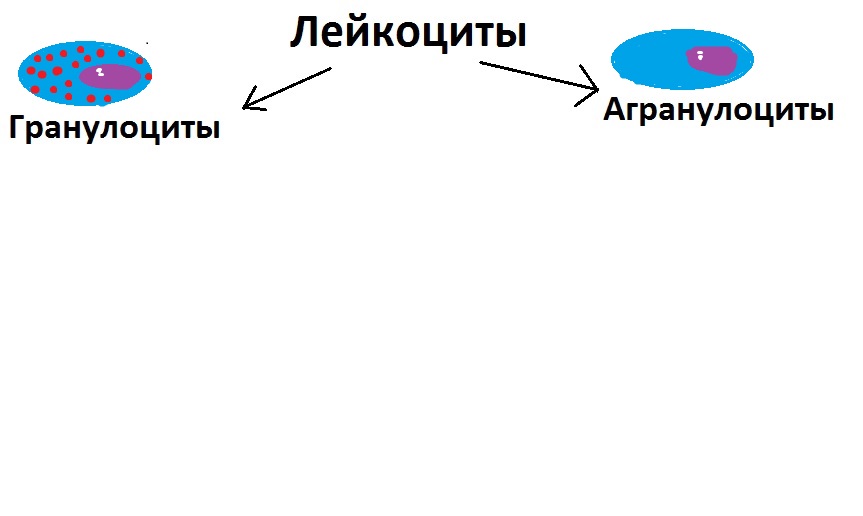
Гранулоциты
Отлично, теперь давайте рассмотрим зернистые лейкоциты (то есть гранулоциты). Они разделятся на три основных подкласса: нейтрофилы, базофилы и эозинофилы.
Эти сложные названия происходят из окраски. Если мы красим по методу Романовского-Гимзе зернистые лейкоциты могут окрасится синим, то есть основным красителем, и тогда мы назовём их базофилы. Другие лейкоциты окрасятся только кислым эозинофильным красителем (он красного цвета), и мы назовём их эозинофилы. Третьи слегка окрашиваются и тем и тем, то есть они нейтральные — не основные и не кислые. Посему мы их назовём нейтрофилы.
Нейтрофилы, несмотря на их название, вовсе не являются нейтральной стороной в случае атаки на наш организм чужеродных агентов. Они неистово кидаются на врага, например, на бактерии, разрывают их на части и пожирают. Правда, они при этом погибают сами. Такие вот берсерки входят в состав нашей крови. Кстати говоря, гной, который вы можете наблюдать при сильном воспалении, например, миндалин или мягких тканей вокруг ногтя на пальце — это не что иное, как обломки погибших нейтрофилов.
Важная примета нейтрофилов — они неспецифичны по отношению к чужеродным агентам. Вообще, нейтрофилы — один из главных компонентов неспецифического иммунитета. Им без разницы, что перед ними — бактерия, простейшее, чужеродная ткань или заноза — они всё будут пытаться разорвать и поглотить.
Эозинофилы. Эти лейкоциты имеют особую функцию. Они помогают организму противостоять незваным гостям — глистам и паразитам. Если у пациента сильно завышены эозинофилы, первым делом необходимо искать питомцев, которые уютно расположились в тонком кишечнике, в желчных протоках или других пригодных для проживания местах организма.

Важная вещь — эозинофилы и особенно нейтрофилы являются ярко выраженными фагоцитами («фагос»-пожирать), то есть клетками, которые пожирают другие клетки. Их принято называть микрофагами, так как они довольно небольшие.
Базофилы. Последний рассматриваемый нами вид зернистых лейкоцитов. В гранулах базофилов содержатся вещества — помощники аллергических реакций. Это, конечно же, гистамин, а также серотонин и лейкотриены. Базофилы в здоровом организме содержатся в крайне малом количестве. Их становится больше при бурных немедленных аллергических реакциях, а также при лимфомах, лейкозах и некоторых аутоиммунных заболеваниях.
Отразим на нашей схеме то, что мы узнали:
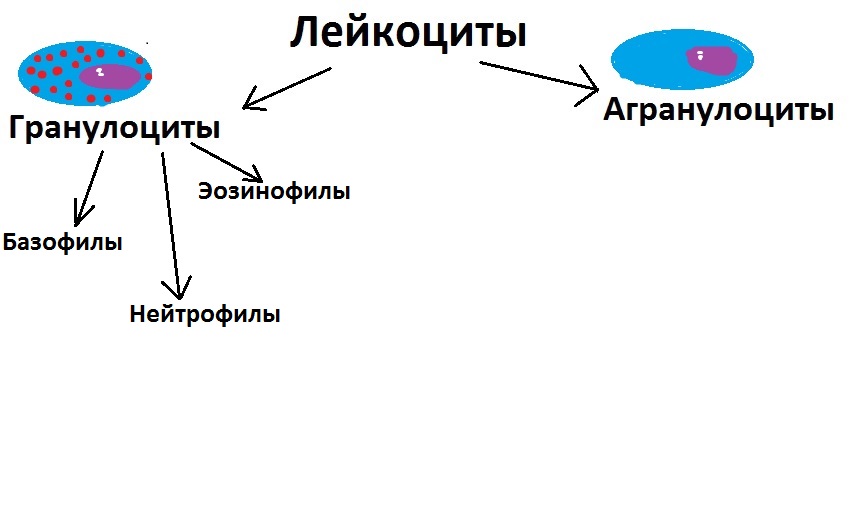
Агранулоциты
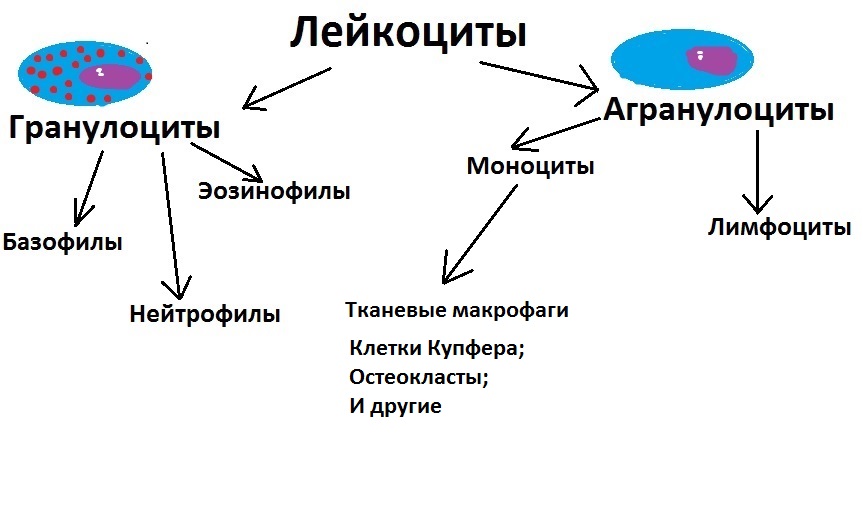
Приступаем ко второй половине классификации. Сейчас мы будем рассматривать аграгулоциты, то есть гладкие лейкоциты, лишённые зернистых гранул. Первым делом разделим агранулоциты на две группы: моноциты и лимфоциты.
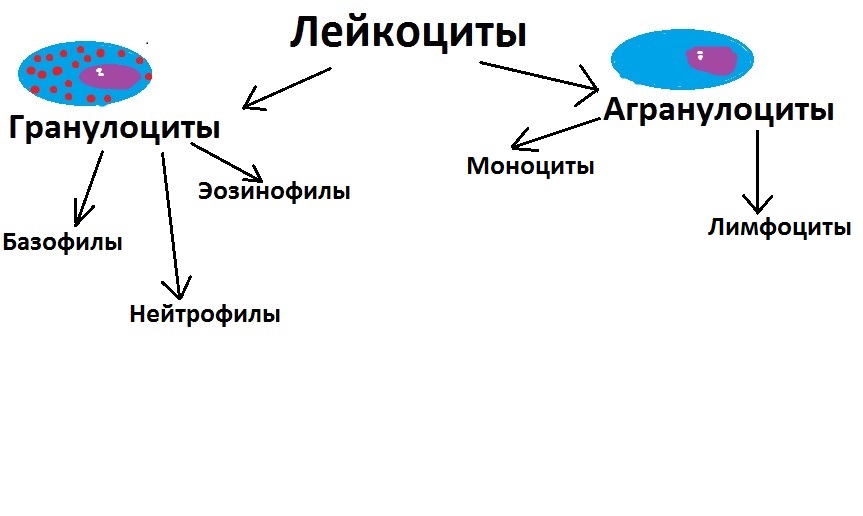
Моноциты
Моноциты — это очень крупные клетки. Их основная задача — фагоцитоз, то есть пожирание, как и у нейтрофилов.
Однако моноциты являются довольно большими клетками-пожирателями, поэтому называть мы их будем макрофагами. Более того, помимо фагоцитоза, моноциты умеют синтезировать и выделять целый класс веществ, которые называются монокины. К монокинам относят интерлейкины 1, 6 (стимулируют продукцию антител, о них чуть позже), фактор некроза опухоли и другие.
Ещё одна важная особенность — моноциты способны заселятся в разнообразные ткани и дозревать там до специализированных клеток, которые называются тканевые макрофаги. Это очень зрелая клетку, которая «пожирает» врагов только в пределах определённой ткани. Если моноцит селится в ткани печени и дозревает там, его называют клеткой Купфера. Если он решает обосноваться в костной ткани, он становится остеокластом. В лёгких это будет альвеолярный макрофаг.
Наконец, моноциты и макрофаги способны не просто поглотить бактерию или клетку, пораженную вирусом — они могу ещё и выставить её обломки на свою поверхность, чтобы её распознали Т-хелперы, о которых ещё поговорим.
Подписываем финальную стадию развития моноцитов и двигаемся далее.
Лимфоциты
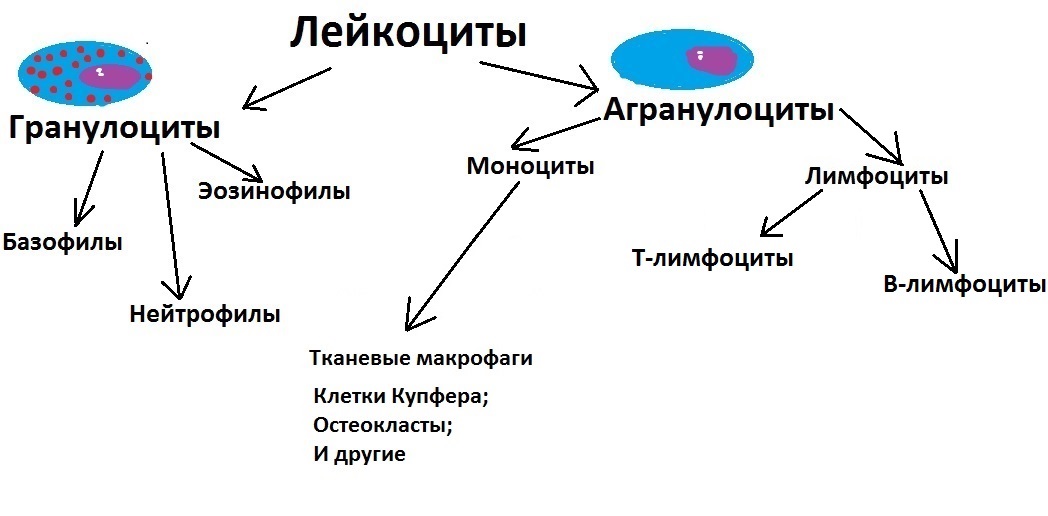
Итак, мы уже знаем, что гладкие лейкоциты (агранулоциты) делятся на моноциты и лимфоциты. Моноциты мы уже разобрали, теперь давайте поговорим про лимфоциты.
Лимфоциты — это важнейшие клетки иммунной системы. Именно они осуществляют полноценный специфический иммунный ответ, защищая нас от многочисленных угроз как извне (вирусы, бактерии), так и изнутри нас (раковые клетки). Прежде, чем мы будем их подробно разбирать, необходимо сразу разделить их на две большие группы — T-лимфоциты и B-лимфоциты. Также есть условно-самостоятельная группа, крайне интересная. Но обо всём по порядку.
T-лимфоциты
Первые стадии созревания у этих лимфоцитов (как и всех клеток крови вообще) проходят в красном костном мозге. А завершается их дозревание до полноценных клеток в тимусе (тимус — это вилочковая железа). Именно поэтому их и называют Т-лимфоциты, то есть «Тимус-Лимфоциты». Т-лимфоциты — это главные представители клеточного иммунитета.
То есть они включаются в работу, когда опасность для организма — клетка (бактерия, раковая клетка), или же нечто, забравшееся внутрь клетки организма ( например, вирус) .
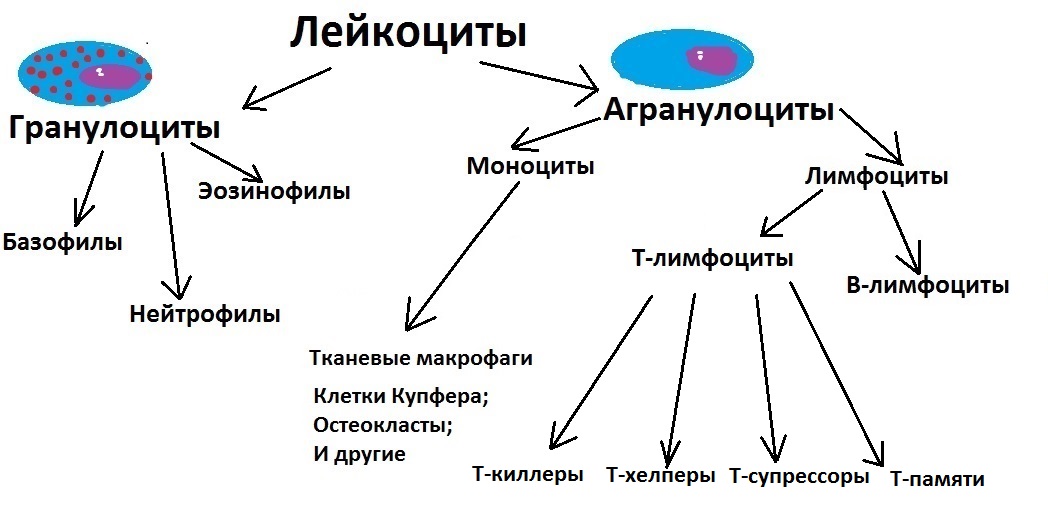
Итак, Т-лимфоциты — это главные представители клеточной линии иммунитета. Они делятся на как минимум 4 группы:
- Т-киллеры. Самые настоящие убийцы. Именно они осуществляют убийство бактерий, и клеток, поражённых вирусом. Также Т-киллеры набрасываются на чужеродную ткань, пересаженную от другого человека. Т-киллеры могут атаковать и клетки с признаками опухолевого перерождения, однако главные герои этой истории ждут нас впереди;
- Т-хелперы, от английского «help»-«помощь». Чрезвычайно важные лимфоциты. Т-хелперы координируют слаженную работу клеточного и гуморального иммунитета. Они реагируют на обстановку внутри организма и оперативно отдают приказы тем или иным клеткам делиться, атаковать или созревать. Кстати говоря, вич-инфекция поражает в первую очередь именно эти клетки, а также тканевые макрофаги.
- Т-супрессоры, от английского «suppress»-подавлять. Эти Т-лимфоциты подавляют активность Т-киллеров и Т-хелперов. Если Т-супрессоры сработают недостаточно, киллеры и хелперы настолько разойдутся, что начнут атаковать и свои собственные ткани. Т-супрессоры следят, чтобы такого не происходило.
- Т-памяти. Этот долгоживущий лимфоцит сохраняет в себе информацию о том, с какими чужеродными агентами пришлось встречаться организму ранее. Благодаря Т-памяти иммунный ответ при вторичной встрече, например, с вирусом, можно осуществить намного быстрее, чем в первый раз.
Рисуем на нашей схеме Т-лимфоциты, все четыре вида, и двигаемся далее.
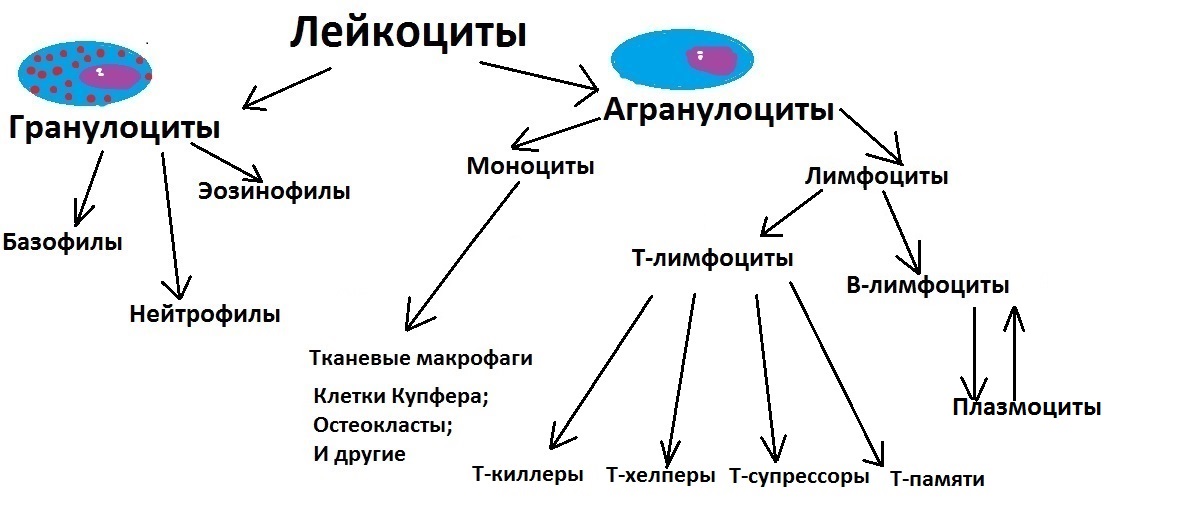
B-лимфоциты
Помните, мы говорили, что Т-лимфоциты дозревают в тимусе, именно поэтому они так и называются? Так вот, B-лимфоциты созревают в красном костном мозге и поэтому они называются…B-лимфоциты? На самом деле, они впервые были обнаружены у птиц, в органе, который называется Фабрициева сумка. «Сумка» по английски — это «bursa», вот откуда здесь буква «B».
Главнейшая функция всех B-лимфоцитов — выработка антител, то есть иммуноглобулинов. Иммуноглобулин — это особый белок, который связывается с чужеродным агентом и нейтрализует его. Часто иммуноглобулины связываются с разнообразными ядами и продуктами распада бактерий, чтобы их нейтрализовать.
Иммуноглобулины представляют собой одну из важнейших составных частей гуморального иммунитета. Помните, мы говорили, что клеточный иммунитет работает, когда чужеродный агент — это клетка? Так вот, гуморальный иммунитет сработает, когда чужеродный агент — это вещество, растворимое в жидкости, либо жидкость. Вы можете легко запомнить это правило, ведь по гречески «гумор» — значит «жидкость».
Важный момент — чтобы начать производить иммуноглобулин, B-лимфоцит должен трансформироваться в плазмоцит. Именно плазмоциты вырабатывают антитела (иммуноглобулины). Чтобы B-лимфоцит превратился в плазмоцит, требуется несколько сигналов, например, от Т-хелперов, про которые мы с вами говорили.
Ещё более интересно то, что плазмоцит способен превращаться обратно в B-лимфоцит, когда его миссия по производству иммуноглобулина будет выполнена.
Не совсем в тему этой статьи, но это важно: клеточный и гуморальный иммунитет разделены в наших с вами классификациях для лучшего понимания, но в реальности они, как правило, работают сообща под руководством Т-хелперов и других иммунных клеток.
Дописываем B-линию в нашу схему и приступаем к последней части рассказа про лейкоциты.
NK-лимфоциты
Помните, мы говорили, что у нас есть крайне интересная самостоятельная группа лимфоцитов, которые не принадлежат ни к Т- ни к B- росткам? Так вот, речь идёт про так называемые NK-лимфоциты, ещё их называют «естественные киллеры». «NK» — от сокращения «Natural Killers», то есть «естественные убийцы«.

В нашей крови существуют очень необычные клетки-лимфоциты. Их рецепторное строение не позволяет отнести их к Т- или B- линиям. Они способны распознавать различные клетки организма, выявляя те, которые поражены вирусом или находятся на пути перерождения в раковую клетку.
Ещё раз — NK-лимфоциты распознают и убивают раковые клетки и поражённые вирусами клетки. Причём узнавать раковые клетки они могут на более тонком уровне, чем Т-лимфоциты. Это очень важный эшелон противораковой защиты, на самом деле.
Когда NK-лимфоцит замечает подозрительно изменённую клетку организма, он начинает массированную атаку. NK буквально продырявливает потенциально раковую клетку сразу в нескольких местах, после чего в неё начинает поступать вода и натрий в огромном количестве. Далее потенциально раковая клетка погибает от разрыва мембраны.
Мне всегда казалось огромной несправедливостью, что на гистологических планшетах, различных схемах кроветворения, даже в гематологических разделах учебников NK-клетки обходятся стороной. То есть их не упоминают вовсе или же просто пишут, что такие существуют. На мой взгляд, это неправильно — на минуточку, мы говорим о клетках иммунитета, которые защищают нас от рака. Но в нашей табличке они займут своё справедливое место:
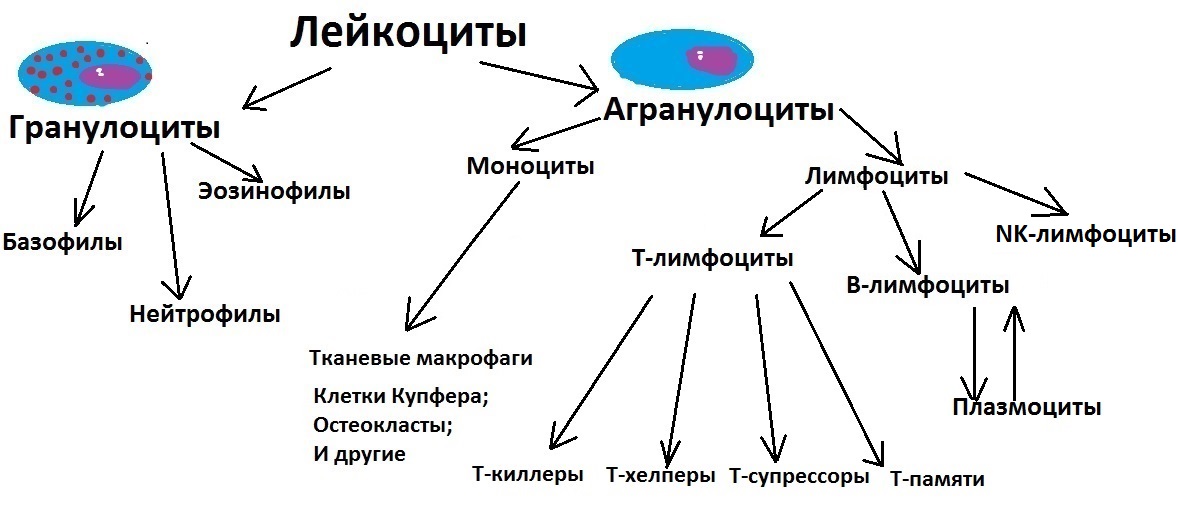
Надеюсь, я вас не сильно запутал. Если вы вдруг не поняли какой-то этап моей схемы, напишите об этом в комментариях, я с удовольствием всё расскажу. Я планирую сделать ещё пару постов про кроветворение в красном костном мозге и про лейкозы. Однако без усвоения этого материала про лейкоциты вы ничего не поймёте, поэтому постарайтесь хорошенько вникнуть в эти схемы. Лучше всего, конечно, нарисовать такие же и подписать рядом с каждым классом особые приметы.
Это руководство я хотел бы посвятить памяти Елены Борисовны Родзаевской — блестящего преподавателя и удивительного человека. Она очень многое в меня вложила и благодаря ей я имею некоторые знания, которыми я делюсь с вами, уважаемые читатели. Елена Борисовна верила в меня тогда, когда практически никто не верил. Я очень горжусь тем, что мне довелось быть её учеником.
Источник: medicine-boy.ru
Образование и жизненный цикл
Гранулоциты образуются в костном мозге: клетки делятся в течение четырех дней, после чего происходит их морфологическое дозревание. Данный этап длится не более пяти дней. После того как клетки выходят в кровяное русло, происходит их деление на два вида: пристеночные, которые временно крепятся к стенкам сосудов, и активно циркулирующие. По кровеносной системе они циркулируют около недели, затем выходят в ткань. Здесь клетки живут около двух суток, после чего происходит завершение их жизненного цикла.
Виды
Количество гранулоцитов в крови составляет около 60% от общего количества белых клеток. Данные компоненты, в свою очередь, делятся на подвиды.
Таким образом, к гранулоцитам относятся следующие клетки:
- Нейтрофильные гранулоциты – их количество у взрослого или ребенка в крови самое большое. По сути, нейтрофильные гранулоциты обезвреживают патогенные организмы, «жертвуя» собой.
- Базофилы – клетки мгновенно реагируют на аллергены, ускоряют кровообращение и направляют большое количество жидкости на пораженный участок.
- Эозинофильные гранулоциты – воздействуют на паразитарные организмы, предупреждают развитие аллергической реакции. Среди белых телец это самые маленькие и самые подвижные тельца.
Если те или иные гранулоциты понижены или повышены, это может негативно сказаться на работе организма, например, при попадании патогенных организмов иммунная реакция может быть слишком слабой, что приведет к серьезным осложнениям.
Функции
Основные функции гранулоцитов заключаются в формировании иммунной реакции при попадании в организм вируса, паразита, аллергена или любого другого патогенного тела.
Кроме этого, некоторые подвиды белых телец отвечают за ускорение кровообращения при ранении, что помогает предотвратить большую кровопотерю. В целом данный компонент отвечает за полноценное функционирование внутренних органов.
Норма
Норма гранулоцитов будет зависеть от возраста и половой принадлежности человека.
Оптимальными показателями являются следующие:
- у ребенка до месяца гранулоциты норма – 5,5-12,5 109 клеток/л
- у ребенка до 12 лет – 4,5-10,0 109 клеток/л;
- у ребенка в пубертатный период – 4,3-9,5 109 клеток/л;
- в крови у женщин и у мужчин – 1,2-6,8 109 клеток/л.
Следует отметить, что повышение гранулоцитов при беременности – это нормальный физиологический процесс и патологией не является. Однако, если показатели существенно выше предельной границы, то обязательно следует пройти полное обследование, на основании которого врач поставит диагноз и назначит корректное лечение.
Возможные причины отклонения от нормы
Причины повышения количества белых телец в крови могут быть следующие:
- паразитарные инфекции;
- острые воспалительные процессы;
- инфекционные заболевания;
- патологические процессы, которые сопровождаются некротизацией тканей;
- аллергические реакции;
- интоксикация организма;
- острые геморрагии;
- болезни кроветворной системы;
- онкологические заболевания;
- воспалительные процессы в желудочно-кишечном тракте;
- синдром Ходжкина;
- нарушения эндокринного характера;
- заболевания сердечно-сосудистой системы;
- гемолитическая анемия;
- инфекционные процессы непаразитарной природы.
Привести к тому, что гранулоциты в крови будут выше нормы, может и прием некоторых медикаментозных препаратов. Как правило, после отмены медикаментов показатели приходят в норму.
Причины того, что гранулоциты в крови ниже нормы, следующие:
- аллергические реакции;
- гастроэнтерологические заболевания;
- системные или аутоиммунные заболевания;
- различные виды анемии;
- скарлатина;
- ревматизм;
- саркоидоз.
Следует учитывать и то, что при расшифровке анализа принимаются во внимание и другие показатели крови, поэтому самостоятельно трактовать данные не рекомендуется: правильно это может сделать только врач.
Проведение анализа
Для того чтобы определить количество белых телец в крови, проводится общий клинический анализ биологической жидкости путем пункции из пальца. Следует отметить, что на результаты могут повлиять и внешние факторы: неправильное проведение процедуры забора жидкости, нарушение техники проведения анализа, неподготовленный пациент. Поэтому, если результаты будут показывать существенное отклонение от нормы, врач может назначить повторное проведение лабораторного исследования.
Контролировать показатели гранулоцитов в крови очень важно, так как от них зависит состояние иммунной системы. Поскольку симптоматически заметить отклонение от нормы не всегда представляется возможным, в целях профилактики необходимо периодически проходить медицинский осмотр со сдачей лабораторных анализов. Любое заболевание гораздо легче предотвратить, чем устранять его последствия.
Источник: MedAnaliz.pro
