Федотова Е.Ю., Иванова Е.О.
Первое описание пациентов, страдающих этим заболеванием, принадлежит Джеймсу Паркинсону, который с 1817 г. в своем «Эссе о дрожательном параличе» описал 6 пациентов со сходной клинической симптоматикой. Из четырех основных признаков, по которым на сегодняшний день ставится диагноз, он описал три: тремор покоя, гипокинезия и постуральная неустойчивость. Чуть позже Жан Мартен Шарко дополнил описание четвертым признаком, ригидностью, и назвал дрожательный паралич «болезнью Паркинсона». В 1912 г. Фредериком Генри Леви были описаны внутриклеточные включения в центральной нервной системе, характерные для болезни Паркинсона (БП), а спустя 7 лет наш соотечественник Константин Николаевич Третьяков впервые показал, что основной мишенью нейродегенеративного процесса при БП является черная субстанция среднего мозга. Важнейшей вехой в изучении и терапии БП явились 1960-е гг., когда для лечения этого заболевания стала применяться леводопа — предшественник дофамина.
Распространенность БП от исследования к исследованию разнится и считается примерно равной 100–250 случаев на 100 000 населения. БП является возраст-зависимым заболеванием, то есть болеют преимущественно люди пожилого возраста. Так, среди лиц старше 60 лет распространенность заболевания может достигать 1–2%. По некоторым данным мужчины болеют примерно в полтора раза чаще, чем женщины. Кроме возраста и пола к факторам риска относят проживание в сельской местности, контакт с гербицидами, пестицидами, тяжелыми металлами.
Патогенез и диагностика болезни Паркинсона
БП является синуклеинопатией, то есть при нейродегенеративном процессе отмечается внутриклеточное накопление белка альфа-синуклеина в виде так называемых телец Леви. На начальных этапах болезни тельца Леви обнаруживаются лишь в периферической нервной системе, в частности в клетках мейснерова и ауэрбахова сплетений желудочно-кишечного тракта, затем по мере распространения патологического процесса — в определенных ядрах ствола и в черной субстанции, а на развернутых стадиях — в коре больших полушарий. Топическое распространение нейродегенеративного процесса сопровождается соответствующими клиническими проявлениями: до поражения черной субстанции — немоторными проявлениями, а после гибели более 70% нигральных нейронов — уже моторными симптомами [1].
К основным двигательным проявлениям БП, как уже отмечалось, относят гипокинезию, тремор покоя, ригидность и постуральную неустойчивость. Именно их наличие и позволяет поставить диагноз БП по общепризнанным критериям Банка головного мозга Общества болезни Паркинсона Великобритании (United Kingdom Parkinson disease Society Brain Bank Criteria). БП не ограничивается только двигательными нарушениями, в ее клинический спектр входит и вполне определенный комплекс немоторных нарушений, которые стали тщательно изучаться и исследоваться относительно недавно. Они представлены сенсорными, диссомническими, когнитивными, эмоционально-аффективными, поведенческими, психотическими, вегетативно-висцеральными расстройствами. Считается, что задолго до начала диагностической стадии БП, до появления двигательных проявлений, у таких пациентов можно выявить ряд немоторных симптомов, в частности, депрессию, констипацию, нарушение сна, гипосмию и некоторые другие. Именно премоторная стадия является потенциальным «терапевтическим окном», когда возможно проведение эффективной нейропротекторной терапии для предотвращения или замедления развития данного заболевания. В качестве инструментального диагностического метода может применяться транскраниальная сонография, позволяющая диагностировать феномен гиперэхогенности черной субстанции (ГЧС), характерный для БП. Данный метод может быть полезен для проведения дифференциальной диагностики между БП и синдромами «паркинсонизм-плюс», однако феномен ГЧС не обладает абсолютной диагностической значимостью и должен трактоваться в совокупности с остальной клинической картиной.
Лечение болезни Паркинсона
Медикаментозная терапия двигательных проявлений болезни Паркинсона
На настоящий момент нет ни одного препарата, который бы обладал доказанными нейропротекторными свойствами при БП, поэтому проводится симптоматическая терапия, а также физическая и социально-психологическая реабилитация, а в некоторых случаях применяется нейрохирургическое лечение. Ниже мы рассмотрим более подробно группы противопаркинсонических препаратов, применяемых в лечении двигательных проявлений БП: препараты леводопы, агонисты дофаминовых рецепторов (АДР), препараты амантадина, ингибиторы моноаминооксидазы типа В (МАО-B) и антихолинергические средства.
Препараты леводопы являются «золотым стандартом» в терапии БП, хотя и имеют вполне определенные ограничения в виде побочных явлений, осложнений при длительной терапии. Доказано, что монотерапия препаратами леводопы обладает большей эффективностью по сравнению с монотерапией АДР. Широко практикуется добавление препаратов леводопы к другим противопаркинсоническим препаратам с целью более эффективного контроля симптомов БП. Леводопа имеет короткий период полувыведения, поэтому чаще всего лечение этим препаратом начинают с трехкратного приема, в дальнейшем наращивая частоту приема и корректируя разовые дозы по мере прогрессирования заболевания и появления двигательных осложнений.
новное действие леводопы заключается в восполнении дефицита дофамина, наблюдающегося при гибели нигростриарных нейронов. Сам дофамин не способен проникать через гематоэнцефалический барьер (ГЭБ), поэтому для лечения БП используется его непосредственный предшественник, проникающий через ГЭБ, — леводопа, которая превращается в дофамин путем декарбоксилирования. Для того чтобы блокировать декарбоксилирование леводопы на периферии и повысить концентрацию леводопы в головном мозге, леводопа применяется в комбинации с ингибитором ДОФА-декарбоксилазы периферического действия — карбидопой или бенсеразидом [2, 3]. Декарбоксилирование является не единственным путем метаболизирования леводопы. Леводопа может подвергаться метилированию с помощью фермента катехол-о-метилтрансферазы (КОМТ), поэтому в некоторых случаях для увеличения биодоступности леводопы к ней добавляют ингибитор катехол-о-метилтрансферазы — толкапон или энтакапон. В России для лечения БП используется комбинация леводопа/карбидопа/энтакапон с несколькими дозировками леводопы. Помимо стандартных лекарственных форм применяется также лекарственная форма леводопы с контролируемым высвобождением, характеризующаяся более длительным периодом полувыведения. Данная форма назначается пациентам с моторными флуктуациями, а также на ночь для коррекции ночной акинезии. Следует отметить, что по сравнению с АДР и амантадином леводопа характеризуется более низким риском развития галлюцинаций и психоза, в связи с чем является препаратом выбора для пациентов с когнитивными нарушениями [2, 3].
Агонисты дофаминовых рецепторов, применяемые для лечения БП, оказывают противопаркинсонический эффект за счет воздействия на D2-рецепторы. Препараты из этой группы могут применяться в комбинации с леводопой и другими противопаркинсоническими препаратами, а могут назначаться как первый препарат в лечении — чаще у молодых пациентов. На настоящий момент в практике используются неэрголиновые агонисты, к которым относятся пирибедил, прамипексол, ропинирол (применяются внутрь), ротиготин (пластырь), и готовится к регистрации апоморфин (для подкожного введения). Существуют лекарственные формы ропинирола и прамипексола с контролируемым высвобождением для применения 1 раз в сутки, за счет чего достигается большая комплаентность к лечению, а также лучшая переносимость препаратов. Назначение ротиготина, представленного в виде трансдермального пластыря, возможно у лиц, у которых по тем или иных причинам затруднен пероральный прием лекарственных средств. Из побочных явлений у АДР чаще всего наблюдаются тошнота, рвота, ортостатическая гипотензия, отеки ног, психические расстройства (дневная сонливость, психоз, галлюцинации), у молодых пациентов в некоторых случаях возможно развитие импульсивно-компульсивных расстройств [2–4].
Наряду с препаратами леводопы и АДР для лечения двигательных симптомов БП нередко назначаются препараты амантадина (амантадина хлорид или амантадина сульфат).
антадин характеризуется умеренным симптоматическим эффектом и поэтому по большей части применяется в комбинации с препаратами других групп. Препараты амантадина обладают анти-NMDA-активностью, препятствуют обратному захвату дофамина и способствуют его высвобождению. Существует инфузионная форма амантадина сульфата, которая может применяться при состояниях острой декомпенсации БП, сопровождающихся явлениями дисфагии. Побочные эффекты обычно слабо выражены и включают тошноту, периферические отеки, сухость во рту, сетчатое ливедо и некоторые другие. Имеющийся у амантадина антихолинергический эффект ограничивает его применение у пациентов с деменцией и галлюцинациями [2, 3].
Ингибиторы моноаминоксидазы типа В препятствуют метаболизированию дофамина, тем самым увеличивая его концентрацию в синаптической щели. Представители данной группы — селегилин и разагилин — могут использоваться в качестве монотерапии на ранних стадиях заболевания с минимально выраженной симптоматикой либо в комбинации с другими препаратами. Следует отметить, что по сравнению с другими противопаркинсоническими препаратами ингибиторы моноаминоаксидазы обладают слабо выраженным клиническим эффектом и поэтому в большинстве случаев применяются как дополнение к основной терапии. В последние годы преимущество отдается разагилину в связи с меньшей частотой побочных эффектов и более выраженным клиническим эффектом. Кроме того, по данным проведенного исследования ADAGIO было показано, что этот препарат обладает нейропротекторными свойствами, что, однако, требует дальнейшего подтверждения [5].
К антихолинергическим средствам относят бипериден и тригексифенидил, которые применяются преимущественно при треморе, резистентном к другим противопаркинсоническим препаратам. Существенно ограничивают их назначение побочные холинолитические явления — сухость во рту, задержка мочи, когнитивные и психотические расстройства. Следует помнить, что антихолинергические препараты противопоказаны пациентам с закрытоугольной глаукомой, а также с деменцией и галлюцинациями.
При назначении противопаркинсонических препаратов, их доз и комбинаций следует учитывать ряд факторов: в первую очередь характеристики и тяжесть моторных и немоторных симптомов, возраст больного, эффективность препаратов у данного конкретного больного, их побочные эффекты и, кроме того, фармакоэкономические аспекты. Например, при раннем возрасте начала БП, то есть до 50 лет, в качестве первого препарата стоит рассматривать АДР, тогда как при возрасте начала БП старше 70 лет в первую очередь назначается леводопа-содержащий препарат [3].
Несмотря на то, что леводопа является «золотым стандартом» в лечении БП, по мере прогрессирования заболевания у большинства больных появляются осложнения леводопа-терапии — моторные флуктуации и лекарственные дискинезии. Моторные флуктуации представляют собой колебания эффекта леводопы.
циенты начинают ощущать окончание действия очередной дозы препарата: сначала постепенное (феномен «истощения конца дозы»), а по мере прогрессирования — резкое и непредсказуемое (периоды «включения/выключения»). У большинства пациентов с моторными флуктуациями отмечаются колебания и немоторных симптомов: вегетативных, психических, сенсорных. Кроме флуктуаций могут развиваться и лекарственные дискинезии — избыточные, насильственные движения, возникающие в большинстве случаев на пике действия леводопы/АДР. Появление данных осложнений связывают с несколькими механизмами, опосредованными прогрессированием заболевания и непосредственным действием леводопы. Так, в процессе прогрессирования БП происходит уменьшение числа нигростриарных нейронов, в связи с чем утрачивается буферная функция их терминалей. Таким образом, концентрация дофамина в синаптической щели впадает в прямую зависимость от концентрации леводопы в крови. При этом происходит пульсирующая стимуляция дофаминовых рецепторов, значительно отличающаяся от физиологической тонической стимуляции, приводящая к вторичным изменениям постсинаптического аппарата.
Коррекция моторных флуктуаций может включать увеличение дозы и кратности приема леводопы, применение препаратов леводопы/АДР с замедленным высвобождением, добавление других групп препаратов — ингибиторов КОМТ, ингибиторов МАО-В, АДР. При наличии дискинезий применяются такие подходы к лечению, как снижение разовой дозы и увеличение кратности приема дофаминергических препаратов, добавление к схеме лечения препаратов амантадина [6, 7].
Несмотря на широкие возможности пероральной медикаментозной терапии, на развернутых стадиях БП нередко приходится сталкиваться с резистентными формами осложнений леводопа-терапии. В этих случаях прибегают к методам, позволяющим поддерживать постоянную стимуляцию дофаминовых рецепторов: дуоденальному введению геля леводопы/карбидопы через гастростому или подкожному введению апоморфина с помощью помп. Постоянное интрадуоденальное введение геля, содержащего леводопу, показано при моторных флуктуациях, которые не могут быть скорректированы другими подходами. Как и любое инвазивное лечение, оно имеет ряд недостатков, связанных с необходимостью периодического хирургического осмотра и соответствующими осложнениями. Подкожная инфузия апоморфина менее инвазивна и также позволяет уменьшить суточную длительность «выключений», однако апоморфин, являясь АДР, обладает всеми побочными эффектами препаратов этого класса, хотя и в меньшей степени.
Хирургическое лечение двигательных проявлений болезни Паркинсона
Отдельного внимания заслуживают нейрохирургические методы лечения БП, к которым прибегают в трех ситуациях: 1) при резистентных к медикаментозной терапии моторных флуктуациях и лекарственных дискинезиях; 2) при резистентном к медикаментозной терапии инвалидизирующем треморе покоя; 3) в тех случаях, когда дофаминергическая терапия эффективна, однако не может проводиться из-за каких-либо иных побочных явлений.
йрохирургическое лечение БП представлено двумя видами стереотаксических вмешательств: деструктивными (таламотомия, паллидотомия) и стимулирующими (DBS, deep brain stimulation — глубокая стимуляция головного мозга). Деструктивные операции являются, как правило, односторонними в силу того, что при двустороннем деструктивном вмешательстве значительно возрастает риск осложнений, в том числе псевдобульбарного синдрома. Так, риск выраженной дизартрии при двусторонней таламотомии составляет около 30%. Для DBS рассматриваются три основные мишени оперативного лечения — Vim (вентролатеральное ядро таламуса), STN (субаталамическое ядро), GPi (внутренний сегмент бледного шара). Мишень выбирается по определенным показаниям, например: вентролатеральное ядро таламуса — при некупируемом медикаментозном треморе, бледный шар — при выраженных лекарственных дискинезиях, субталамическое ядро — при моторных флуктуациях без инвалидизирующих дискинезий. Следует учитывать, что стимуляция Vim не оказывает влияния на выраженность гипокинезии/ригидности. Также известно, что стимуляция STN позволяет в большей степени снизить дозы дофаминергических препаратов по сравнению со стимуляцией GPi. Важнейшую роль играет правильный отбор кандидатов на хирургическое лечение. Необходимым условием является точно установленный диагноз идиопатической БП длительностью более 5 лет (выраженная инвалидизация больных ранее этого срока с большой вероятностью свидетельствует о наличии синдрома «паркинсонизм-плюс»). Необходимо убедиться в эффективности препаратов леводопы у данного больного в отношении гипокинезии и ригидности, так как эффективность хирургического вмешательства обычно не превышает эффективность леводопа-терапии. Вместе с тем данное условие не касается резистентного к медикаментам тремора, для которого эффективность DBS может превышать таковую медикаментозной терапии. Должны быть исключены такие немоторные проявления БП, как деменция и психотические нарушения [8]. К осложнениям функциональной нейрохирургии относятся: кровоизлияния, инфекционные осложнения, смещение электродов, психотические нарушения, эмоциональная лабильность и депрессия (включая суицидальные попытки), лобная дисфункция, нарушения глотания и речи. Вместе с тем выраженность осложнений в большинстве случаев невелика и не является поводом для отказа от операции у пациентов, отобранных по всем необходимым критериям [9].
Лечение немоторных нарушений при болезни Паркинсона
Разнообразные немоторные проявления БП могут снижать качество жизни больных ничуть не в меньшей степени, чем двигательные нарушения (особенно на продвинутых стадиях заболевания), поэтому необходимо уделять должное внимание их медикаментозной коррекции. Ниже мы рассмотрим основные подходы к лечению наиболее часто встречающихся недвигательных расстройств при БП.
Депрессия, тревога. Тревожно-депрессивные расстройства отмечаются примерно у 40% больных с БП. Назначение дофаминергических препаратов для коррекции двигательных проявлений может уменьшить выраженность не только двигательных симптомов, но и тревоги/депрессии. В ряде исследований был продемонстрирован антидепрессивный эффект прамипексола. При резистентности этих симптомов к дофаминергической терапии показано назначение антидепрессантов. В клинических исследованиях была подтверждена эффективность трициклических антидепрессантов в лечении депрессии при БП, однако применение препаратов этой группы ограничено из-за риска побочных реакций. Более безопасные селективные ингибиторы обратного захвата серотонина/серотонина и норадреналина также применяются в клинической практике, хотя их эффективность не была подтверждена в крупных исследованиях [10–12].
Деменция, психотические расстройства. При наличии у пациентов деменции следует в первую очередь отменить препараты, негативно влияющие на когнитивные функции, — антихолинергические препараты, амантадин, трициклические антидепрессанты, толтеродин и оксибутинин, бензодиазепины. Для лечения деменции применяют ингибиторы холинэстеразы: ривастигмин, донепезил, галантамин. В настоящее время из трех вышеперечисленных препаратов только ривастигмин обладает достаточной доказательной базой по эффективности. В качестве препарата второй линии можно рассматривать акатинол мемантин. Нередко у пациентов с когнитивными нарушениями (либо высоким риском их развития) отмечаются психотические расстройства, наиболее часто — зрительные галлюцинации. Их коррекция также подразумевает отмену вышеупомянутых препаратов, влияющих на когнитивные функции. При неэффективности этой меры показано снижение дозы/отмена АДР, ингибиторов МАО-В и КОМТ и, в последнюю очередь, снижение дозы леводопы. При необходимости назначаются атипичные нейролептики в минимальной эффективной дозе — клозапин или кветиапин. Из них более предпочтителен клозапин, поскольку имеет большую доказательную базу по эффективности. Сопутствующие инфекционные/метаболические расстройства также могут провоцировать развитие психотических состояний, поэтому нельзя забывать об их своевременном выявлении и коррекции [11, 12].
Вегетативные нарушения. К наиболее часто встречающимся при болезни Паркинсона вегетативным нарушениям относятся запоры, дисфункция желудка, ортостатическая гипотензия, расстройства мочеиспускания.
В лечении запоров, помимо назначения слабительных, большую роль играет коррекция диеты и повышение физической активности. Из слабительных препаратов предпочтение следует отдавать осмотическим слабительным и средствам, содержащим клетчатку. В случае нарушения эвакуаторной функции желудка с развитием таких симптомов, как тошнота, рвота, чувство переполнения и абдоминальные боли, целесообразно применять домперидон. При наличии у пациента ортостатической гипотензии необходимо в первую очередь скорректировать дозу либо отменить препараты, ее провоцирующие: диуретики и другие антигипертензивные средства, нитраты, альфа-блокаторы. В ряде случаев приходится прибегать к коррекции схемы противопаркинсонической терапии, так как дофаминергические препараты (чаще всего АДР) могут также провоцировать либо усугублять проявления ортостаза. Необходимо рекомендовать пациентам дробный прием пищи небольшими порциями, соблюдение адекватного режима потребления воды и соли (не менее 2 л воды в день, 1 г соли на прием пищи), ношение компрессионных эластических колготок/бандажа, подъем головного конца кровати до 30–40°. При неэффективности вышеуказанных мер к лечению можно добавить флудрокортизон под контролем уровня артериального давления и электролитного баланса.
Нарушения сна, часто наблюдаемые при БП, подразделяются на дневные (дневная сонливость, эпизоды внезапного засыпания) и ночные (нарушение поведения в REM-фазу сна, инсомния, синдром беспокойных ног). При дневных нарушениях рекомендовано снижение дозы/отмена седативных препаратов, снижение дозы АДР либо замена на другой АДР. При нарушениях поведения в REM-фазе сна целесообразно уменьшить дозу/отменить антидепрессанты, уменьшить дозу АДР, а при неэффективности данных мер может быть эффективным назначение препаратов мелатонина либо клоназепама в небольших дозах на ночь. Инсомния, обусловленная ночной акинезией, корректируется добавлением к противопаркинсонической схеме пролонгированных дофаминергических препаратов. В остальных случаях целесообразно проводить терапию препаратами мелатонина либо антидепрессантами с седативным эффектом.
У подавляющего числа пациентов с БП на том или ином этапе заболевания развиваются нарушения мочеиспускания, главным образом в виде гиперактивности детрузора. Появление у пациентов жалоб на учащенное мочеиспускание/недержание мочи требует исключения других потенциально курабельных причин — инфекции мочевыводящих путей и сахарного диабета. В качестве терапии при гиперактивности мочевого пузыря применяют холинолитики периферического действия (троспиума хлорид, толтеродин, оксибутинин). При этом у пациентов с когнитивными нарушениями предпочтение следует отдавать троспиума хлориду, как препарату, в наименьшей степени проникающему через ГЭБ [11, 12].
Заключение
Лечение БП является достаточно сложной, комплексной задачей, требующей от врача соответствующих знаний, определенного опыта, а также наблюдательности и терпения. Кроме перечисленных подходов к симптоматическому лечению, в последние годы также появились широкомасштабные исследования по применению инновационных, патогенетических препаратов, в том числе на основе генной терапии. Ожидается, что в клиническую практику они войдут в ближайшее десятилетие, что принципиально поменяет прогноз и качество жизни больных с БП. Вместе с тем уже сейчас имеющееся разнообразие препаратов и подходов к лечению позволяет максимально индивидуализировать схему лечения для конкретного больного, воздействуя на все проявления заболевания, на моторные и немоторные симптомы. Правильно подобранное лечение дает пациентам возможность длительно поддерживать должный уровень физической и умственной активности, продолжать работать, жить полноценной жизнью.
Литература
- Klingelhoefer L., Reichmann H. Pathogenesis of Parkinson disease — the gut-brain axis and enviromental factors // Nat. Rev. Neurol. 2015; 11 (11): 625–636.
- Клинические рекомендации по неврологии Европейской федерации неврологических сообществ / Под ред. Gilhus N. E., Barnes M. P., Brainin M. Научный ред. Никитин С. С. Издательство «АБВ-пресс», 2012. С. 271–334.
- Иллариошкин С. Н. Терапия паркинсонизма: возможности и перспективы // Неврология и ревматология. Приложение к журналу Consilium Medicum. 2009. № 1. С. 35–40.
- Иллариошкин С. Н., Иванова-Смоленская И. А., Загоровская Т. Б. и др. Семилетний опыт применения мирапекса у больных с различными формами первичного паркинсонизма // Журнал неврологии и психиатрии им. C. C. Корсакова. 2006; 11: 26–32.
- Stowe R., Ives N., Clarke C. E. et al. Evaluation of the efficacy and safety of adjuvant treatment to levodopa therapy in Parkinson’s disease patients with motor complications // Cochrane Database Syst. Rev. 2010; 7: CD007166.
- Fox S. H., Katzenschlager R., Lim S. Y. et al. The Movement Disorder Society Evidence-Based Medicine Review Update: Treatments for the Motor Symptoms of Parkinson’s Disease // Mov. Disord. 2011; 26 (Suppl 3): S2–S41.
- Левин О. С. Леводопа-индуцированные дискинезии при болезни Паркинсона: возможности предупреждения и терапии // Современная терапия в психиатрии и неврологии. 2015; 3: 15–25.
- Загоровская Т. Б., Ширшов А. В., Иллариошкин С. Н. Алгоритм отбора пациентов с болезнью Паркинсона для хирургического лечекния с применением глубокой стимуляции мозга // Атмосфера. Нервные болезни. 2010; 3: 8–12.
- Duker A., Espay A. Surgical treatment of Parkinson-s disease: past, present and future // Neurol. Clin. 2013; 31 (3): 799–808.
- Connolly B. S., Lang A. E. Pharmacological treatment of Parkinson’s disease: a review // JAMA. 2014; 311 (16): 1670–1683.
- Seppi K., Weintraub D., Coelho M. et al. The Movement Disorder Society Evidence-Based Medicine Review Update: Treatments for the Non-Motor Symptoms of Parkinson’s Disease // Mov. Disord. 2011; 26 (Supple 3): S42–S80.
- Lim S. Y., Lang A. E. The nonmotor symptoms of Parkinson’s disease — an overview // Mov Disord. 2010; 25 (Suppl 1): S123–S130.
Лечащий врач…
Источник: www.neurology.ru
Причины развития Паркинсона
По сути, в головном мозге каждого человека в некоторой мере нейроны обречены на погибель, что является вполне естественным для физиологии процессом. Специалистами рассчитана даже закономерность утраты нервных клеток мозга у абсолютно всех людей: за 10 лет жизни безвозвратно погибает примерно 4% нейронов. Но головной мозг уникален, поскольку умеет «включать» своеобразные компенсаторные механизмы, чтобы сохранять нормальную работу нервной системы.
Если же потенциалы компенсации иссякли, а вместе с этим экстрапирамидная система (в ее состав входит черное вещество и пр.) лишилась 80% нейронов, возникают типичные для болезни Паркинсона симптомы. То есть, в анормальном положении разрушение соответствующего вида нейронов происходит активнее. И чем старше человек, тем выше вероятность достижения порогового уровня. Медики выдвигают гипотезу, что заболевание связано с увеличением продолжительности жизни, так как недуг преимущественно одолевает лиц пожилой группы.
Более интенсивное уменьшение числа нейронов, чем при нормальной физиологии старения, при болезни Паркинсона начинается задолго до проявления основных симптомов. И только спустя десятилетия человек, достигнув пожилого возраста, понимает, что болен.

Конкретно БП относят к идиопатической форме, что говорит о самостоятельной (первичной) болезни, которая возникает по необъяснимым причинам. Отсюда следует, что она не связана с генетическими факторами или какими-либо другими заболеваниями. При обследовании пациента врачи не могут установить этиологию ее развития.
В медицине существует еще один термин – «паркинсонизм». Паркинсонизм – обобщающее понятие, характеризующее в целом синдром, что связан с поражениями экстрапирамидной системы первичного или вторичного генеза. В отличие от первичной формы (истинной БП), вторичный паркинсонизм имеет первопричину, которая ведет к такому же клиническому исходу. Первопричинами вторичного паркинсонизма могут быть:
- интоксикация организма под токсическим воздействием угарного газа, марганца, барбитуратов, нейротоксина МФПТ, циннаризина, никотина и пр.;
- хронический энцефалит;
- черепно-мозговые травмы;
- дисциркуляторная энцефалопатия;
- атеросклероз сосудов мозга;
- мозговой инсульт;
- новообразования головного мозга;
- наследственность (семейная мутация генов α-синуклеина и паркина).
Основываясь на клинические данные, в 3/4 случаев синдрома паркинсонизма выявляют именно болезнь Паркинсона, то есть, идиопатическую (включая ювенильную) форму.
Статистика заболеваемости
По частоте развития среди нейродегенеративных патологий БП занимает второе место после болезни Альцгеймера. По данным ВОЗ, болезнь довольно распространена повсеместно: всего в мире насчитывается более 6 млн. людей с таким сложным диагнозом. Уровень заболеваемости по России соответствует 140-160 случаям на каждые 100 тыс. населения. При этом из года в год неуклонный рост прослеживается в распространении патологии даже среди молодых людей в возрасте 30-40 лет. Согласно статистике, каждый 10-й пациент не старше 40 лет. Если дебют БП приходится на любые годы до 40 лет, ее называют ювенильным паркинсонизмом.
На основании предоставленной информации разными авторами, до 55 лет риски заболеваемости в среднем составляют 0,5%, от 55-74 лет – 1,5%, 75-85 лет – 2,5-3%, старше 85 лет – 4-4,5%. Наиболее уязвимый к заболеванию контингент людей – мужчины. Инвалидизация, как правило, наступает спустя 3-5 лет с момента манифестации симптомов. Средний показатель выживаемости – 15 лет. Болезнь Паркинсона относится к числу заболеваний с относительно невысокими цифрами летальности. Причинами смертельных исходов преимущественно являются осложнения после падения, инфекции легких, ТЭЛА, инфекционный патогенез мочевыводящих путей.
Симптомы болезни Паркинсона: от ранних до поздних
Диагностика болезни Паркинсона на ранней стадии сопряжена большими трудностями. Ранняя симптоматика либо вообще отсутствует, либо характеризуется неспецифическими проявлениями, которые могут не восприниматься людьми за серьезную проблему. К числу первых симптомов, которые могут иметь связь с паркинсонизмом, относят:
- частая или постоянная слабость, быстрая утомляемость;
- легкие нарушения координации;
- небольшие нарушения мелкой моторики: например, немного проблематично завязать шнурки, писать ручкой;
- появление болезненных ощущений в области шеи, поясницы, плеч и лопаток, которые часто связывают с остеохондрозом и артрозом;
- депрессивные состояния, необоснованная тревожность;
- снижение обонятельных ощущений;
- нарушение ночного сна, но в дневное время случается внезапное засыпание;
- проблемы со стулом, в частности, запор.
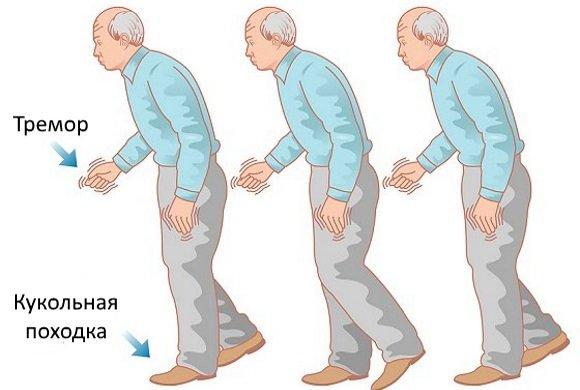
Клиницисты объясняют развитие таких состояний, предшествующих явным двигательным расстройствам, вовлечением при стартовавшей нейродегенерации значительного количества нервных структур. Заболевание от предсимптомной до симптомной стадии проходит в несколько патоморфологических этапов.
- Сначала поражаются дорсальные ядра X черепного нерва и периферическая часть обонятельного центра конечного мозга.
- Затем каскадом повреждаются ствол мозга, ретикулярная субстанция, голубое пятно.
- На предыдущие два этапа в общей сложности уходит примерно от 2 до 4 лет. Только потом, на третьем этапе, начинается прогрессирующая гибель нейронов черного вещества и других структурных компонентов (миндалевидного тела, базальных ганглиев, гипоталамуса).
Далее морфологические нарушения продолжаются, и, начиная с 4 этапа, когда дефицит дофамина составит 60%-80%, открываются клинические симптомы. Их спектр достаточно разнообразен, однако наиболее специфичными проявлениями паркинсонизма являются:
- тремор дистальных отделов конечностей – обычно начинается с одной руки, с прогрессированием заболевания он распространяется на другую руку и нижние конечности;

- дрожание головы и ее отдельных органов – голова дрожит в вертикальном (по типу «да-да») и/или горизонтальном направлении (по типу «нет-нет»), кроме того, могут наблюдаться тремор языка, век и нижней челюсти;

- сокращение непроизвольной двигательной активности – общая скованность, застывание в определенном положении, активные движения в замедленном темпе возобновляются после некоторой задержки (брадикинезия);
- кукольная походка – это когда человек ходит мелкими шажками с постановкой стоп параллельно относительно друг друга, при этом руки содружественно не двигаются и прижаты к туловищу, голова и туловище остаются застывшими;
- амимия лица – застывшая (окаменелая) мимика, не соответствующая происходящим событиям (эмоции радости и плача проявляются с запаздыванием, спадают так же медленно и с отставанием);
- речевые расстройства – речь больного приобретает монотонность и невыразительность, интонации отсутствуют или слабо выражены, склонны к затуханию;
- нарушение письма и почерка – по причине уменьшенного диапазона движений при письме буквы становятся очень мелкими, причем настолько, что написанное автор сам зачастую не в состоянии разобрать;
- мышечная ригидность – это мышечный гипертонус, который в определенных группах мышц приводит к формированию позы «манекена» (спина согнута и вместе с головой наклонена вперед, руки в локтях полусогнуты и примкнуты к телу, а ноги в коленях и тазобедренном отделе фиксированы в положении легкого сгибания);
- утрата постуральных рефлексов – серьезное нарушение координации движений при ходьбе, сопровождающееся трудностями при старте (сложно начать движения) и финише (невозможно остановить инерцию движения) с потерей центра тяжести (возникает на поздних стадиях, часто ведет к травматизму);
- психоз и вегетативные расстройства – отклонения состояния психики выражаются галлюцинаторно-параноидным синдромом, приступами страха, аффектом растерянности, маразмом, склонностью к повторению одних и тех же вопросов; вегетативная дисфункция проявляется ортостатическими нарушениями, проблемами с мочеиспусканием и дефекацией;
- нарушение метаболизма, секреторных функций – часто сопровождается ожирением или стремительной потерей веса до нижних границ, избыточной секрецией слюны, сальной кожей, гипергидрозом.

Диагностика и лечение болезни Паркинсона
Врачи говорят, что, если выявить и начать лечить патологию еще на ранней стадии (в момент самого начала гибели нейронов), можно было бы притормозить скорость разрушающего процесса и не допустить порогового уровня. Так, человек и в 100 лет не ощутил бы признаков заболевания. Но вся беда в том, что вряд ли кто пойдет к врачу в отсутствие проблем. Пациенты обращаются, когда появляются симптомы, но вот с резервами то нейронов уже катастрофа, их почти не осталось, что делает невозможным достижение такого перспективного плана.
В неврологической практике встречается еще одна проблема диагностики: неврологи часто допускают ошибки в установлении диагноза, игнорируя принципы дифференциации и комплексности. Отсюда возникают грубейшие просчеты в назначении симптоматического пособия, пациент получает зачастую неадекватную терапию, порой, в неоправданно поздние сроки. Многих попросту лечат не от той болезни, что есть по существу на самом деле. Либо рекомендуют лекарства и дозы, не соответствующие стадии патогенеза, возрасту пациента, сопутствующим патологиям, роду профессии и т. д. В результате клиническое состояние доходит до критической фазы, из-за чего часто требуется нейрохирургическая помощь, то есть, операция на головном мозге.
Врач обязан провести глубокую оценку моторных, рефлективных, психических расстройств, затем досконально дифференцировать признаки болезни. Однако и этого мало, ведь аналогичная клиника нередко присутствует при других патологиях и синдромах. Например, при гидроцефалии, опухолях мозга, депрессиях, истерии, кататоническом ступоре, синдроме Исаакса, эссенциальном треморе, пр. После осмотра окончательно и достоверно определить, имеет ли место паркинсонизм и какие структуры параллельно страдают, сможет уже только патоморфологическое исследование мозга.
Болезнь Паркинсона – пожизненная патология, полностью избавить от нее невозможно. Больному для улучшения качества жизни могут быть назначены в отдельном виде или в комбинации лекарства-симптоматики:
- агонисты ДА-рецепторов;
- агонисты амантадина;
- ингибиторы моноаминоксидазы Б-типа;
- ингибиторы катехол-О-метилтрансферазы;
- препараты леводопы.
Принцип действия лекарственных средств направлен на коррекцию нарушенного биохимического баланса в базальных ядрах, восполнение недостающих веществ. В итоге, пока их пациент принимает, симптомы устраняются или становятся менее выраженными. После их отмены происходит быстрое возвращение симптомов с тенденцией стремительной прогрессии. Лекарства имеют многообразный спектр противопоказаний и ряд тяжелых побочных эффектов, поэтому должны выбираться очень осторожно хорошим специалистом по неврологии.
Хирургическая операция при болезни Паркинсона
В современной мировой практике для лечения болезни Паркинсона активно применяются хирургические методы. Операции позволяют существенно сгладить симптоматику, поспособствовать заметному улучшению уровня качества жизни. Обратиться к перспективной нейрохирургии иногда очень даже целесообразно. Особенную важность они представляют при предполагаемо продолжительном сроке жизни и крайне неудовлетворительном состоянии. Перечислим все показания, когда проблему уместно решать оперативно:
- фармакотерапия не дает ожидаемого результата, тяжелые симптомы не ликвидируются или устраняются в минимальной степени;
- болезнь сильно прогрессирует и вынуждает повышать количество, дозировку, кратность использования медикаментов, а такие изменения вызывают острую непереносимость организма (дискинезию конечностей, тошноту и рвоту, отечность, выраженный депрессивный и галлюцинаторный синдром, пр.);
- наблюдается быстро развивающаяся утрата трудоспособности, из-за чего без сопровождения и помощи со стороны близких людей обходиться невозможно;
- собственное желание пациента пройти хирургическое лечение ввиду переживаний насчет потери работы, которая требует постоянного контакта и общения с людьми.
Операции по поводу симптомов болезни Паркинсона имеют противопоказания к назначению. В оперативном вмешательстве может быть отказано, если:
- больной старческого возраста (75 лет и старше);
- сильно выражено слабоумие (хирургия усугубит деменцию);
- в организме имеется онкологический процесс;
- присутствуют поражения зрительно-сенсорной системы с частичной слепотой (риск от стандартной операции состоит в абсолютной потере зрения);
- имеется неконтролируемый сахарный диабет (gamma-knife и cyber-knife диабетикам не противопоказаны);
- больного опасно оперировать из-за высокой вероятности наступления мозговой геморрагии (н-р, при осуществляемом лечении антитромботическими препаратами с невозможностью их временной отмены, при резистентной артериальной гипертонии, патологиях системы свертываемости крови, др.).
В нейрохирургическом арсенале для лечения больных с диагнозом «паркинсонизм/болезнь Паркинсона» применяются стереотаксические методики с доказанной эффективностью, это:
- таламотомия;
- паллидотомия;
- глубокая стимуляция мозга;
- радиохирургия на Гамма-ноже или Кибер-ноже.
Главный принцип хирургического лечения базируется на локальном разрушении подкорковых ядер головного мозга, что ответственны за появление дрожательного синдрома и ригидности мышц. Такие операции в значительной мере позволяют пациентам адаптироваться к условиям повседневной жизни, ведь некоторым не под силу даже выполнить элементарные действия – поднести ко рту ложку, поставить подпись, застегнуть пуговицу.
Пройдя нейрохирургическое вмешательство, пациентам, и это первостепенно значимо, возвращаются способности к самостоятельному обслуживанию. Очередной веский аргумент в пользу хирургической терапии – это возможность перейти на самые низкие, неагрессивные лекарственные дозы. Хирургия во многих случаях делает жизнь полноценной или максимально приближенной к норме здорового человека.
Рассмотрим же, что представляют собой все тактики операций, которые спасают людей от тех злостных мучений, уготованных болезнью Паркинсона.
Процедура таламотомии
Таламотомия – стереотаксический прием нейрохирургии, в момент которого оказывается точечное деструкционное воздействие на отдельные ядра и проводящие пути таламуса. Процедура выполняется под местным наркозом, человек остается в сознании и полном контакте с врачом. После обезболивания голова закрепляется в стереотаксической раме. Далее в черепной коробке делается 1,5-саниметровое отверстие, через которое к таламусу под КТ-контролем подводится зонд-электрод. При подаче электротока кончик зонда нагревается до 75-80 градусов, что вызывает абляцию (прижигание) интересующих нервных структур. После вмешательства на череп накладывается стерильная повязка.
Деструкция таламусной области эффективна только при контрлатеральном (одностороннем) треморе. Процедура сложная, долгая (манипуляции занимают до 2 часов), по степени инвазивности средняя. Она показывает в 90% случаев хорошие и отличные результаты. После таламотомии достигается устойчивый и длительный противотреморный эффект, у большинства он отмечается сразу в операционной. Осложнения случаются не сильно часто, у 2% пациентов. Послеоперационные нарушения в основном представлены расстройствами чувствительности и психики, односторонними парезами.
Видео на английском языке, но весьма наглядное:
Операция паллидотомия
Суть паллидотомии заключается в деструкции медиальной части бледного шара с целью подавления его гиперактивности. Бледный шар головного мозга отвечает за регуляцию мышечного тонуса и двигательных способностей. При его чрезмерной активности, как в случае с паркинсонизмом, возникает неадекватное воспроизведение движений. Процедура позволяет пресечь его патологическую импульсацию, которая провоцирует торможение нервных клеток таламуса и моторных областей коры головного мозга.
Эта операция сходна с таламотомией, отличие – функциональная область для прямого нанесения деструкции. Этот способ может быть рассмотрен в качестве лечения дискинезий от приема леводопы, сочетающихся с болезненным спазмированием мышц. Улучшение при таких дискинезиях наступает в 90% случаев, ригидность и брадикинезию сократить удается в 80%, тремор – только в 50-55%. Безусловно, если операция была проведена безупречно. Однако если у пациента ведущим симптомом выступает тремор, проводить паллидотомию неуместно, предпочтительнее таламотомия.
В ходе манипуляций на бледном шаре крайне важно использовать самые щадящие интраоперационные системы деструкции (например, криозонды) для столь уязвимого участка.
По причине близкого расположения зрительного тракта и внутренней капсулы, индивидуальной вариабельности размеров БШ от паллиодотомии в ведущих клиниках мира все чаще стали отказываться. Методика сопряжена высокими рисками необратимых последствий: выпадением полей зрения, внутримозговыми кровоизлияниями, дизартриями и др.
Метод глубокой стимуляции мозга
Уникальная методика Deep Brain Stimulation, изобретенная в 80-х годах французскими специалистами, стала хорошей альтернативой таламо- и поллидотомии. Техника ее проведения состоит во вживлении электродов в мозг. Они будут обеспечивать должный контроль над тремором, скованностью и замедленностью движений, распознавая и блокируя аномальные сигналы ЦНС. Эта процедура нейростимуляции не подойдет пациентам с немоторными нарушениями.
Миниинвазивный сеанс осуществляется в 2 этапа. На первом этапе под местной анестезией через крошечное отверстие в черепе в зону субталамического ядра вводятся специальные электроды. Для высокоточного и безопасного внедрения электродов используется трехмерная КТ-навигация. Свободные концы электродов оставляют под кожей головы. В течение примерно 1 недели импланты тестируются и настраиваются посредством магнитных приборов. По достижении необходимого эффекта переходят ко второму этапу.
На втором этапе выполняется имплантация импульсного генератора под кожу, немного ниже ключицы. Концы электродов соединяют с генератором электроимпульсов, затем на область рассечения кожи накладывается косметический шов. После окончания вмешательства выполняется контрольная проверка работы установленной системы. Первое время в месте операции могут беспокоить болезненные явления, которые постепенно сойдут на нет. В целом процедура переносится относительно легко и редко осложняется последствиями. Выраженность тремора сокращается, как показывают наблюдения, во многих случаях на 85% и более.
При выписке больному выдается специальный пульт магнитного действия, которым можно будет выключить или включить основное устройство. В случае усиления симптомов, врач изменит настройки нейростимулятора, используя только внешние источники управления. Стимулятор работает от батарей, срок службы которых составляет 5 лет и более, самые последние модели рассчитаны на срок эксплуатации до 10 лет.
Радиохирургия на Гамма-ноже, Кибер-установках
Радиохирургические операции на Гамма и Кибер ножах приобрели грандиозный успех в нейрохирургическом мире. Такие процедуры безопасны, безболезненны и бескровны, поскольку проводятся без вовлечения методов трепанации и разрезов, не требуют прямого контакта хирургических инструментов с тканями головного мозга. Пациента не нужно госпитализировать, сеанс проходит в амбулаторных условиях. По терапевтической мощи передовые технологии не уступают, а иногда даже превосходят классические операции.

Гамма-нож и Кибер-нож – «золотой стандарт» современной радиохирургии. С их помощью всего за 1 сеанс устраняются очаги, вызывающие клинику болезни Паркинсона. Работают методики по принципу прицеленного воздействия радиоактивным потоком лучей на патологическую область, к примеру, на таламус или бледный шар. В участки, которые виновны в появлении дрожательного синдрома и других нарушений, поступает концентрированная доза радиации. Под действием радиоактивной энергии облучаемый объект разрушается и обезвреживается, а вслед за этим наступает облегчение для пациента.
За процессом посредством компьютерного оборудования будет следить врач из соседнего кабинета. Облучения бояться не стоит, «умные» установки работают только в изолированном поле, четко в избранной точке. Поэтому они не окажут негативного влияния на организм и близлежащие структуры головного мозга. Пациенту нужно просто от 30-60 минут полежать на столе установке. А уже через час после проведенной терапии он сможет покинуть лечебное учреждение, на следующий день вернуться к повседневной деятельности. Эффективность лечения тремора на системе Гамма- или Кибер-нож составляет 95% и более.
Профильные клиники
В Европе одним из лидеров в области нейрохирургического лечения и реабилитации пациентов с диагнозом болезни Паркинсона является Чехия. Чехия имеет огромный опыт в восстановлении опорно-двигательных функций и утраченного потенциала ЦНС не только при паркинсонизме, но и при болезни Альцегеймера, эпилепсиях, мозговых новообразованиях. Медицинская помощь предоставляется по современным стандартам нейрохирургии.
Чешские специалисты практикуют исключительно проверенные, действенные и щадящие технологии, актуальные нынешнему времени. Клиники Чешской Республики – учреждения с мировым именем, которые не уступают медучреждениям Германии и Израиля. И при этом цены на радио- и нейрохирургическую помощь при паркинсонизме в Чехии в разы доступнее (не менее чем в 1,5 раза ниже), чем в этих странах.
Источник: msk-artusmed.ru
Анатомия и физиология нервной системы
Все движения, осуществляемые человеком, контролируются центральной нервной системой, в которую входят головной и спинной мозг. Это очень сложно организованная система, отвечающая практически за всё, что происходит в организме. Роль высшей нервной деятельности принадлежит коре головного мозга. Стоит человеку лишь подумать о каком-либо намеренном движении, кора уже приводит в готовность все системы, ответственные за это движение. Одной из таких систем являются так называемые базальные ганглии.
 Базальные ганглии – это вспомогательная двигательная система. Они работают не самостоятельно, а лишь в тесной связи с корой головного мозга. Базальные ганглии участвуют в выполнении сложных комплексов движений, таких как писание, рисование, ходьба, забивание мяча в ворота, завязывание шнурков и т.д. Они отвечают за то, как быстро осуществляется движение, а также за точность и качество этих движений. Подобные движения являются произвольными, то есть изначально возникают в коре головного мозга. Отсюда информация о данных движениях поступает в базальные ганглии, которые определяют какие мышцы будут в них участвовать и насколько каждая из мышц должна быть напряжена, чтобы движения были максимально точными и целенаправленными.
Базальные ганглии – это вспомогательная двигательная система. Они работают не самостоятельно, а лишь в тесной связи с корой головного мозга. Базальные ганглии участвуют в выполнении сложных комплексов движений, таких как писание, рисование, ходьба, забивание мяча в ворота, завязывание шнурков и т.д. Они отвечают за то, как быстро осуществляется движение, а также за точность и качество этих движений. Подобные движения являются произвольными, то есть изначально возникают в коре головного мозга. Отсюда информация о данных движениях поступает в базальные ганглии, которые определяют какие мышцы будут в них участвовать и насколько каждая из мышц должна быть напряжена, чтобы движения были максимально точными и целенаправленными.
Базальные ганглии передают свои импульсы с помощью специальных химических соединений, называемых нейромедиаторами. От их количества и механизма действия (возбуждающий или тормозящий) зависит, как будут работать мышцы. Основным нейромедиатором является дофамин, который тормозит избыток импульсов, и тем самым контролирует точность движений и степень сокращения мышц.
При болезни Паркинсона поражаются определённые участки базальных ганглиев. В них отмечается уменьшение количества нервных клеток и разрушение нервных волокон, по которым передаются импульсы. Также характерным признаком этого заболевания является снижение количества дофамина. Его становится недостаточно для торможения постоянных возбуждающих сигналов коры головного мозга. Эти сигналы получают возможность проходить прямо до мышц и стимулировать их сокращение. Этим объясняются основные симптомы болезни Паркинсона: постоянные мышечные сокращения (тремор, дрожание), скованность мышц из-за чрезмерно увеличенного тонуса (ригидность), нарушение произвольных движений тела.
Причины болезни Паркинсона
 Учёным до сих пор не удалось выявить точные причины возникновения болезни Паркинсона, однако существует определённая группа факторов, которые могут спровоцировать развитие этого заболевания.
Учёным до сих пор не удалось выявить точные причины возникновения болезни Паркинсона, однако существует определённая группа факторов, которые могут спровоцировать развитие этого заболевания.
- Старение – с возрастом количество нервных клеток снижается, это приводит и к снижению количества дофамина в базальных ганглиях, что может спровоцировать болезнь Паркинсона;
- Наследственность – несмотря на то, что ген болезни Паркинсона до сих пор не выявлен, у многих пациентов выявлено наличие этой болезни в генеалогическом древе, в частности детская форма заболевания объясняется именно генетическими факторами;
- Факторы окружающей среды – различные токсины, пестициды, тяжёлые металлы, ядовитые вещества, свободные радикалы могут спровоцировать гибель нервных клеток и привести к болезни Паркинсона;
- Лекарственные препараты – некоторые нейролептические препараты (например, антидепрессанты) нарушают обмен дофамина в центральной нервной системе и вызывают побочные эффекты, схожие с симптомами болезни Паркинсона;
- Травмы и заболевания головного мозга – ушибы, сотрясения, а также энцефалиты вирусного или бактериального происхождения могут повредить структуры базальных ганглиев и спровоцировать болезнь;
- Неправильный образ жизни – к болезни Паркинсона могут привести такие факторы риска, как недосыпание, постоянные стрессы, неправильное питание, авитаминозы и др.;
- Другие заболевания – атеросклероз, злокачественные опухоли, заболевания эндокринных желез могут привести к такому осложнению, как болезнь Паркинсона.
Симптомы и признаки болезни Паркинсона
| Симптом | Проявление | Механизм возникновения |
| Тремор (постоянное непроизвольное дрожание) |  |
Избыточное стимулирующее влияние центральной нервной системы на мышцы ведёт к появлению постоянного дрожания конечностей, головы, век, нижней челюсти и др. |
| Ригидность (скованность и сниженная подвижность мышц) |  |
Отсутствие тормозящего действия дофамина ведёт к чрезмерному повышению тонуса мышц, отчего они становятся твёрдыми, неподвижными, теряют эластичность. |
| Гипокинезия (снижение двигательной активности) |  |
При разрушении базальных ганглиев, отвечающих за выполнение различных движений, появляется общая скованность, неподвижность, медленные движения, редкие моргания и т.д. |
| Брадифрения (замедленные мышление, речь, эмоциональные реакции) |  |
Из-за разрушения нервных клеток и снижения количества дофамина в центральной нервной системе нарушаются мыслительные процессы, быстрота реакции, проявление эмоций, речь становится невнятной, тихой, монотонной. |
| Постуральная неустойчивость (снижение способности удерживать равновесие) |  |
Так как регуляция движений при ходьбе осуществляется базальными ганглиями, то при их разрушении нарушается способность удерживать равновесие, переходить из одной позы в другую, шаги становятся медленными и короткими. |
| Вегетативные и психические расстройства |  |
При болезни Паркинсона отмечаются также общие нарушения деятельности нервной системы: бессонница, деменция, нарушение слюновыделения, обмен веществ и др. |
Как выглядят люди с болезнью Паркинсона?
 Для людей, страдающих болезнью Паркинсона, характерна скованность всего тела, руки обычно прижаты к туловищу и согнуты в локтях, ноги расположены параллельно друг другу, тело немного наклонено вперёд, голова вытянута, как будто подпирается подушкой. Иногда можно заметить лёгкое дрожание всего тела, особенно конечностей, головы, нижней челюсти, век. Из-за паралича мимических мышц лицо приобретает выражение «маски», то есть не выражает эмоций, спокойное, человек редко моргает или улыбается, взгляд надолго задерживается в одной точке. Походка страдающих болезнью Паркинсона очень медленная, неуклюжая, шаги маленькие, неустойчивые, руки при ходьбе не двигаются, а остаются прижатыми к туловищу. Также отмечаются общая слабость, недомогание, депрессия.
Для людей, страдающих болезнью Паркинсона, характерна скованность всего тела, руки обычно прижаты к туловищу и согнуты в локтях, ноги расположены параллельно друг другу, тело немного наклонено вперёд, голова вытянута, как будто подпирается подушкой. Иногда можно заметить лёгкое дрожание всего тела, особенно конечностей, головы, нижней челюсти, век. Из-за паралича мимических мышц лицо приобретает выражение «маски», то есть не выражает эмоций, спокойное, человек редко моргает или улыбается, взгляд надолго задерживается в одной точке. Походка страдающих болезнью Паркинсона очень медленная, неуклюжая, шаги маленькие, неустойчивые, руки при ходьбе не двигаются, а остаются прижатыми к туловищу. Также отмечаются общая слабость, недомогание, депрессия.
Диагностика болезни Паркинсона

На сегодняшний день не существует каких-либо лабораторных анализов, способных подтвердить или опровергнуть наличие болезни Паркинсона. Это создаёт определённые трудности в диагностике данного заболевания, а также в различии истинной болезни Паркинсона от других заболеваний со схожими симптомами.
Диагноз болезни Паркинсона ставится после тщательного физического обследования, а также подробного составления истории заболевания.
Этапы диагностики болезни
| Этап диагностики | Принцип диагностики | Выявляемые признаки |
| 1 этап | Выявление симптомов, указывающих на наличие паркинсонизма | Данный этап включает в себя физическое обследование пациента на момент обращения к врачу. Он позволяет выявить основные признаки болезни Паркинсона: постоянное мышечное дрожание, скованность мышц, сложность с удержанием равновесия или выполнением направленных движений. |
| 2 этап | Выявление признаков, исключающих болезнь Паркинсона и указывающих на другое заболевание со схожими внешними проявлениями | 1)Наличие в истории заболевания повторных инсультов, травм головы, опухолей мозга; 2)Лечение нейролептиками или отравление различными токсинами; 3)Нарушение движения глаз (отклонение вверх и в сторону, паралич взгляда); 4)Специфическое начало заболевания (длительная ремиссия, ранние признаки слабоумия, симптомы, проявляющиеся только с одной стороны тела более 3-х лет и т.д.); 5) Рефлекс Бабинского (резкое разгибание большого пальца ноги при лёгком прикосновении к стопе); 6)Отсутствие улучшений после начала приёма противопаркинсонических препаратов. |
| 3 этап | Подтверждение наличия болезни Паркинсона | 1)Длительное течение заболевания; 2)Прогрессирование заболевания; 3)Наличие улучшений после начала приёма противопаркинсонических препаратов; 4)Проявление симптомов сначала с одной стороны тела, позже – с другой; 5)Феномен Вестфаля (при пассивном сгибании сустава близлежащие мышцы сокращаются вместо расслабления и сустав остаётся в согнутом положении); 6)Симптом голени (пациент ложится на живот, максимально сгибает ногу в колене, после чего она разгибается медленно и не полностью). |
При необходимости врач может назначить дополнительные инструментальные исследования, однако их эффективность в диагностике болезни Паркинсона остаётся под вопросом. К таким исследованиям относятся:
- Электроэнцефалография (исследование электрической активности мозга);
- Компьютерная томография головного мозга (послойное рентгеновское исследование головного мозга);
- Магнитно-резонансная томография головного мозга (электромагнитное исследование структур головного мозга);
- Электромиография (исследование биоэлектрических процессов мышечной ткани).
Лечение болезни Паркинсона
 К сожалению, на сегодняшний день болезнь Паркинсона остаётся неизлечимой.
К сожалению, на сегодняшний день болезнь Паркинсона остаётся неизлечимой.
Однако существует множество методов, способных замедлить прогрессирование болезни, а также улучшить её симптоматику.
Традиционное лечение болезни Паркинсона
| Метод лечения | Принцип лечения | Как проводится |
| Медикаментозное лечение | Восполнение нехватки дофамина в центральной нервной системе | Применяются препараты, содержащие предшественники дофамина (Леводопа), а также его агонисты (Бромокриптин, Лизурид, Ропинирол и др.) |
| Блокирование ферментов, разрушающих дофамин | С этой целью назначают ингибиторы МАО (Селегинин) и КОМТ (Толкапон, Энтакапон) | |
| Облегчение выхода дофамина из клеток | Данные препараты способствуют выбросу запасов дофамина (Амантадин, Бемантан и др.) | |
| Снижение возбуждающего действия ацетилхолина (возбуждающий нейромедиатор) | Эти препараты уравновешивают возбуждающее и тормозящее действие нервных клеток (Тригексифенидил, Бипериден, Проциклидин и др.) | |
| Снижение возбуждающего действия глутамата (возбуждающий нейромедиатор) | С этой целью назначают блокаторы рецепторов глутамата (Мемантадин, Амантадин) | |
| Дополнительные препараты для устранения некоторых симптомов | К таким препаратам относятся антидепрессанты, нейролептики, антигистаминные препараты, миорелаксанты и др. | |
| Хирургическое лечение | Электростимуляция структур головного мозга, ответственных за двигательную активность | В определённые структуры головного мозга вводятся электроды, соединяющиеся с нейростимулятором, который имплантируется под кожу в области груди. Такая операция значительно улучшает состояние больного, а также замедляет прогрессирование болезни. |
| Разрушение определённых структур головного мозга | Для устранения тремора иногда прибегают к таламотомии(разрушение определённых ядер гипоталамуса). При паллидотомии (разрушение участка базальных ганглиев) наблюдается улучшение двигательных функций. Однако, такие операции очень рискованны и обладают большим количеством побочных эффектов. |
Альтернативное лечение болезни Паркинсона
| Состав | Способ приготовления | Как принимать | Эффект |
| -высушенные цветки липы; -спирт медицинский разбавленный 40% |
Залить цветки спиртом, дать настояться 2-3 недели, процедить | 3 раза в день по 1-2 чайной ложке, после еды | Выраженный противосудорожный эффект |
| -1 стакан овса; -2 л дистиллированной воды |
Залить овёс водой, кипятить на медленном огне 40 минут, затем дать настояться 1-2 дня, процедить | 3 раза в день по половине стакана, до еды, курс приёма – 2 месяца, после перерыва можно возобновить курс | Отвар снимает тремор, способствует расслаблению мышц |
| -30 г прополиса | Разделить на порции по 1 г | Жевать утром и вечером, до еды, курс – 15 дней, затем следует сделать перерыв | Помогает снять мышечную дрожь, улучшает двигательную активность |
| -2 ст л шалфея; 2 стакана кипятка |
Залить шалфей кипятком, дать настояться 10 часов, процедить | 4 раза в день по половине стакана, до еды | Противосудорожный, расслабляющий эффект |
| -3 ст л высушенного зверобоя; -1 стакан кипятка |
Залить зверобой кипятком, дать настояться 5 часов, процедить | 2 раза в день по половине стакана, до еды, курс приёма – 2 месяца, после перерыва можно повторить курс | Настой облегчает симптомы болезни, улучшает самочувствие |
| ВНИМАНИЕ! Лечение народными средствами не заменяет медикаментозного лечения, прописанного лечащим врачом! |
Другие способы лечения болезни Паркинсона
| Вид лечения | Способ лечения | Эффект |
| Лечебный массаж |
Интенсивное массирование мышц всего тела |
Способствует расслаблению мышц, снимает болезненность, восстанавливает кровоток в мышцах |
| Лечебная физкультура |
Активные упражнения, подобранные индивидуально с помощью лечащего врача |
Интенсивные движения способствуют улучшению питания и работы мышц и суставов, восстанавливают двигательную активность |
| Упражнения для развития речи |
Речевые упражнения, подобранные индивидуально с помощью логопеда | Улучшают речь, способствуют улучшению работы мимических и жевательных мышц |
| Диета | Питание, богатое растительной пищей, со сниженным содержанием холестерина, подобранное индивидуально с помощью диетолога | Способствует улучшению обменных процессов в нервных клетках, повышению эффективности работы центральной нервной системы |
Первичная и вторичная профилактика болезни Паркинсона

Дают ли инвалидность при болезни Паркинсона?
Установление группы инвалидности проводится по результатам медико-социальной экспертизы в соответствии с приказом Министерства здравоохранения и социального развития Российской Федерации от 22 августа 2005 г. N 535, согласно которому существуют определённые классификации и критерии, по которым определяется группа инвалидности. Оцениваются обычно нарушения основных функций организма (психических, двигательных, зрения, слуха, дыхания, кровообращения и т.д.), а также способности к самообслуживанию, общению, передвижению, трудовой деятельности.
Существует 3 группы инвалидности:
— первая группа: человек не может обходиться без посторонней помощи, не передвигается самостоятельно, соблюдает постельный режим, не трудоспособен;
— вторая группа: человек способен к самообслуживанию в ограниченной степени, проявление симптомов двухстороннее, выраженная постуральная неустойчивость, ограниченная трудовая деятельность;
— третья группа: человек способен к самообслуживанию, проявление симптомов двухстороннее, отсутствие или умеренная постуральная неустойчивость, сниженная трудовая деятельность.
От чего зависит продолжительность жизни страдающих болезнью Паркинсона?
Продолжительность жизни людей с болезнью Паркинсона зависит от своевременной постановки диагноза и эффективности лечения. При обнаружении заболевания на ранних стадиях, эффективного медикаментозного лечения, соблюдения диеты и правильного образа жизни, а также при регулярном проведении различных физиопроцедур (массаж, гимнастика) продолжительность жизни практически не изменяется.
Каков прогноз при болезни Паркинсона?
Так как болезнь Паркинсона является неизлечимой, прогноз этого заболевания, как правило, неблагоприятный. Прогрессирование болезни остановить невозможно. Оно зависит от множества факторов, включая генетические, физиологические, экологические и др. Однако, при эффективном лечении, проведении различных физиопроцедур и соблюдении адекватной диеты развитие заболевания можно замедлить, а качество жизни – улучшить.
Источник: www.polismed.com
