Всем нам с детства знакома такая процедура, как анализ крови. Кровь необходима как для простых исследований, так и высокотехнологичных генетических тестов. Человек приходит с утра в больницу, врач забирает небольшое количество биоматериала в пробирку, и через какое-то время мы получаем результат. Что же происходит между этим? Как нам удалось выяснить — много интересного!
***
Чтобы посмотреть за тем, как кровь исследуется и какие тесты с ней можно провести, мы отправились в «Инвитро». 4 октября медицинская компания открыла в Новосибирске новый большой лабораторный комплекс, где будут выполняться более двух тысяч видов тестов для пациентов со всей Сибири и Дальнего Востока. Здесь и прошла наша экскурсия.
Цель материала — показать, что происходит с пробирками крови и другими биоматериалами, когда они отправляются на исследования. Ведь мы, обычные люди, достаточно регулярно обращаемся в лаборатории к специалистам, в чьих руках оказывается наше здоровье. И от того, как проходит процесс исследования, зависит и результат, который мы получим.
По словам экспертов, лабораторные исследования включают три основных этапа: преаналитический, аналитический и постаналитический. Заместитель заведующего клинико-диагностической лабораторией ООО «Инвитро-Сибирь» Валентина Андрушкевич рассказала, что первый этап начинается, как ни странно, с мысли: у человека, который решил что-то у себя проверить, или у врача, принимающего пациента. Важную роль играет подготовка к анализам, это влияет на конечный результат. Так, общий анализ крови нужно сдавать натощак, но нельзя голодать свыше 14 часов. Перед каждым исследованием следует внимательно ознакомиться с подготовкой к нему.
И вот, за мыслью следует действие — человек идет в медицинский офис (перед сдачей анализов проконсультируйтесь с врачом). В новом медцентре для клиентов сделали индивидуальные кабинки, чтобы сохранить приватность разговора со специалистом. Также работает электронная очередь.

Сегодня многие медицинские центры при регистрации пациентов используют программу, создающую индивидуальные баркоды, также именуемые штрихкодами. В дальнейшем это позволяет упростить процесс идентификации пациента для приборов, которые проводят распределение пробирок и продолжают исследование. Кроме того, такая процедура необходима для исключения подмены, потери пробирок и быстрого выполнения исследований. После регистрации пациент отправляет в процедурный кабинет.
— Люди по-разному переносят процедуру взятия крови, поэтому в процедурных кабинетах есть как кресло, так и кушетка, — поясняет Валентина Андрушкевич. — Для взятия биоматериала мы используем только одноразовые расходные материалы, для нас это не просто государственный стандарт, это жизненно необходимый момент для наших пациентов. Вакуумные пробирки безопасны для сдающего кровь и позволяют сохранять аналиты (так еще называют биоматериалы) необходимое время для проведения основных и дополнительных тестов.



После того, как кровь оказалась в пробирке, ее отправят дальше — в регистратуру. В данном случае регистратурой называется лаборатория преаналитической подготовки. Здесь отмечают прибывший биоматериал в специальной программе, после чего приборы видят задание на исследование.
Биоматериалы поступают в лабораторию двумя большими потоками. Тот, который берут в процедурном кабинете, уже зарегистрирован и первично обработан. В программе регистратуры фиксируется прибытие аналита, лабораторная информационная система (ЛИС) уже видит задание на исследование. Второй поток — то, что приходит от других медучреждений — партнеров «Инвитро». Сначала происходит регистрация пробирок и баркодирование, присваивается индивидуальный код заказа. Данные с ручного бланка, где врач отметил, какие нужны анализы, переносятся в программу.
— Пробы поступают в лабораторию круглосуточно. Перевозка биоматерила осуществляется всеми доступными видами транспорта. Используются разные температурные режимы доставки, в частности, режим от +2°С до +8°С и режим -20°С. Необходимая температура для сохранности проб обеспечивается специальными сертифицированными термоконтейнерами. Выбор режима хранения и транспортировки каждого биоматериала происходит в соответствии с ГОСТом, — рассказывает Валентина Андрушкевич.
Существует заблуждение, что кровь возить нельзя, но на самом деле это не так. Биоматериал можно перевозить в большинстве случаев. Если анализы не подлежат длительному хранению, то их и не перевозят. Например, материал для спермограммы принимается только в медицинском офисе при лаборатории.



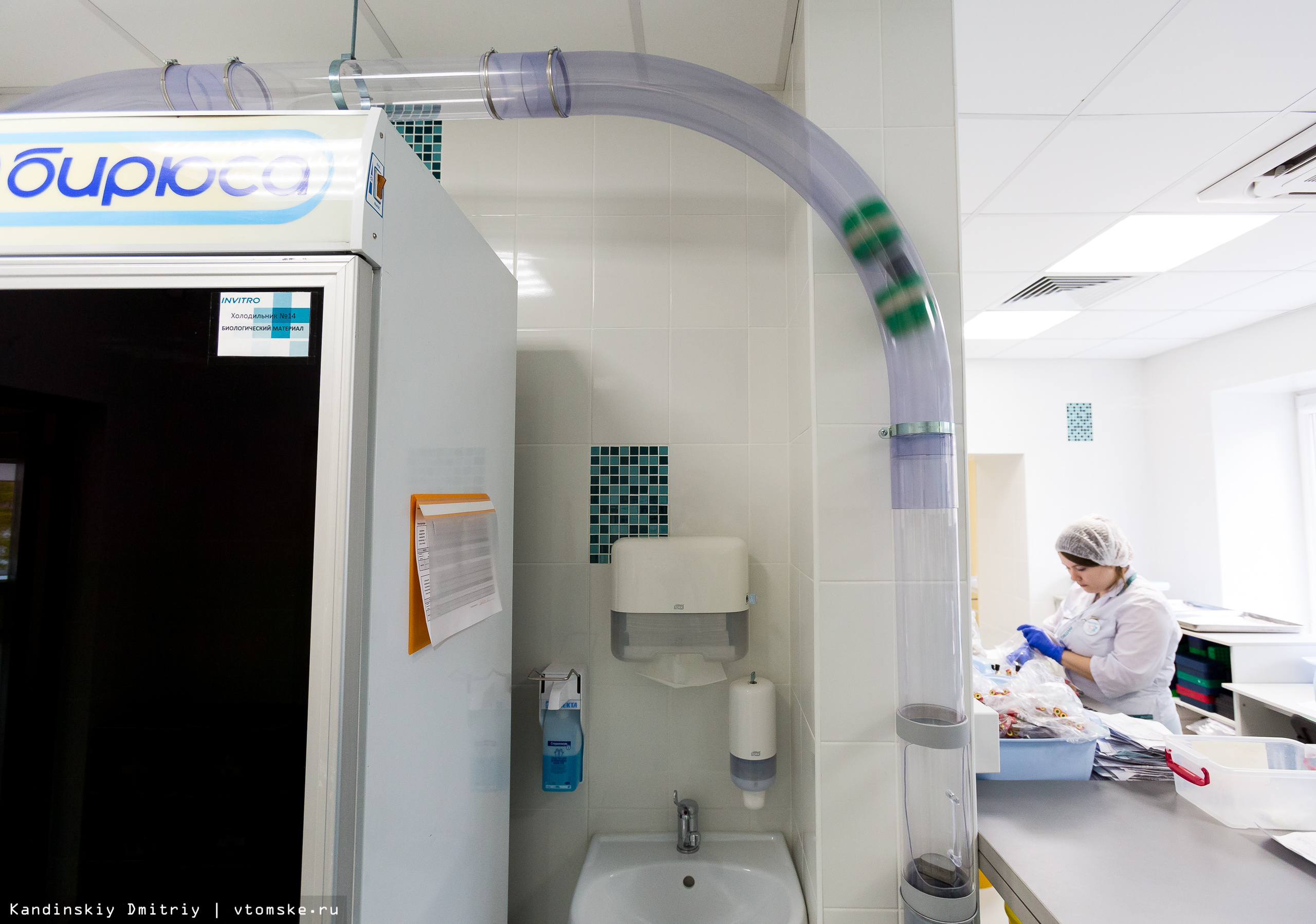
Многие лаборатории на сегодняшний день практикуют выполнение срочных исследований, которые называются cito. По своему опыту могу сказать, что цена на тесты такого формата выше, но результат пациент получит в течение двух-четырех часов. В новой лаборатории пробирки для cito-анализов из процедурного кабинета в регистратуру отправляются пневмопочтой (система перемещения грузов под действием сжатого или, наоборот, разреженного воздуха). Такая посылка прибывает в место назначения меньше чем за десять секунд. Мы сами смогли в этом убедиться.


После всех регистрационных процедур для пробирки наступает аналитический этап исследований, который проходит в разных подразделениях.
Наша первая остановка — лаборатория общеклинических, биохимических и иммунохимических исследований. Помещения и оборудование лаборатории — настоящие роботизированные комплексы. Высокотехнологичное оборудование проводит анализ и выводит результаты в онлайн-режиме в лабораторную информационную систему.
— В зоне гематологии находятся гематологические анализаторы для выявления количественных показателей клеток крови, — показывает Валентина Андрушкевич. — Для точности результата кровь предварительно нужно перемешать, так как она оседает. Этим процессом заведует отдельное вспомогательное оборудование. Перемешивание пробирок происходит перед любыми тестами.


Пробирки с сиреневыми крышечками отправляются на общий анализ крови. Он выполняется в гематологическим анализаторе Sysmex. В данном случае перемешивание пробирок на отдельном оборудование не требуется, анализатор делает все сам. Результаты анализов сбрасываются в систему, их можно увидеть на мониторе. Но никаких фамилий там нет, только баркоды пациентов и итоги тестов.
Программа сама оценивает итоги согласно заложенным в нее правилам — нормам, которые должны быть. Если анализ нормальный, он автоматически подтверждается системой и сбрасывается дальше в ЛИС. Если образец имеет патологические отклонения, система дает сигнал, и пробирка пойдет на микроскопию.


— В случае выявления патологии готовится мазок крови, и врач будет смотреть его в микроскоп. Специалист скорректирует результат анализа и внесет его в систему, — добавила эксперт.


Напротив гематологических анализаторов располагается оборудование для автоматизированного исследования мочи. Что касается данного исследования, он в целом предусматривает микроскопию осадка мочи. На отдельном аппарате в лаборатории проводится химические исследование биоматериала, а на отдельном оборудовании — именно микроскопия.
— Это высокопроизводительное оборудование, которое позволяет быстро микроскопировать осадки мочи и описывать их — сколько солей, лейкоцитов, эритроцитов. Экспертная оценка здесь присутствует: специалист смотрит на итоги исследований и при наличии патологии будет выполнена дополнительная микроскопия, но уже врачом. Несмотря на технологии, специалист все равно остается во главе угла, — подчеркивает Андрушкевич.

Иногда пациенту требуется сдать кровь на несколько исследований. Конечно, в этом случае его не будут колоть несколько раз и заполнять множество пробирок, хватит одной. Но разные анализы выполняют разные группы приборов. Чтобы пробирка прошла по всем аппаратам, работает специальная программа и робот-сортировщик. К нему пробирки поступают из регистратуры, робот снимает с них крышечку и расставляет по штативам, куда должен пойти образец крови. Когда штатив будет заполнен, он выскочит, и специалист заберет его.
Сортировщик работает очень плавно — на данном этапе кровь встряхивать и перемешивать нельзя — и при этом быстро. Робот помогает как ускорить работу без потери качества, так и обеспечить биобезопасность для медперсонала.






Кстати, для приготовления реагентов в лаборатории используют ионизированную воду — кроме молекул воды в ней больше ничего нет. Пить такую воду нельзя, но она позволяет добиться точного результата при проведении тестов. К каждому прибору вода подводится индивидуально, по трубкам, что позволяет сохранить ее чистоту.
На отдельном этаже в лабораторном комплексе находится ПЦР-лаборатория, где выполняются генетические исследования (выявление предрасположенности к тем или иным заболеваниям, наследственность и так далее) и выявление инфекций. В ней — очень строгие санитарные правила, поскольку диагностика — очень точная и порой хватает несколько сторонних клеток, чтобы повлиять на результат. Поэтому сотрудники медцентра провели для нас виртуальный тур.
ПЦР-лаборатория выполняет от четырех до шести тысяч исследований, выявляет более 50 инфекционных маркеров и свыше 20 генетических маркеров патологии человека. Все помещения лаборатории находятся в особом режиме изоляции, оснащены предбоксами, имеют особый график кварцевая, три изолированные приточно-вытяжные системы. Все операции контролируются через программное обеспечение. Все это позволяет исключить погрешности в результатах.


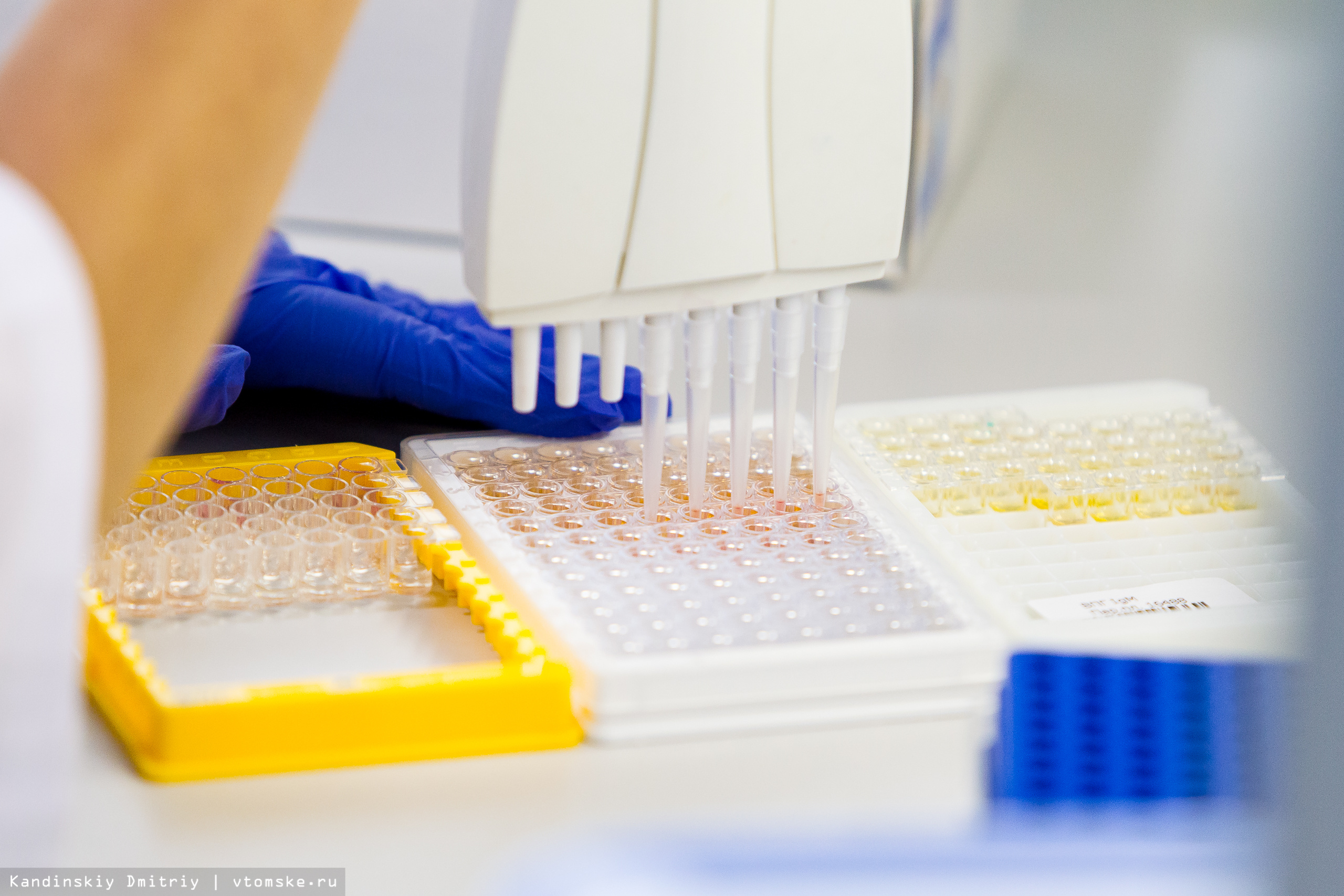
Как рассказала врач группы по контролю качества лаборатории Екатерина Томзикова, для ряда тестов пока не существуют приборы, которые бы делали исследования автоматически, поэтому специалисты проводят их вручную. Последнее место в нашей экскурсии — лаборатория иммуноферментного анализа.
— В месяц в данной лаборатории выполняется порядка 40 тысяч тестов. Несмотря на то, что это ручные методики, на помощь специалистам приходит свой робот-сортировщик. Здесь мы смотрим гормоны, выполняем тесты на аллергию, большое число аутоиммунных маркеров, — уточнила Томзикова.



Вначале материала я упоминала про три этапа лабораторных исследований. Аналитический подошел к концу. Постаналитика включает в себя консультации пациентов врачами касательно результатов исследований: что они означают, нужно ли обращаться к специалисту.

P.S. Казалось бы, анализ крови, что может быть проще? Но за этими двумя словами скрывается масса операций которую стоит провести, чтобы пациент получил верный результат. Конечно, не стоит забывать и о подготовке к исследованию со стороны самого пациента. А вообще — будьте здоровы и болейте меньше!
Имеются противопоказания, необходимо проконсультироваться со специалистом.
Данный материал не носит коммерческий или заказной характер и выходит в рамках рубрики «Знай город»
Источник: news.vtomske.ru
Анализ результатов исследования крови составляет неотъемлемое звено в диагностическом процессе. При анализе гемограммы любые изменения трактуют как патологические, что требует тщательного обследования пациента. Они могут иметь неспецифический характер, и в этих случаях их используют для динамического наблюдения за больным. При системных заболеваниях кроветворной системы общий анализ крови приобретает первостепенное диагностическое значение. Его результаты определяют дальнейшую стратегию обследования пациента с последующим выбором схемы лечения. Анализ необходим для мониторинга проводимой терапии.
Следует учитывать влияние различных факторов на результаты гематологических исследований. Это такие физиологические факторы, как возраст, пол, особенности питания, физическая нагрузка, менструальный цикл, беременность, роды; к факторам окружающей среды относят климатические условия, высоту над уровнем моря, температуру окружающей среды, к токсическим факторам — курение, прием алкоголя, наркотиков, лекарственных препаратов, профессиональные вредности.
На показатели крови оказывают влияние эмоциональное состояние пациента, циркадные и сезонные ритмы, положение пациента в момент взятия крови.
С увеличением высоты над уровнем моря повышается уровень гематокрита и гемоглобина. Физические упражнения могут приводить к существенным изменениям количества лейкоцитов, что обусловлено гормональными сдвигами. Смена пациентом положения тела (лежа, стоя) приводит к повышению показателей гемоглобина, гематокрита и количества эритроцитов и лейкоцитов. Этот эффект обусловлен проникновением воды и фильтрующихся веществ из сосудистого русла в ткани в результате повышения гидростатического давления. Выраженные диарея и рвота могут приводить к значительной дегидратации и гемоконцентрации, и, наоборот, после регидратации наблюдают снижение уровня гемоглобина и гематокрита, что может быть ошибочно принято за кровопотерю.
Для устранения или сведения к минимуму влияния этих факторов кровь для повторных анализов необходимо брать в одних и тех же условиях.
Кровь для клинического анализа берут у пациента из пальца, вены или мочки уха, у новорожденных — из пятки. Кровь следует брать натощак (после примерно 12 ч голодания, воздержания от приема алкоголя и курения), между 7 и 9 ч утра, при минимальной физической активности непосредственно перед взятием (в течение 20-30 мин), в положении пациента лежа или сидя. Взятие материала следует проводить в резиновых перчатках, соблюдая правила асептики.
Венозная кровь
Венозную кровь считают лучшим материалом для клинического исследования. Достоверность и точность гематологических исследований, проводимых из венозной крови, во многом зависят от техники взятия крови. Кровь для гематологических исследований должна поступать свободным током непосредственно в пробирку, содержащую антикоагулянт К2ЭДТА (К3ЭДТА). Взятие крови шприцем без антикоагулянта с последующим переливанием в пробирку недопустимо из-за формирования микросгустков и гемолиза.
Взятие крови вакуумными системами имеет ряд преимуществ, основными из которых являются обеспечение высокого качества пробы и предотвращение любого контакта с кровью, а значит, обеспечение безопасности медицинского персонала и пациентов.
ЭДТА (К2ЭДТА ИЛИ К3ЭДТА) — предпочтительный антикоагулянт при подсчете форменных элементов крови с использованием автоматических гематологических анализаторов.
Использование 2ЭДТА не рекомендуют вследствие его плохой растворимости. Концентрация ЭДТА во взятой крови должна быть постоянной и составлять 1,5-2,2 мг/мл крови.
Применение в качестве антикоагулянтов гепарина или цитрата натрия сопровождается структурными изменениями клеток, поэтому эти антикоагулянты не рекомендуют для использования как при автоматизированном, так и морфологическом исследовании крови. Необходимо строго следить за количеством взятой крови, объем которой должен соответствовать указанной отметке на пробирке. Несоблюдение этого условия, а также недостаточно тщательное перемешивание крови приводит к изменению конечной концентрации антикоагулянта, что может повлечь появление микросгустков, неточное определение концентрации клеточных элементов, искажение морфологической структуры клеток.
Капиллярная кровь
Для гематологических исследований капиллярную кровь рекомендуют брать в следующих случаях: при ожогах, занимающих большую площадь поверхности тела пациента; мелких или труднодоступных венах у пациента; выраженном ожирении; установленной склонности к венозному тромбозу; у новорожденных; при необходимости ежедневного мониторинга за показателями крови, например, у онкологических больных на фоне химиотерапии.
Следует отметить, что при взятии капиллярной крови возможен ряд особенностей, которые бывает трудно стандартизировать: физиологические — холодные, цианотичные пальцы, методические — малый объем исследуемой крови и в связи с этим необходимость разведения образца для анализа на гематологическом анализаторе и др. Нарушения методики взятия крови приводят к значительным разбросан в получаемых результатах и, как следствие, к необходимости повторных исследований для уточнения результата.
Доставка, хранение и подготовка проб к исследованию
Для обеспечения качественного результата исследований необходимо четко кон-тролировать время и условия хранения проб до выполнения анализа. Оптимальное время исследования крови — в интервале от 1 до 4 ч после взятия. В промежутке от 5 до 30 мин происходят временная адаптация тромбоцитов к антикоагулянту и их агрегация, что может привести к ложному снижению их количества в пробе крови. Нежелательно исследовать кровь позднее 8 ч после взятия вследствие изменения некоторых характеристик клеток: снижается объем лейкоцитов, повышается объем эритроцитов, что в конечном итоге приводит к ошибочным результатам измерения и их неправильной интерпретации. Только концентрация гемоглобина и количество тромбоцитов стабильны в течение суток хранения крови.
Кровь нельзя замораживать. Капиллярную кровь с ЭДТА следует хранить при комнатной температуре и анализировать в течение 4 ч после взятия, более длительное хранение капиллярной крови не рекомендуют из-за малого ее объема. При необходимости проведения отсроченного анализа (транспортировка на дальние расстояния, технические неполадки прибора и т. д.) пробы венозной крови хранят в холодильнике при температуре 4-8 °С и исследуют в течение 24 ч. При этом следует учитывать, что происходит набухание клеток и изменение параметров, связанных с их объемом. У практически здоровых людей эти изменения не носят критического характера и не сказываются на количественных параметрах, но при наличии патологических клеток последние могут изменяться или даже разрушаться в течение нескольких часов с момента взятия крови.
Непосредственно перед исследованием кровь необходимо тщательно перемешать в течение нескольких минут для разведения антикоагулянта и равномерного распределения форменных элементов в плазме. Длительное постоянное перемешивание образцов до момента их исследований не рекомендуют из-за возможного травмирования и распада патологических клеток.
Исследование крови на приборе проводят при комнатной температуре. Кровь, хранившуюся в холодильнике, необходимо вначале согреть до комнатной температуры, так как при низкой температуре увеличивается вязкость и форменные элементы имеют тенденцию к склеиванию, что, в свою очередь, приводит к нарушению перемешивания и неполному лизису. Исследование холодной крови может быть причиной появления «флагов» из-за компрессии лейкоцитарной гистограммы.
Мазки крови рекомендуют делать не позднее 1-2 ч после взятия крови. При выполнении гематологических исследований на значительном удалении от места взятия крови неизбежно возникают проблемы, связанные с неблагоприятными условиями транспортировки. Воздействие механических факторов (тряски, вибрации, перемешивания и т. д.), температурного режима, вероятность пролива и загрязнения проб могут оказывать влияние на качество анализов. Для устранения этих причин при перевозках пробирок с кровью рекомендуют использовать герметично закрытые пластиковые пробирки и специальные транспортные изотермические контейнеры.
СИСТЕМА МЕНЕДЖМЕНТА КАЧЕСТВА
СТАНДАРТНАЯ ОПЕРАЦИОННАЯ ПРОЦЕДУРА
Общий анализ крови
1 Область применения
Настоящая стандартизованная операционная процедура (далее – СОП) определяет порядок выполнения общего анализа крови.
Настоящая СОП предназначена для врача клинической лабораторной диагностики, биолога и фельдшера-лаборанта.
2 Нормативные ссылки
2.1 ГОСТ Р 53079.4 – 2008. Технологии лабораторные клинические. Обеспечение качества лабораторных исследований. Часть 4. Правила ведения преаналитического этапа.
2.2 Руководство пользователя автоматического гематологического анализатора SysmexKX-21.
2.3 С. А. Луговская и др. «Гематологические анализаторы. Интерпретация общего анализа крови».
2.5 Инструкция по применению красителя азур-эозин по Романовскому
2.6 С. А. Луговская и соавт. «Лабораторная гематология»
2.7 Справочник заведующего КДЛ №1 январь 2009 г. М. М. Антипов «Скорость оседания эритроцитов. Современные методы определения и клиническая интерпретация».
2.8 Руководство для пользователей автоматического анализатора СОЭ SRS20/II
2.9 Руководство по эксплуатации модуля окрашивания мазковHematekSlideStainer.
3 Термины и определения
3.1. Клинический анализ крови (общий анализ крови) – анализ качественных и количественных свойств форменных элементов крови.
3.2. Лейкограмма — процентное соотношение различных видов лейкоцитов, определяемое при подсчёте их в окрашенном мазке крови под микроскопом.
4 Общие положения
Клинический анализ крови – один из важнейших диагностических методов, тонко отражающих реакцию кроветворных органов на воздействие различных физиологических и патологических факторов. Общеклиническое исследование крови имеет большое значение в постановке диагноза, а при заболеваниях системы кроветворения ему отводят ведущую роль.
5 Требования к обеспечению выполнения технологии
5.1 Лабораторное оборудование: автоматический гематологический анализатор SysmexKX-21, ротамикс RM1-L, микроскоп бинокулярный с иммерсией и встроенным осветителем LeicaDM1000, счетчик лейкоцитарной формулы крови СЛФ-ЭЦ-01-09, автоматический анализатор СОЭSRS 20/II, модуль окрашивания мазков HematekSlideStainer.
5.2 Реагенты, реактивы: Диюлент CELLPACK,WBC/RBC лизирующий раствор STROMATOLYSER-WH, детергент CELLCLEAN, набор реагентов для автоматической окраски препаратов крови и костного мозга (НПФ Арбис+)
5.3 Прочий расходуемый материал: масло иммерсионное, предметные стекла, шпатель для приготовления мазков крови Flexi-strip, вакуумная система для забора крови BDVacutainerK2E, вакуумная система для забора крови Vacuette 4NCESRsodiumcitrate, перчатки медицинские, дезинфицирующее средство «Мелисептол», спирт медицинский 70%, дозатор автоматическмй 20-200 мкл, наконечники для автоматического дозатора, штативы для предметных стекол, буферная смесь для гематологических исследований (производства НПФ «Абрис+»), штативы для предметных стекол, штативы пластиковые для пробирок, марля, вода дистиллированная, бумага фильтровальная, цилиндры мерные вместимостью 25-1000 мл, таймер.
6 Требования к технологии выполнения исследования (работ)
6.1 Взятие образца: для общего анализа крови используется венозная кровь. Забор крови производится с использованием вакуумной системы BDVacutainerK2E, для определения СОЭ используются система для забора кровиVacuette 4NCESRsodiumcitrate . Пробы крови доставляются в течении 1 часа в лабораторию при соблюдении температурного режима 2-8 о С . Технология взятия и требования к преаналитическому этапу согласно ГОСТ Р 53079.4 – 2008. Технологии лабораторные клинические. Обеспечение качества лабораторных исследований. Часть 4. Правила ведения преаналитического этапа.
6.2 Идентификация и приемлемость образца: при поступлении образца крови в лабораторию лаборант, принимающий материал, должен проверить правильность оформления направления на анализ, маркировку пробирки (наличие штрих-кода), оценить объем пробы, отсутствие видимых сгустков, дату и время забора крови, время доставки образца в лабораторию и соблюдение правил транспортировки, в случае необходимости отметить в бланке отсрочку анализа и использование охлаждения образца, зарегистрировать полученный материал. Перед проведением исследования образцы должны быть доведены до комнатной температуры.
6.3 Технология исследования.
Этапы клинического исследования крови:
- Выполнение исследования на гематологическом анализаторе (показатели: количество лейкоцитов (WBC), количество эритроцитов (RBC), концентрация гемоглобина (HGB), гематокрит (HCT), количество тромбоцитов (PLT), средний объем эритроцита (MCV), среднее содержание гемоглобина в эритроцитах (MCH), средняя концентрация гемоглобина в эритроците (MCHC), показатель гетерогенности эритроцитов по объему (RDW-CV, RDW-SD), взвешенное распределение тромбоцитов (PDW), средний объем тромбоцита (MPV), отношение (%) объема крупных тромбоцитов ко всему объему тромбоцитов (P-LCR)): образцы помещаются в ротамикс для перемешивания пробы в течении 3-5 минут. С помощью сканера с пробирки считывается штрих-код. Порядок проведения аналитической процедуры на гематологическом анализаторе см. «Руководство пользователя автоматического гематологического анализатора SysmexKX-21» п. 2.4.1.
- После аспирации образца анализатором на предметное стекло с помощью дозатора наносится 10 мкл крови и с помощью шпателя готовится мазок крови. Приготовление и покраска мазков см. Руководство по эксплуатации модуля окрашивания мазков HematekSlideStainer.
- Установка пробирок для определения СОЭ по методу Вестергрена в автоматический анализатор СОЭ SRS20/II.
- Подсчет лейкоцитарной формулы в мазке производится с помощью бинокулярного микроскопа Leica и счетчика лейкоцитарной формулы крови. Технологию подсчета см. С. А. Луговская и соавт. «Лабораторная гематология» «Морфологическое исследование мазков крови». Лейкоцитарная формула записывается в виде лейкограммы на бланк распечатки результатов анализа, выполненного на гематологическом анализаторе.
- Показатели исследования, выполненные на гематологическом анализаторе, переносятся в электронную форму бланка ответа автоматически. Лейкограмма с указанием особенностей морфологии эритроцитов и лейкоцитов и СОЭ вносятся вручную, проверяются врачом лабораторной диагностики, утверждаются и отправляются в регистратуру медицинского центра. Бланк распечатки результатов общего анализа крови с гематологического анализатора вклеивается в бумажный журнал регистрации исследований общего анализа крови.
7. Обеспечение качества выполнения исследования
7.1 Контроль качества оборудования и материалов
Контроль работы оборудования проводится согласно документированной процедуре «Управление оборудованием».
Наборы реагентов используются в пределах установленных сроков годности и хранятся при регламентированных в паспорте условиях.
7.2 Контроль качества исследования
Контроль качества работы гематологического анализатора см. «Руководство пользователя автоматического гематологического анализатора SysmexKX-21» п. 5, Х контроль.
7.3 Регистрация контрольных мероприятий
Результаты контроля качества выводятся на компьютер и хранятся в электронном виде.
Подготовка обследуемых
Взятие венозной крови производится натощак, в утренние часы. При взятии венозной крови необходимо учитывать ряд факторов которые могут повлиять на результат гематологических исследований: физическое перенапряжение (бег, быстрая ходьба, подъем по лестнице), эмоциональное возбуждение, прием пищи накануне исследования, купение, прием алкоголя и т.д. Для исключения этих факторов, следует соблюдать следующие условия подготовки пациентов:
• взятие венозной крови осуществляется после 15-минутного отдыха обследуемого;
• пациент во время взятия сидит, у тяжелых больных взятие крови может осуществляться лежа.
• курение, прием алкоголя и пищи непосредственно перед исследованием исключаются;
Основной способ взятия венозной крови для лабораторного исследования – пунктирование вены. Венозную кровь, как правило, забирают из локтевой вены. В случае необходимости ее можно получить из любой вены (запястья, тыла ладони, над большим пальцем и т.д.). У новорожденных и грудных детей кровь обычно берется из лобной, височной или яремной вены.
При взятии крови из вены необходимо избегать: мест шрамов, гематом; вен, используемых для переливания растворов; ножных вен (у больных диабетом, при нарушениях периферического кровотока, ангиопатиях).
Оборудование
Для венепункции можно использовать три варианта пункционных систем:
• одноразовые пластиковые системы (вакутейнеры), состоящие из контейнера с навинчивающейся на него одноразовой иглой и пробирки с плотно прилегающей пробкой и вакуумом внутри;
• одноразовые шприцы с подходящим диаметром иглы;
• иглы с внутренним диаметром 0,55-0,65 мм.
Условия транспортировки венозной крови
Правильно собранная венозная кровь должна быть своевременно доставлена в лабораторию. При комнатной температуре время доставки не должно превышать 60 мин после взятия крови. Если доставка крови в лабораторию осуществляется в течении дня, то она хранится при температуре +40С-+60С (в холодильнике) и далее в специальных транспортных контейнерах в ледяной бане доставляется в лабораторию.
Во время транспортировки пробирки и контейнеры с кровью должны быть соответствующим образом защищены от вредного воздействия окружающей среды и погодных условий. При транспортировке венозной крови должны строго соблюдаться правила техники безопасности, асептики и антисептики.
Пробирки должны быть промаркированы, упакованы и плотно закрыты. Упаковка должна быть удобной для транспортировки. Сроки хранения зависят от исследуемого показателя, температуры хранения и антикоагулянта, с помощью которого осуществляется взятие крови.
Методика получения сыворотки крови (без использования разделительных или вспомогательных средств для центрифугирования)
Оборудование
1. Центрифужные стеклянные пробирки общим объемом 10-12 мл.
2. Стеклянные палочки или Пастеровские пипетки с запаянными на конце капиллярами (для отделения сгустка).
3. Центрифуга лабораторная (до 3000 об/мин).
Венозная кровь, полученная без антикоагулянтов в центрифужную стеклянную пробирку, отстаивается в ней при комнатной температуре (15-200С) в течение 30 минут до полного образования сгустка. По окончании образования сгустка пробирки открывают и осторожно проводят тонкой стеклянной палочкой или запаянным капилляром Пастеровской пипетки по внутренним стенкам пробирки по окружности в верхнем слое крови для отделения столбика сгустка от стенок пробирки. Сыворотку сливают в другую центрифужную пробирку, придерживая сгусток стеклянной палочкой, и центрифугируют, либо центрифугируют в тех же, первичных, пробирках.
После ретракции сгустка пробы центрифугируют при относительной центробежной силе RCF от 1000 до 1200 xg (максимально до 1500 xg) в течение 10 минут.
В случае использования микропробирок и центрифуги для них центрифугирование проводят при 6000-15000 xg в течение 1,5 минут. После центрифугирования сыворотку сливают во вторичные (транспортные) пробирки. Сыворотка не должна быть гемолизированной.
Плазма получается из крови путем отделения клеток крови. Она представляет собой бесклеточную надосадочную жидкость, которая получается при центрифугировании крови, свертываемость которой ингибирована добавлением антикоагулянтов тотчас после взятия. В плазме содержатся факторы свертывания крови. В связи с тем, что плазма и сыворотка содержат около 93% воды, в отличие от цельной крови, которая содержит около 81% воды, концентрация компонентов в плазме на 12% выше, чем в цельной крови. Это может иметь принципиальное диагностическое значение при исследовании активности, например ЛДГ у которого наиболее высокая концентрация наблюдается в сыворотке крови, чем в плазме.
Широко применяются коммерческие системы для получения плазмы. Они представляют собой пробирки или устройства типа шприцев (“вакутейнер”) с вакуумом внутри, содержащие различные антикоагулянты и/или ингибиторы гликолиза. Как и в случае устройств для сыворотки, эти пробирки для плазмы имеют разные варианты, содержащие разделительные гели и гранулят из полистирола, ускоряющие получение плазмы, облегчающие транспортировку и хранение. В них уже имеются антикоагулянты и метки до которых следует набирать кровь.
Методика получения плазмы
Венозную кровь, полученную с антикоагулянтом немедленно после взятия перемешивают переворачиванием пробирок с кровью, закрытых крышками, не менее 5 раз. Перемешивание должно осуществляться без встряхивания и пенообразования. Время между началом наложения жгута и смешиванием крови с антикоагулянтом не должно превышать 2 минут.
После уравновешивания пробирок с кровью, их центрифугируют при RCF 1000-1200 xg, но не более 1500 xg, в течение 10-15 минут. Плазму немедленно сливают в транспортную центрифужную или химическую пробирку. Пробирку закрывают крышкой.
Условия транспортировки плазмы крови
Правильно полученная и собранная плазма крови должна быть своевременно доставлена в лабораторию. При комнатной температуре время доставки не должно превышать 24 часа. Если доставка плазмы в лабораторию осуществляется в течение дня, то она хранится при температуре +4. +80С (в холодильнике) и далее в специальных транспортных контейнерах в ледяной бане доставляется в лабораторию. Для более длительного хранения плазма может быть заморожена при температуре –200С.
Правила транспортировки плазмы такие же как и венозной крови.
Источник: serdce-help.ru
Для исследования системы гемостаза разработаны и полущили широкое распространение высокоточные приборы и надежные лабораторные методы, которые позволяют быстро и эффективно выявить нарушения, приводящие к кровоточивости или тромбозам, однако их воспроизводимость и точность значимо снижаются при несоблюдении правил и условий преаналитического этапа. Взятие образцов крови, транспортировку и их подготовку для исследования системы гемостаза следует рассматривать как важнейшие этапы полущения корректных результатов,
которым должно быть уделено немало внимания в любой лаборатории, выполняющей исследование системы гемостаза.
ПОДГОТОВКА ПАЦИЕНТА
Кровь для исследования гемостаза забирают утром натощак по прошествии не менее. 8 ч после последнего приема пищи. Важно, чтобы взятие венозной крови проводилось в спокойном состоянии, поэтому перед венепункцией пациенту рекомендуют посидеть в течение 20-30 мин. Для получения надежных результатов при исследовании тромбоцитарного гемостаза за день до сдачи анализа пациенту следует избегать стрессов, физических нагрузок, смены режима дня и изменений в питании, приема алкоголя. Особенно тщательно необходимо соблюдать эти условия при исследовании маркеров активации тромбоцитов (β-тромбоглобулина, тромбоцитарного фактора-4).
Врачу необходимо знать о лекарственных препаратах, которые назначены и вводятся пациент}, поскольку ряд медикаментов способны нарушить агрегацию тромбоцитов или вызвать изменение параметров коагуляции. В подобных ситуациях часто приходится учитывать лишь антикоагулянтный или антитромбоцита р- ный эффект применяемых лекарственных препаратов, поскольку выявить многие нарушения гемостаза на фоне применения антикоагулянтов или антиагрегантов невозможно.
У пациентов в реанимационном отделении нельзя брать кровь из подключичного катетера, поскольку это наиболее частая причина попадания гепарина в образец крови. У пациентов в отделении гемодиализа нельзя осуществлять забор крови из артериовенозной фистулы. Однако при некоторых критических состояниях взятие крови в пробирку или вакутейнер из кубитальной вены бывает невозможно из-за снижения давления. В подобных ситуациях кровь для исследования допустимо взять из подключичного катетера, но при этом следует учитывать, что перечень выполняемых методик будет существенно ограничен вследствие возможного наличия гепарина в образце.
АНТИКОАГУЛЯНТЫ
Цитрат натрия
Цитрат натрия связывает ионы кальция и останавливает реакции свертывания. В качестве антикоагулянта для определения большинства показателей коагуляционного и тромбоцитарного звеньев системы гемостаза следует использовать 0,105-0,109 M раствор лимоннокислого натрия, который готовят растворением 3.1-3,2 г Na3C6H507х2H2O в 100 мл воды. Этот раствор следует хранить при температуре от +2 до +8 0C не более 48 ч. При несоблюдении температурного режима в таком растворе развивается микрофлора, вследствие чего концентрация цитрата натрия уменьшается и появляются посторонние примеси, обладающие потенциальной способностью стимулировать тромбоциты и активировать коагуляционные реакции. При наличии рекомендации фирм-производителей реагентов допустимо применение 0,129 M (3,8%) цитрата натрия, однако следует учитывать, что разные концентрации стабилизатора по-разному влияют на ряд показателей коагуляции, в том числе и на МНО. Такое влияние особенно заметно при сравнении реагентов разных производителей.
Этилендиаминтетраацетат
ЭДТА также связывает кальций, останавливая свертывание. Соли этилендиа- минтетраацетата используют для стабилизации образцов, предназначенных для определения клеточного состава периферической крови на гематологических анализаторах. K2-, K3— и Na2-соли ЭДТА в концентрации 1,2-2,0 мг/мл применяют также при дальнейшем исследовании методами ИФА и ПЦР. Недопустимо использование ЭДТА для исследования коагуляции и функциональной способности тромбоцитов.
Гепарин
Гепарин активирует плазменный антитромбин, который необратимо связывает ферментные факторы свертывания. Этот антикоагулянт традиционно применяют в ИФА; как правило, для стабилизации крови необходимо от 12 до 30 ЕД/мл натриевой, калиевой или литиевой соли нефракционированного гепарина. При получении плазмы для исследования ее коагуляционных свойств и функциональной способности тромбоцитов этот антикоагулянт применять нельзя.
ПРОБИРКИ
При взятии и подготовке образцов крови для исследования гемостаза следует применять меры для предупреждения активации тромбоцитов и коагуляционных реакций. Для образцов крови нельзя использовать обычные стеклянные пробирки. поскольку стекло активирует коагуляцию и сорбирует коагуляционные факторы. В течение многих лет для предупреждения этих эффектов использовали силиконирование пробирок, однако появились сведения о недостаточной способности некоторых силиконов предупреждать активацию тромбоцитов. Кроме того, эта процедура трудно стандартизируется и занимает дополнительное время. Как альтернативу силиконированию следует использовать пластиковые пробирки, однако различные сорта пластика также разнятся по способности активировать коагуляционные реакции.
Хорошие результаты дает использование вакуумных систем для взятия крови, содержащих забуференный 3,2% раствор цитрата натрия (буферизация чаще достигается добавкой лимонной кислоты). Цветовая кодировка по ISO/DIS 6710 для вакуумных систем, содержащих цитрат натрия, предусматривает светло- голубой или зеленый цвет колпачков; для пробирок с ЭДТА — лиловый или красный; для пробирок с гепарином — зеленый или оранжевый. Существуют данные о хороших результатах использования специальных CTAD-систем (со стабилизатором, включающим цитрат натрия, трифосаденин, теофиллин и дипиридамол) для определения β-тромбоглобулина, тромбоцитарного фактора-4, PAI-1, контроля гепаринотерапии по АЧТВ или анти-Ха, определения МНО. Однако этот стабилизатор непригоден для исследования функциональной способности тромбоцитов.
ОПТИМАЛЬНОЕ СООТНОШЕНИЕ ЦИТРАТ/КРОВЬ
Поскольку большинство факторов свертывающей системы содержится в плазме, но не в эритроцитах, необходимое количество антикоагулянта зависит от показателя гематокрита у пациента. Для стабилизации образцов крови при значении гематокрита в нормальном диапазоне (от 35 до 50%) принято смешивать один объем 3,2% раствора цитрата натрия с девятью объемами крови. При отклонениях гематокрита от указанных величин следует изменить это соотношение в соответствии с формулой Ingram:
X = V × (100 — НСТ) / (595 — НСТ),
где X — добавляемый объем 3,2% цитрата, мл; V — конечный объем пробирки для крови, мл; HCT — показатель гематокрита у пациента, %.
ТЕХНИКА ВЕНЕПУНКЦИИ
ИГЛА И ПРОБИРКА
Для получения образцов венозной крови необходимо привлекать наиболее опытных и квалифицированных процедурных медсестер, способных в течение нескольких секунд пунктировать вену с наименьшими травматичностью и болезненностью для пациента. Медсестре необходимо внимательно ознакомиться с направлением на исследование, выбрать пробирки, определить корректную последовательность их наполнения, промаркировать их и указать время взятия крови. В некоторых специализированных лабораториях на время взятия крови в помощь процедурной медсестре направляют лабораторного техника, что позволяет значительно увеличить пропускную способность процедурного кабинета, снизить вероятность ошибок дозирования цитрата при сдвигах гематокрита и неточностей маркировки проб.
Образец крови предпочтительнее брать из кубитальной вены; место прокола обрабатывают 70% спиртом и дают высохнуть. Допустимо лишь кратковременное (не более 60 с) наложение жгута на плечо, поскольку при венозном стазе происходит активация фибринолиза; после введения иглы в вену жгут тотчас же расслабляют или удаляют. Наилучшие результаты (с учетом травматичности, болезненности, универсальности, скорости наполнения пробирок) дает использование иглы с калибром 21G. Желательно не брать для исследования гемостаза первые 2-3 мл крови, поэтому их набирают в пробирку без антикоагулянта и используют, например, для получения сыворотки (биохимические, иммунологические тесты и др.). Далее пластиковые или силиконированные пробирки с предварительно добавленным цитратом наполняют кровью из иглы самотеком, сразу же закрывают и перемешивают путем 4-6-кратного переворачивания или вращения (без встряхивания). В связи с использованием игл увеличенного диаметра после венепункции в большинстве ситуаций руку пациента необходимо перебинтовать 2- 4 оборотами бинта, приложив к месту прокола марлевый тампон с 70% спиртом.
Наполнять пробирки с цитратом с помощью шприцев для инъекций нельзя, поскольку при насасывании крови и ее последующем переносе в пробирку происходит активация тромбоцитов и коагуляционных факторов вследствие контакта крови с пластиком шприца и дополнительного вспенивания, обусловленного турбулентным движением крови в шприце.
СПЕЦИАЛИЗИРОВАННЫЕ ВАКУУМНЫЕ СИСТЕМЫ
Стандартом для клинических лабораторий, в которых исследуют показатели гемостаза, считается использование одноразовых вакуумных систем (вакутейнеров и др.), содержащих 3,2% раствор цитрата натрия. Их использование в значительной степени ускоряет, стандартизирует процедуру взятия крови и позволяет существенно снизить разброс результатов. Если кровь для исследования показателей гемостаза берут через катетеры или системы с иглой-бабочкой, необходимо обеспечить полную герметичность системы и предварительное заполнение кровью всех «мертвых» объемов — просвета самого катетера, иглы и переходника, иначе возможны частичная потеря вакуума и неполное заполнение пробирки. Для предотвращения этого, а также попадания кусочков поврежденных тканей кровь для анализа показателей гемостаза не рекомендуют брать в первую вакуумную пробирку.
В условиях выраженного сгущения крови (полицитемии, дегидратации и др.) стандартное количество цитрата в вакуумных системах оказывается избыточным для уменьшенного объема плазмы. При использовании вакуумных пробирок и уровне гематокрита у пациента выше 50% часть раствора цитрата из пробирки следует предварительно отсосать (например, с помощью инсулинового шприца). Подлежащий удалению из стандартной вакуумной пробирки объем цитрата можно определить по формуле:
Y = (V / 10) × (9 × HCT — 405) / (595 — НСТ),
где Y — подлежащий удалению объем цитрата, мл; V — конечный объем пробирки для крови, мл; HCT — показатель гематокрита у пациента, %.
При низком (<35%) значении гематокрита, напротив, следует предварительно добавить дополнительное количество цитрата в пробирку, подсчитав его по той же формуле (отбросив знак «минус»).
Однако скорригировать объем цитрата в вакуумных пробирках без нарушения вакуума весьма сложно, и стандартные инструкции производителей вакуумных систем подобной возможности не предусматривают. В связи с этим, поскольку грубые сдвиги гематокрита в диагностической практике встречаются нечасто, при их наличии бывает проще взять кровь с помощью иглы не в вакуумную, а в обычную пластиковую пробирку, предварительно добавив в нее цитрат в соответствии с приведенной выше формулой.
Транспортировка и промежуточный контроль образцов
Следует сократить до минимального интервал времени между взятием образца крови из вены и центрифугированием. До центрифугирования кровь следует хранить при комнатной температуре (от +18 до +24 °С). Недопустимо хранить образцы крови в холодильнике и тем более их замораживать. При охлаждении образцов до 12 °C и ниже начинается холодовая агрегация тромбоцитов. Маркированные образцы транспортируют в лабораторию в специальном контейнере. В том случае, если образцы крови необходимо отправить в другое лечебное учреждение, их нужно транспортировать в термоконтейнере, но без хладагентов. В зимнее время термоконтейнер не позволит образцам охладиться до 12 °C, а в летнее время — перегреться. Направление на исследование или иную медицинскую документацию не следует помещать в контейнер с образцами.
Перед центрифугированием необходимо визуально проверить полученные для исследования пробы крови (маркировку, наличие гемолиза, липемии и сгустков). Образцы, содержащие сгустки, бракуются. Для визуального выявления «подсвертывания» необходимо медленно наклонить пробирку с образцом; при правильных взятии и обработке крови происходит равномерное ее перетекание, соответствующее углу наклона пробирки, и на стенках не остается багровых образований овальной или иной формы.
ПОЛУЧЕНИЕ ПЛАЗМЫ
Богатая тромбоцитами плазма
Цитратная плазма, богатая тромбоцитами, получается при центрифугировании стабилизированной цитратом крови при 150 g в течение 5 мин. Торможение центрифуги должно быть плавным. Сразу же после центрифугирования богатую тромбоцитами плазму переносят в пластиковые пробирки пипетками со сменными наконечниками и используют для исследования агрегационной функции тромбоцитов, которое следует выполнить в течение 2 ч после взятия крови. Замораживание образцов богатой тромбоцитами плазмы недопустимо.
Бедная тромбоцитами плазма
Цитратная плазма, бедная тромбоцитами, обычно еще содержит тромбоциты, но в малых количествах. Для ее получения стабилизированную кровь или плазму, богатую тромбоцитами, центрифугируют при 1700-1900 g в течение 15 мин без охлаждения, а затем надосадочную жидкость переносят в пластиковые пробирки.
Бестромбоцитная плазма
Подобный режим центрифугирования считается достаточным для большинства коагуляционных тестов. Однако в ряде ситуаций, например при определении волчаночного антикоагулянта, проведении dRVV-теста или при необходимости замораживания и хранения материала, требуется бестромбоцитная плазма. Ее получают путем повторного центрифугирования плазмы, бедной тромбоцитами, при 1700-1900 g в течение 15 мин. Следует осторожно относиться к рекомендациям центрифугировать образцы крови с ускорением более 2500 g и охлаждением, поскольку при увеличении центробежной силы и снижении температуры возможно разрушение клеток крови.
Хранение образцов плазмы
Желательно, чтобы функция как тромбоцитарного, так и коагуляционного звена гемостаза была исследована в течение 2 ч после взятия крови у пациента. В большинстве ситуаций обеспечить это довольно сложно, поэтому при условии быстрого отделения плазмы от клеточных элементов допускается исследование коагуляционных показателей в течение 4 ч. Редко выполняемые тесты коагуляционного гемостаза допустимо проводить после накопления замороженных образцов. Хранение плазмы при -20 °С возможно до 4 нед; лучшие результаты получаются при хранении при температуре от -40 до -70 °С. Большинство бытовых холодильников неспособны удерживать температуру -20 ºC, поэтому хранить образцы плазмы в них не рекомендуют. Перед исследованием плазму необходимо быстро разморозить на водяной бане при 37 °С и хорошо перемешать.
Источник: www.clinlabs.com
