Мегалобластные анемии (МА) – группа анемий, основной причиной которых является дефицит фолиевой кислоты и витамина В12 и связанное с этим нарушение синтеза ДНК (при этом страдают прежде всего быстро обновляющиеся ткани – кроветворная и эпителий ЖКТ).
Морфологически при МА деление клеток замедляется, цитоплазма созревает нормально, в результате клетки становятся крупными, содержание РНК превышает ДНК; эритропоэз неэффективный, т.к. на уровне костного мозга образуются мегалобласты – предшественники эритроцитов, разрушающиеся в самом костном мозге.
Классификация мегалобластных анемий:
а) В12-дефицитная анемия
б) Фолиеводефитиная анемия
в) МА, обусловленная наследственным дефицитом ферментов, участвующих в синтезе пуриновых и пиримидиновых оснований (дигидрофолиевой редуктазы, формиминотрансферазы и др.)
г) МА, поддающаяся лечению витамином В1 (врожденное аутосомно-рециссивное заболевание)
д) МА, обусловленная дефицитов витамина С (он участвует в метаболизме фолиевой кислоты)
е) острая мегалобластная болезнь (быстрое развитие МА вследствие действия различных причин – закиси азота, гемодиализа, длительного парентерального питания и др.)
Этиология мегалобластных анемий:
1. Причины дефицита витамина В12:
а) недостаточное поступление его с пищей
б) нарушение его всасывания при недостатке внутреннего фактора Касла (на уровне желудка), поражении дистальных отделов ileum, конкурентном поглощении витамина В12 при дифиллоботриозе, применении некоторых лекарственных средств (аминосалициловая кислота, неомицин)
2. Причины дефицита фолиевой кислоты:
а) недостаточное поступление с пищей (особенно у алкоголиков, подростков, грудных детей)
б) период повышенной потребности в фолиевой кислоте (беременность, грудной возраст, злокачественные опухоли, гемолитическая анемия, гемодиализ)
в) нарушение всасывания (болезни тонкого кишечника: целиакия, спру; применение некоторых ЛС: барбитураты, фенитоин)
г) нарушения метаболизма фолиевой кислоты (применение ингибиторов дигидрофолатредуктазы — метотрексата, триметоприма; алкоголь; недостаточность дигидрофолатредуктазы) и др.
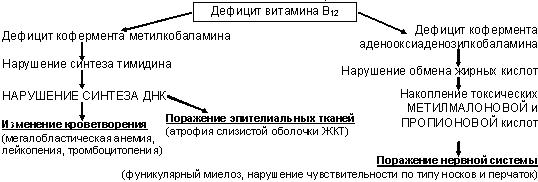
Патогенез мегалобластных анемий:
Фолиевая (птероилглутаминовая) кислота – источник для человека – зеленые овощи и фрукты, минимальная потребность – 50 мкг/сут (при беременности увеличивается в несколько раз), резерв в организме 5-20 мг (половина резерва содержится в печени); в пище находится в конъюгированной форме в виде полиглютамата; основная функция — перенос метильной или формильной группы от одного вещества к другому.
Метаболизм фолиевой кислоты: полиглютамат + γ-глютамилгидролаза в просвете кишечника ® моноглютамат ® всасывание в проксимальном отделе тонкой кишки ® попадание с помощью переносчика в клетку ® потеря метильной группы (при участии витамина В12) ® повторное образование полиглютамата ® использование на нужды клетки.
При дефиците фолиевой кислоты нарушается синтез ДНК в кроветворных клетках из-за нарушения синтеза пуриновых и пиримидиновых оснований.
Витамин В12 (кобаламин) – источник для человека – продукты животного происхождения (мясо, молоко, яичные желтки); минимальная потребность – 2,5 мкг/сут, резерв в организме: 2 мг в печени + 2 мг в других тканях (поэтому дефицит развивается лишь через 3-6 лет после прекращения поступления в организм);
Метаболизм кобаламина: высвобождение кобаламина из пищи в желудке + желудочный R-белок ® комплекс В12+R-белок поступает в ДПК ® соединение с внутренним фактором Касла (вырабатывается париетальными клетками желудка) ® расщепление образовавшегося комплекса в энтероцитах концевого отдела подвздошной кишки ® связь кобаламина с транскобаламином II (переносчиком) ® перенос кровью к костному мозгу и печени.
Атрофия желудка с нарушением образования внутреннего фактора Касла и развитием МА –
болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла)
Клиническая картина В12-дефицитной анемии:
а) поражение пищеварительной системы – чаще всего самые ранние признаки заболевания:
— снижение или отсутствие аппетита, ощущение тяжести и полноты в подложечной области после еды, отрыжка съеденной пищей и воздухом, боль и жжение в языке, в области десен, губ, иногда в области прямой кишки (из-за глоссита, атрофического гастрита и атрофии слизистой кишечника)
— воспалительно-атрофические изменения слизистой полости рта и языка (слизистая рта бледная, с признаками афтозного стоматита; гладкий «лакированный» язык с атрофированными сосочками, потрескавшийся, с участками воспаления ярко-красного цвета, иногда с изъязвлениями — глоссит Hunter)
— пальпаторно — неинтенсивная боль в эпигастральной области, иногда – гепатоспленомегалия
б) поражение кроветворной системы – чаще всего ведущие признаки заболевания:
— общеанемический синдром (как при ЖДА)
— кожа бледная, часто с лимонно-желтым оттенком (в связи с гипербилирубинемией из-за гемолиза), легкая иктеричность склер
— несколько одутловатое лицо, часто – пастозность в области голеней и стоп
— синдром миокардиодистрофии (тахикардия, экстрасистолия, небольшое расширение границ сердца влево, приглушенность тонов сердца, негромкий систолический шум в области верхушки)
в) поражение нервной системы – фуникулярный миелоз – возникает при тяжелом и длительном течении болезни, характеризуется поражением задних и боковых столбов спинного мозга с демиелинизацией и дегенерацией нервных волокон в спинном мозге и спинномозговых нервах:
1) при преимущественном поражении задних столбов:
— жалобы на слабость в ногах, особенно при подъеме по лестнице, при быстрой ходьбе, ощущение ползания мурашек по ногам, онемение ног; больным кажется, что они не чувствуют при ходьбе опоры под ногами, что нога наступает не на твердую землю, а на что-то рыхлое, мягкое, как вата (больные неоднократно как бы «пробуют землю ногой»)
— снижение сухожильных рефлексов, атрофия мышц нижних конечностей
— нарушение функции тазовых органов (недержание мочи, недержание кала)
2) при преимущественном поражении боковых столбов:
— нижний спастический парапарез с резким повышением сухожильных рефлексов и тонуса мышц нижних конечностей
— нарушение функции тазовых органов (задержка мочеиспускания и дефекации)
Клиническая картина фолиеводефицитной анемии отличается от В12-дефицитной анемии отсутствием поражения пищеварительной и нервной системы.
Диагностика В12-дефицитной анемии:
1. Лабораторные исследования:
а) ОАК: гиперхромная (ЦП > 1,1) макроцитарная анемия, анизоцитоз (разная величина эритроцитов, наряду с макроцитами имеются эритроциты нормальных размеров), пойкилоцитоз (изменение формы эритроцитов);
тельца Жолли, кольца Кебота, базофильная пунктация (остатки ядра в мегалоцитах); лейкопения, нейтропения, эозинопения, относительный лимфоцитоз, гиперсегментированные нейтрофилы (большие сегментоядерные нейтрофилы с полисегментированным ядром); умеренная тромбоцитопения
б) миелограмма (пункцию необходимо делать до начала лечения!): раздражение красного кроветворного ростка, его гиперплазия; клетки красного ряда преобладают над клетками белого ряда, отношение лейкоциты/эритроциты 1:2 — 1:3 (при норме 3:1-4:1); мегалобластный тип кроветворения (гиганская клетка с эксцентрично расположенным ядром без ядрышек, нежной хроматиновой сетью) с преобладанием в разгар болезни базофильных мегалобластов («синий костный мозг»); изменение клеток миелоидного ряда; нарушение созревания мегакариоцитов
в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) тест Шеллинга — позволяет оценить всасывание витамина В12 в кишечнике в присутствии гастромукопротеина или без него и сделать заключение о патогенетическом варианте В12-дефицитной анемии:
1) Шеллинг – I: больному дают принять внутрь витамин В12, меченный 60Со и через 1-6 часов в/м вводят «ударную дозу» немеченого витамина В12 для насыщения печеночного депо, затем измеряют содержание радиоактивного витамина В12 в суточной моче; снижение его экскреции указывает на нарушение всасывания витамина В12 в кишечнике
2) Шеллинг – II: повторяется тест Шеллинг-I с использованием гастромукопротеина, меченого радиоактивным кобальтом; повышение экскреции радиоактивного витамина В12 указывает на дефицит гастромукопротеина в качестве основного механизма развития В12-дефицитной анемии; если экскреция радиоактивного витамина В12 не увеличилась, причина развития МА — нарушение всасывания витамина
В12 в кишечнике.
2. Инструментальные исследования: ФГДС с биопсией (атрофические изменения слизистой ЖКТ); исследование желудочной секреции (резкое уменьшение количества желудочного сока, ахилия) и др.
Диагностика фолиеводефицитной МА:
а) ОАК – те же признаки, что и при В12-дефицитной анемии
б) миелограмма – те же признаки, что и при В12-дефицитной анемии; при окраске пунктата по Кассу (ализариновым красным) мегалобласты окрашиваются только при В12-дефицитной анемии и не окрашиваются при фолиеводефитиной анемии
в) БАК: признаки гемолиза (неконьюгированная гипербилирубинемия, умеренное повышение СЖ)
г) проба с гистидином — больной принимает 15 г гистидина, после чего определяется экскреция с мочой формиминглутаминовой кислоты за 8 ч после приема гистидина; в норме основная часть гистидина превращается при участии фолиевой кислоты в глутаминовую кислоту, с мочой выводится от 1 до 18 мг формиминглутаминовой кислоты; при фолиеводефицитной анемии выделение формиминглутаминовой кислоты значительно увеличивается ( до 1500 мг)
Лечение МА:
При В12-дефицитной анемии — препараты витамина В12 (цианокобаламин, оксикобаламин) 400-500 мкг/сут в/м (30-40 инъекций), затем – поддерживающая доза 500 мкг 1 раз в неделю 3 месяца, затем 500 мкг 1 раз в 2 недели еще 3 мес.
При фуникулярной миелозе 1000 мкг/сут + кобамид (кофермент витамина) 500 мкг/сут в/м до исчезновения признаков поражения спинного мозга.
При фолиеводефицитной анемии: фолиевая кислота внутрь по 10-15 мг/сут до 6 недель.
Источник: studopedia.ru
Гемолитическая анемия
Это группа врожденных или приобретенных острых и хронических заболеваний крови, сопровождающихся повышенным распадом эритроцитов и укорочением продолжительности их жизни [8].
Гемолитические анемии делятся на врожденные и приобретенные. Причинами гемолиза могут быть нестабильность мембраны эритроцитов или воздействие на них повреждающих факторов – сывороточных антител, инфекционных агентов (например при малярии), а также травмирование эритроцитов при циркуляци крови (при протезированных клапанах сердца).
В большинстве случаев гемолиз происходит вне сосудов в клетках селезенки, печени, костного мозга; внутрисосудистый гемолиз наблюдается редко (при аутоиммунной гемолитической анемии, пароксизмальной гемоглобинурии).
Наследственные гемолитические анемии в основном встречаются в практике врачей-педиатров, тогда как приобретенные гемолитические анемии чаще наблюдаются у пациентов в пожилом возрасте.
По данным Л. И. Дворецкого, основными причинами гемолиза у пациентов старших возрастных групп являются: лимфопролиферативные заболевания (миеломная болезнь, хронический лимфолейкоз и т. д.); злокачественные опухоли различных локализаций; системные заболевания соединительной ткани, лекарственные воздействия при приеме таких препаратов, как антиаритмики (прокаинамид, хинидин), антипаркинсонические средства, антибиотики (пенициллины, цефалоспорины и т. д.), нестероидные противовоспалительные средства.
Специфическими признаками гемолитической анемии могут быть желтуха, лихорадка, озноб, боль в спине, увеличение селезенки.
Лабораторными признаками гемолиза являются: наличие в крови ядросодержащих эритроидных клеток (эритрокариоцитов); повышение содержания непрямого билирубина, железа в сыворотке крови; наличие в крови гемосидерина; повышение содержания свободного гемоглобина в плазме, положительная проба Кумбса.
Лечение гемолитических анемий должно производиться в специализированных стационарах.
Макроцитарная анемия
Макроцитарная анемия встречается значительно реже микроцитарной, но всегда заслуживает внимания со стороны врача. Обнаружение в анализе периферической крови картины макроцитарной анемии требует выполнения стернальной пункции и определенного алгоритма (рис. 28).
Рисунок 28. Алгоритм при макроцитарной анемии
При наличии в миелограмме морфологических признаков мегалобластного кроветворения предполагается В12-дефицитная, фолиеводефицитная или лекарственная токсическая анемия. Мегалобластное кроветворение развивается в связи с нарушением синтеза ДНК и РНК ядер и характеризуется задержкой созревания ядер гемопоэтических клеток при нормальном развитии и гемоглобинизации цитоплазмы. Результатом такой ядерно-цитоплазматической диссоциации является продукция клеток больших размеров – макроциты [7].
В12-дефицитная анемия
Из макроцитарных анемий наиболее часто встречается В12-дефицитная анемия. Распространенность этой анемии по различным данным составляет от 0,1 до 1 % среди всего населения. По данным ВОЗ 2001 г., среди пожилых пациентов в США распространенность В12-дефицитной анемии составляет до 20 %.
Среди причин В12-дефицитной анемии выделяют внешние (нехватка витамина В12) – очень редко, при строжайшем вегетарианстве, и внутренние (патология ЖКТ – перенесенная гастрэктомия, резекция тонкого кишечника, рак желудка, синдром мальабсорбции, глистная инвазия; рис. 29).
Рисунок 29. Причины В12-дефицитной анемии
При попадании витамина В12 с пищей (внешний фактор) кобаламин должен соединиться с внутренним фактором Касла – белок, вырабатываемый париетальными клетками желудка. Этот комплекс всасывается в дистальном отделе подвздошной кишки и переносится с помощью транспортного белка транскобаламина в органы и ткани (П. А. Воробьев, 2001).
Одной из тяжелых форм В12-дефицитной анемии является злокачественная пернициозная анемия Аддисона-Бирмера, обусловленная аутоиммунным поражением и атрофией слизистой желудка, в результате чего прекращает вырабатываться внутренний фактор Касла и витамин В12 не всасывается.
Для клинической картины В12-дефицитной анемии характерны анемический синдром, поражение ЖКТ (глоссит – «лакированный малиновый язык», извращение вкуса, диспепсия) и фуникулярный миелоз – неврологические нарушения в виде «ватных» ног, онемения дистальных отделов конечностей, парестезии, атактическая походка.
При В12-дефицитной анемии обязательно морфологическое исследование костного мозга. В миелограмме имеет место эритроцитарная гиперплазия и мегалобластическая реакция. В старых классификациях ошибочно выделялись два вида анемий в один – витамин В12 (фолиево) – дефицитную, основываясь на их морфологическом сходстве– появлении мегалобластов.
Из-за этого, согласно Воробьеву А. И., врачи выявляют мегалобластную анемию и назначают одновременно как витамин В12, так и фолиевую кислоту, что является грубым дефектом работы и при определенных условиях создает опасность для жизни больного.
В периферической крови при В12-дефицитной анемии мы видим макроцитоз, гиперхромию, анизоцитоз и пойкилоцитоз, базофильную зернистость эритроцитов. Обнаруживаются также тельца Жолли и кольца Кебота – эритроциты с остатками ядер. Кроме снижения количества эритроцитов для В12-дефицитной анемии характерна умеренная тромбоцитопения и лейкопения, что подтверждает нарушение синтеза нуклеиновых кислот во всех ростках кроветворения.
Для подтверждения дефицита витамина В12 сегодня существует хемилюминесцентный анализ. Референтные значения витамина В12 колеблются в пределах 200–835 пг/мл.
Кроме того, при В12-дефицитной анемии повышается уровень непрямого билирубина и ЛДГ как результат интрамедуллярного гемолиза эритроцитов. Лечение В12-дефицитной анемии проводится витамином В12 в дозе 500—1000 грамм с контролем эффективности лечения (ретикулоцитарный криз на 3—5-е сутки), а также лечение основной патологии, ставшей причиной развития В12-дефицитной анемии.
Фолиеводефицитная анемия
Распространенность фолиеводефицитной анемии гораздо ниже, чем В12-дефицитной анемии. Недостаток фолиевой кислоты встречается чаще у молодых, тогда как В12-дефицитная анемия – заболевание пожилых.
К дефициту фолиевой кислоты приводит недостаточное употребеление в пищу продуктов растительного происхождения (основного источника фолатов), нарушение всасывания при энтеритах различной этиологии, а также резекции тонкой кишки. Прием противосудорожных препаратов, злоупотребление алкоголем обусловливают развитие фолиеводефицитной анемии. Повышенная потребность в фолатах наблюдается при беременности.
Клиническая картина фолиеводефицитной анемии схожа с таковой при В12-дефиците. Однако при фолиеводефицитной анемии поражение нервной системы не встречается, что служит важным дифференциально-диагностическим признаком.
Лабораторные характеристики фолиеводефицитной анемии таковы: макроцитоз эритроцитов, повышение среднего содержания гемоглобина в эритроците (MCH), тельца Жолли, кольца Кебота, снижено количество лейкоцитов, тромбоцитов, повышено содержание билирубина за счет его непрямой фракции, повышена активность ЛДГ. В картине костного мозга – мегалобластический тип кроветворения. Для диагностики фолиеводефицитной анемии важное значение имеет определение фолиевой кислоты в сыворотке крови (в норме 3—17 нг/мл).
Лечение осуществляется препаратом фолиевой кислоты в дозе 5—15 мг в сутки.
Лекарственная анемия
Прием некоторых цитостатических препаратов (6-меркаптопурин, тиогуанин, азатиоприн и пр.) вызывает развитие макроцитарной мегалобластной анемии. Данный вид анемии следует заподозрить при нормальных показателях фолиевой кислоты и витамина В12 в сыворотке крови.
Макроцитарная анемия без признаков мегалобластного кроветворения
Помимо мегалобластных, существуют макроцитарные анемии, сопровождающиеся нормобластическим кроветворением. По мнению Стуклова Н. И., немегалобластический макроцитоз при алкоголизме обычно связан с патологией липидов, увеличивающих размер эритроцитарной мембраны. Такой же механизм возможен при заболеваниях печени и тиреотоксикозе. Увеличение объема эритроцитов у пациентов, злоупотребляющих алкоголем, сохраняется в течение длительного времени после прекращения приема алкоголя.
При мегалобластическом типе кроветворения содержание ретикулоцитов всегда снижено.
При макроцитарной анемии с повышенным содержанием ретикулоцитов можно думать либо об острой кровопотере, либо о гемолизе.
Анемия при различных заболеваниях
Анемия у «сосудистых» больных
Снижение гемоглобина при сердечно-сосудистых заболеваниях, как правило, проявляется двумя типами анемий: микроцитарной и нормоцитарной (рис. 30).
Рисунок 30. Анемия у «сосудистых» больных
Микроцитарная анемия предполагает железодефицит, связанный с явной или скрытой кровопотерей. Причинами кровотечений могут быть острые эрозии и язвы верхних отделов ЖКТ при системном атеросклерозе, а также ульцерогенный эффект и нарушения гемостаза при приеме антитромботических препаратов.
Нормоцитарная анемия, как правило, служит проявлением анемии хронических заболеваний.
Снижение гемоглобина является частым спутником хронической сердечной недостаточности и инфекционного эндокардита. При инфекционном эндокардите патогенез развития анемии связан с провоспалительными эффектами цитокинов, описанными подробно в гл. «Анемия хронических заболеваний».
Причинами развития анемии при ХСН могут быть нарушения эритропоэза и гемодилюция. Основную роль в патогенезе анемии при ХСН играет нарушение почечной перфузии и снижение выработки эритропоэтина. Дополнительными факторами служат негативные эффекты, связанные с повышенным синтезом медиаторов воспаления и гепсидина. Кроме того, нарушения гемодинамики при ХСН способствуют снижению всасывания железа в кишечнике.
Что же касается «ложной» анемии, то при ХСН происходит активация ренин-ангиотензин-альдостероновой системы; это приводит к увеличению реабсорбции натрия и воды в дистальных канальцах почек, и, как следствие, повышению объема циркулирующей плазмы.
Лечение анемии при ХСН имеет принципиальное значение, так как известно, что анемия ухудшает прогноз и увеличивает летальность при ССЗ.
По данным некоторых авторов, в лечении анемии у больных ХСН с успехом использовали эритропоэтины. Применение эритропоэтина приводит не только к устранению анемии, но и к достоверному уменьшению темпов развития гипертрофии левого желудочка и снижению сердечно-сосудистой летальности. В настоящее время получены данные, что эритропоэтин также обладает и прямым кардиопротекторным эффектом [9].
Однако в апреле 2013 г. американским обществом врачей предложены рекомендации, основанные на обзоре публикаций на английском языке по лечению анемии при сердечно-сосудистых заболеваниях за период с 1947 г. по 2012 г., согласно которым предложено отказаться от использования эритропоэтинов у пациентов с легкой и умеренной анемией и застойной сердечной недостаточностью или ишемической болезнью сердца.
Объединенные данные одиннадцати исследований показали, что использование эритропоэтинов у пациентов с ИБС и ХСН не снижают смертность. Доказано, что использование эритропоэтинов приводит к улучшению функционального класса по NYHA. Однако анализ результатов четырех крупных исследований показал, что использование эритропоэтинов у пациентов с ХСН и легкой анемией увеличивает риск тромбозов.
Использование препаратов железа у пациентов с ХСН, в частности железа III карбоксиполимальтозата, на 22,4 % снижает возникновение повторных сосудистых катастроф в сравнении с плацебо. Кроме того, применение препаратов железа увеличивает толерантность к нагрузке, улучшает функциональный класс ХСН по NYHA.
Анемия при злокачественных новообразованиях
Анемия при злокачественных новообразованиях имеет многофакторный характер. В ее патогенезе играют роль хроническая кровопотеря, дефицит витамина В12, гемолиз, воздействие провоспалительных цитокинов, химио– и лучевая терапия, вытеснение нормальных ростков костномозгового кроветворения опухолевыми клетками. Частота встречаемости АХЗ колеблется от 30 % до 60 % в зависимости от типа опухоли и характера лечения [9].
Основными патогенетическими факторами, вызывающими снижение уровня гемоглобина при химиотерапии, являются миелосупрессия и блокирование выработки эритропоэтина, вследствие нефротоксичности многих препаратов [10]. Особенностью АХЗ при злокачественных новообразованиях является снижение содержания сывороточного железа, общей железосвязывающей способности сыворотки крови и насыщения трансферрином [11].
Для лечения АХЗ у таких больных также с успехом применяют эритропоэтины. Так, у 399 пациентов с анемией на фоне солидных опухолей после введения эритропоэтина значительно увеличилась концентрация гемоглобина, а потребность в заместительных гемотрансфузиях была снижена.
Однако у 30–50 % таких больных может наблюдаться толерантность к препарату и отсутствие эффекта [12]. В этих случаях может быть полезным парентеральное введение железа, которое обусловливает усиление ответа на эритропоэтин у онкологических больных, получающих химиотерапию.
Анемия при системных заболеваниях соединительной ткани (СЗСТ)
Возникновение анемии при СЗСТ, как правило, обусловлено множеством причин. Снижение гемоглобина может быть следствием непосредственного воздействия цитокинов на костный мозг, а также повышением уровня гепсидина, что является характерными механизмами при АХЗ. Помимо этого, при лечении глюкокортикоидами и НПВС анемия возникает вследствие кровопотерь из ЖКТ. Цитостатики и иммунодепрессанты, также применяющиеся при СЗСТ, обусловливают развитие апластической анемии. При ревматоидном артрите и системной красной волчанке может возникать гемолитическая анемия.
Лечение анемии при СЗСТ зависит от ее патогенеза. В случае АХЗ целесообразно применение эритропоэтинов.
Некоторые редкие виды анемий, сопровождающиеся повышенным уровнем сывороточного железа
Талассемии
В связи с расширением туристических и международных связей на территории России встречаются такие редкие виды анемий, как талассемии.
Это гетерогенная группа гемоглобинозов, в основе которых имеет место дефицит синтеза полипептидных цепей, которые входят в состав нормального гемоглобина. Талассемии являются наследственными заболеваниями. Основные виды талассемий распространены в странах Средиземноморья, Западной Азии и Северной Африки. Кроме того, 7—10 % населения Азербайджана являются носителями талассемии.
В зависимости от того, синтез каких цепей глобина (альфа или бета) снижен, выделяют две группы талассемий: альфа-талассемия и бета-талассемия.
Для врача-терапевта очень важно вовремя заподозрить и правильно дифференцировать талассемию и ЖДА. Как и для других видов анемий, связанных с нарушением синтеза порфиринов и гема, талассемия носит микроцитарный характер, но в отличие от ЖДА связана с высоким содержанием железа.
Выраженность клинических проявлений зависит от вида талассемии. Но такие характерные изменения, как сплено– и гепатомегалия, иногда – желтуха, а также отсутствие трофических изменений кожи и слизистых, связанных с железодефицитом, позволяют с высокой вероятностью исключить ЖДА.
Лабораторные характеристики талассемии таковы: в мазке крови обнаруживают малых размеров мишеневидные эритроциты; повышен уровень непрямого билирубина, сывороточного железа, снижена ОЖСС.
Анемия при отравлении свинцом
Среди всех приобретенных анемий из группы приобретенных порфирий, пожалуй, наибольшее практическое значение имеет анемия, связанная со свинцовым отравлением.
Отравление вызывают растворимые соли свинца. Чаще всего это касается лиц, имеющих контакт со свинцом на производстве. Возможно также и бытовое отравление свинцом, так как свинец применяется во многих продуктах, например в пигментах, красках, витражах, хрустальной посуде, ювелирных изделиях, изготовлении водопроводных свинцовых труб и т. д.
В основе патогенеза анемии, связанного с отравлением свинцом, лежит нарушение синтеза гема и накопление свободного железа и свинца, которые могут откладываться в органах. В клинической картине помимо признаков анемии имеет значение поражение нервной системы в виде полинейропатии и желудочно-кишечного тракта, проявляющегося болями в животе. Последняя группа симптомов очень часто ошибочно вызывает подозрение в отношении желудочно-кишечного кровотечения при дифференциальной диагностике с ЖДА.
Среди лабораторных признаков анемии, связанной с отравлением свинцом, значение имеет снижение MCV, повышение уровня сывороточного железа, повышение уровня свинца в крови, иногда – повышение непрямого билирубина.
Послесловие
Итак, анемия – это распространенное заболевание, встречающееся часто в амбулаторной практике терапевта. Анемия является независимым фактором риска инфаркта миокарда у мужчин и серьезных сердечно-сосудистых осложнений как у мужчин, так и у женщин. Поэтому любая анемия требует внимания, постановки диагноза и назначения лечения (рис. 31). К сожалению, на практике это далеко не так. Нет настороженности у терапевта, причины анемии далеко не всегда устанавливаются, а следовательно, лечение не назначается.
Рисунок 31. Проблемы диагностики анемии
Одна из глав книги названа «Интрига поликлиники-2013». И это действительно так. На рис. 32 представлены результаты спонтанного измерения гемоглобина у 149 пациентов, пришедших на прием к терапевту суммарно за 2 дня. Об этом мы уже писали выше. Но вот в чем дело: из 149 у 22 пациентов была выявлена анемия. В поликлинике удалось найти только 9 амбулаторных карт [12]12
Примечание научного редактора: многие пациенты хранят свои амбулаторные карты дома, ссылаясь на возможность их утери в поликлинике.
[Закрыть].
Рисунок 32. Результаты спонтанного измерения гемоглобина в поликлинике
И вот что интересно: анемия выявлена и у беременных, пришедших к врачу с явлениями ОРВИ, и у больных с ИБС, и у пациента с циррозом печени, и просто у человека, который устраивается на работу. Какая галерея образов! Ну а что дальше? А дальше требуется выполнение алгоритма (рис. 33), который, как нам кажется, может быть полезен на практике, уважаемые терапевты.
Рисунок 33. Диагностический алгоритм при снижении Hb
Приложения
Источник: iknigi.net
гранулоцитарные колониестимулирующие факторы
гранулоцитарно-макрофагальные факторы роста
источник
1 ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ АНЕМИИ, ОБУСЛОВЛЕННОЙ ДЕФИЦИТОМ В 12 1
2 Ответственные исполнители: — Демихов Валерий Григорьевич д- р мед. наук, проф., директор Научно- клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России -Скобин Владимир Борисович канд. мед. наук, научный сотрудник Научноклинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России — Журина Ольга Николаевна канд. мед. наук, научный сотрудник Научноклинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России Рецензирование, обсуждение содержания рекомендации проводилось на сайте НОДГО, совещаниях, съездах педиатров, гематологов России 2
3 Диагностика и лечение анемии, обусловленной дефицитом В 12 МКБ-10: рубрикой D51 Анемия, обусловленная дефицитом В12 Код по МКБ-10: D51 Этиология и патогенез Основные причины развития В12-дефицигной анемии: строгая вегетарианская диета; врожденный дефицит внутреннего фактора Кастла; глистная инвазия; гастрэктомия; болезни тонкого кишечника; резекция кишечника; синдром слепой кишки; синдром Иммерслунд Гресбека; инаследственный дефицит транскобаламина II Цианокобаламин (витамин В12) является кофактором метилтрансфе-разной каталитической реакции, осуществляющей ресинтез метионина и одновременно регенерацию 5-метилтетрагидрофолата в тетрагидро -фолат и 5,10-метилентетрагидрофолат. При недостаточности фолатов и (или) цианкобаламина нарушается процесс включения уридина в дезоксирибонуклеиновую кислоту (ДНК) развивающихся гемопоэтичеких клеток и образования тимидина, что обусловливает фрагментацию ДНК (блокирование ее синтеза и нарушение клеточного деления). При этом возникает мегалобластоз, происходит накопление больших форм лейкоцитов и тромбоцитов, их раннее внутри костномозговое разрушение и укорочение жизни циркулирующих клеток крови. В результате гемопоэз оказывается неэффективным, развивается анемия, сочетающаяся с тромбоцитопенией и лейкопенией. Кроме того, цианкобаламин является коферментом в реакции превращения метилмалонил-коа в сукцинил-коа. Эта реакция необходима 3
4 для метаболизма миелина в нервной системе, в связи с чем при дефиците цианкобаламина наряду с мегалобластной анемией отмечается поражение нервной системы, в то время как при недостаточности фолатов наблюдается только развитие мегалобластной анемии. Цианкобаламин содержится в пищевых продуктах животного происхождения печени, почках, яйцах, молоке. Запасы его в организме взрослого человека (главным образом в печени) велики около 5 мг, и если учесть, что суточная потеря витамина составляет 5 мкг, то полное истощение запасов при отсутствии поступления ( нарушение всасывания, при вегетарианской диете) наступает только через 3 года. Цианкобаламин в желудке связывается (на фоне кислой реакции среды) с внутренним фактором гликопротеином, продуцируемым париетальными клетками желудка, или другими связывающими белками R-факторами, присутствующими в слюне и желудочном соке. Эти комплексы предохраняют цианкобаламин от разрушения при транспорте по ЖКТ. В тонкой кишке при щелочном значении ph под влиянием протеиназ панкреатического сока цианкобаламин отщепляется от R-протеинов и соединяется с внутренним фактором. В подвздошной кишке комплекс внутреннего фактора с цианкобаламином связывается со специфическими рецепторами на поверхности эпителиальных клеток, освобождение цианкобаламина из клеток кишечного эпителия и транспорт к тканям происходит с помощью особых белков плазмы крови транскобаламинов. Так как в организме имеется значительный запас витаминов В12 и фолатов, для развития анемии требуется время. Однако существует ряд причин, которые могут привести к развитию острой мегалобластной анемии: длительный наркоз закисью азота; тяжелые заболевания с массивными трансфузиями, диализом, полным парентеральным питанием, прием антагонистов фолатов. 4
5 КЛИНИЧЕСКАЯ КАРТИНА Для В12-дефицитной анемии характерна триада: поражение крови; поражение ЖКТ; поражение нервной системы. Анемия проявляется слабостью, быстрой утомляемостью, одышкой, сердцебиением. В результате повышенного разрушения эритроидных клеток (неэффективный эритропоэз) развивается умеренная желтуха за счет непрямого билирубина. Поражение ЖКТ проявляется анорексией, глосситом, «лакированным» языком. Выявляется снижение желудочной секреции, атрофический гастрит. В результате поражения периферической нервной системы (фуникулярный миелоз) появляются атаксия, парестезии, гипорефлексия, рефлекс Бабинского, в тяжелых случаях клонус и кома. У детей раннего возраста развиваются гипотрофия, отставание в росте, раздражительность, хроническая диарея, склонность к инфекциям. ЛАБОРАТОРНАЯ ДИАГНОСТИКА В периферической крови при В12-дефицитной анемии выявляются следующие изменения: MCV увеличивается до фл при легкой и умеренной анемии, до фл при более тяжелой анемии. У большинства пациентов MCV нарастает в течение нескольких месяцев при отсутствии анемии и других клинических симптомов. Нарастание MCV на 5 фл от первоначального уровня дает основание заподозрить мегалобластную анемию и провести дальнейшие исследования. MCV >120 фл, как правило, является следствием мегалоблаетной анемии и исключает другие макроцитарные анемии. MCV может оставаться нормальным при сочетании с ЖДА, талассемией, анемией при хронических заболеваниях; показатель количества эритроцитов может быть очень низким. Степень анемии не коррелирует с выраженностью неврологической симптоматики, которая часто предшествует гематологическим нарушениям; RDW обычно значительно увеличен; МСН увеличен (33 38 пг) при умеренной анемии и достигает 56 пг при тяжелой анемии; МСНС остается в пределах нормы; 5
6 снижен уровень ретикулоцитов (менее 0,5%); количество тромбоцитов;лейкоцитов; отмечается выраженный анизо и пойкилоцитоз: характерны макроовалоциты (обычно встречаются только при мегалобластной анемии, как исключение при миелодисплазии), шизоциты, полихроматофилия, кольца Кебота, тельца Жолли, нормобласты. Ранним признаком развития мегалобластного кроветворения является наличие гиперсегментации нейтрофилов (обнаружение более 5% нейтрофилов с 5 сегментами или любое количество нейтрофилов с 6 и более сегментами подтверждает диагноз). В костном мозге имеются признаки эритроидной гиперплазии с мегалобластными изменениями; нарушения имеются во всех клеточных линиях, отмечаются признаки неэффективного эритропоэза. При сопутствующем дефиците железа мегалобластные изменения в эритроидном ростке могут быть замаскированы, но изменения в гранулоцитарном ростке сохраняются. При биохимическом исследовании крови выявляются значительное Увеличение уровня ЛДГ (преимущественно 1 и 2 фракции), снижение щелочной фосфатазы. В результате внутрикостномозгового гемолиза повышается уровень непрямого билирубина. Сывороточное железо и ферритин, а также костномозговое железо почти всегда увеличены. Специфические тесты Уровень витамина В 2 в сыворотке снижен. Норма пг/мл. Повышенный уровень метилмалоновой кислоты (норма нмоль/л) и гомоцистеина (норма 5 15 мкмоль/л). Положительный терапевтический тест: коррекция самочувствия, а также гематологических, биохимических показателей на фоне лечения. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА Дифференциальный диагноз проводят в группе заболеваний, протекающих с признаками мегалобластоидности или макроцигозом: фолиеводефицитная анемия; анемии с мегалобластоццным типом кроветворения: врожденная оротата-цидурия, синдром Леша Найена (Lesch-Nyhan), 6
7 тиаминзависимая мегалобластная анемия, врожденная дизэритропоэтическая анемия, рефрактерная мегалобластная анемия, эритролейкемия; заболевания, протекающие с макроцигозом, но без признаков мегалобластоидности апластическая анемия, аутоиммунная гемолитическая анемия, заболевания печени, гипотиреоз, сидеробластные анемии. ЛЕЧЕНИЕ И ВТОРИЧНАЯ ПРОФИЛАКТИКА В 12-ДЕФИЦИТНОЙ АНЕМИИ Витамин В12 назначается в дозе 5 мг/кг в день детям в возрасте до одного года, мкг в день детям после года, мкг в день подросткам. Курс лечения составляет 4 нед, Поддерживающая терапия: еженедельное введение препарата в той же дозе в течение 2 мес, затем последующие 6 мес препарат вводится 2 раза в месяц. При невозможности устранить причину развития анемии противорецидивные курсы лечения витамином В12 проводятся ежегодно, на один курс инъекций. Как правило, пациенты не нуждаются в переливании эритроцитной массы. Показания к переливанию эритроцитной массы возникают при снижении уровня гемоглобина ниже 50 г/л, тяжелых инфекциях, сердечно-сосудистых нарушениях. У отдельных пациентов на фоне лечения витамином В12 и активизации эритропоэза может проявиться дефицит железа, который препятствует полной нормализации показателей крови и требует стандартного лечения препаратами железа. ДИНАМИКА ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ ПОСЛЕ НАЗНАЧЕНИЯ ВИТАМИНА В12 Уровень гемоглобина и эритроцитов начинает увеличиваться через 2 нед и нормализуется между 4 и 6 нед лечения в зависимости от выраженностидефицита. Уровень гемоглобина нарастает медленнее, могут развиваться гипохромия и микроцитоз эрироцитов. Содержание ретикулоцитов начинает увеличиваться на 2 4-й день и становится максимальным на 8 9-й день, к 14-му дню нормализуется. 7
8 Одновременно повышается количество лейкоцитов и тромбоцитов. Гиперсегментация ядер нейтрофилов сохраняется до го дня от начала лечения. В костном мозге мегалобласты исчезают в течение ч от дачи препарата, изменения в морфологии ядер гранулоцитов сохраняются еще несколько дней.в биохимическом анализе увеличиваются уровни мочевой кислоты ихолестерина (максимум на пике ретикулоцитоза); уровни билирубина, ЛДГ, ЩФ нормализуются.уменьшается уровень сывороточного железа. ПЕРВИЧНАЯ ПРОФИЛАКТИКА В 12-ДЕФИЦИТНОЙ АНЕМИИ Первичная профилактика заключается в рациональном питании своевременной диагностике и лечении глистных инвазий, назначении витамина В12 при состояниях, ведущих к развитию его дефицита (например, после резекции кишечника, субтотальной резекции желудка). ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ Проводится в течение 2 лет. 8
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Ш ирокий спектр самых разнообразных заболеваний, приводящих к анемии наряду с различными механизмами развития анемического синдрома позволяет считать целесообразным осуществление диагностического поиска в определенной последовательности с решением конкретной диагностической задачи на каждом из этапов поиска.
На начальном этапе диагностического поиска основной целью является определение так называемого патогенетического варианта анемии (АН), т.е. основного механизма, обусловливающего снижение уровня гемоглобина у конкретного пациента.
На основании преобладающего механизма (не причины!) формирования различных видов анемий можно условно выделить несколько патогенетических вариантов:
– сидероахрестические (железонасыщенные) АН
– В12– дефицитные и фолиеводефицитные АН
– анемии при костно–мозговой недостаточности
– анемии при уменьшении объема циркулирующей крови
– анемии со смешанным механизмом развития.
На данном этапе фактически речь идет о синдромной диагностике, так как каждый из патогенетических вариантов представляет собой лишь отдельный анемический синдром (синдром железодефицитной, синдром гемолитической анемии и т.д.). Указанные варианты отражают лишь ведущий патогенетический механизм, в то время как причины развития АН при каждом патогенетическом варианте могут быть различными. Например, причиной железодефицитной анемии могут быть хронические кровопотери из ЖКТ, патология кишечника с нарушением всасывания, алиментарная недостаточность и др. Сидероахрестические анемии могут развиваться у больных хронической свинцовой интоксикацией, на фоне лечения некоторыми лекарственными препаратами (изониазид и др.).
На следующем этапе диагностического поиска после определения патогенетического варианта анемии задачей врача является распознавание заболевания или патологического процесса, лежащего в основе имеющегося анемического синдрома, т.е. выявление причины анемии у конкретного больного. Данный этап диагностического поиска может быть условно обозначен, как нозологическая диагностика. Последняя приобретает важное значение, поскольку позволяет во многих случаях проводить не только патогенетическую терапию анемии, например, препаратами железа, но и воздействовать на основное заболевание (устранение хронической кровопотери при железодефицитной анемии, купирование инфекционно–воспалительного процесса и т.д.).
Основным патогенетическим механизмом развития железодефицитной анемии (ЖДА) является недостаток в организме железа – главного строительного материала для построения молекулы гемоглобина, в частности, его железосодержащей части – гема. Основными критериями ЖДА являются следующие:
– низкий цветовой показатель
– гипохромия эритроцитов, микроцитоз
– снижение уровня сывороточного железа
– повышение общей железосвязывающей способности сыворотки
– снижение содержания ферритина в сыворотке.
На этапе нозологической диагностики поиск причины ЖДА должен проводиться с использованием наиболее информативных методов исследования для конкретной клинической ситуации (данные анамнеза, объективного обследования, дополнительные методы и т.д.) (рис. 1).
Рис. 1. Алгоритм диагностического поиска при гипохромной и нормо-/гиперхромной анемии
Основные причины развития ЖДА:
1. Хронические кровопотери различной локализации:
1. Хронические кровопотери различной локализации:
– желудочно–кишечные (гастроэзофагальная рефлюксная болезнь, эрозивно–язвенные поражения желудка, опухоли желудка и толстой кишки, терминальный илеит, неспецифический язвенный колит, дивертикулиты, кровоточащий геморрой и др.);
– маточные (меноррагии различной этиологии, миома, эндометриоз, внутриматочные контрацептивы;
– носовые (наследственная геморрагическая телеангиэктазия и другие геморрагические диатезы);
– почечные (IgA–нефропатия, геморрагический нефрит, опухоли почек, перманентный внутрисосудистый гемолиз);
– ятрогенные и искусственные кровопотери (частые кровопускания и заборы крови для исследований, лечение гемодиализом, донорство и др.).
2. Нарушение всасывания железа (энтериты различного генеза, синдром недостаточности всасывания, резекции тонкой кишки, резекция желудка с выключением 12–перстной кишки).
3. Повышенная потребность в железе (беременность, лактация, интенсивный рост и пубертатный период, В12 –дефицитная анемия, леченная цианокобаламином).
4. Нарушение транспорта железа (гипопротеинемии различного генеза).
5. Алиментарная недостаточность.
Лечение. При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). В целом ряде случаев (меноррагии и др.) основное значение приобретает патогенетическая терапия лекарственными препаратами железа (ПЖ).
В клинической практике ПЖ применяются внутрь или парентерально. Путь введения препарата у больных ЖДА определяется конкретной клинической ситуацией. В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. На российском фармацевтическом рынке имеется широкий выбор ПЖ для приема внутрь. Они различаются количеством содержащихся в них солей железа, в том числе двухвалентного железа, наличием дополнительных компонентов (аскорбиновая и янтарная кислоты, витамины, фруктоза и др.), лекарственными формами (таблетки, драже, сиропы, растворы), переносимостью, стоимостью (табл. 1)
Клинические рекомендации лечения ПЖ для приема внутрь:
– назначение ПЖ в виде солей внутрь с достаточным содержанием двухвалентного железа;
– назначение ПЖ в виде солей внутрь с достаточным содержанием двухвалентного железа;
– назначение ПЖ, содержащих вещества, усиливающие всасывание железа;
– нежелательность одновременного приема пищевых веществ и лекарственных препаратов, уменьшающих всасывание железа;
– целесообразность назначения препаратов железа, содержащих фолиевую кислоту, цианокобаламин при наличии смешанного характера анемии;
– назначение препаратов железа парентерально при нарушении кишечного всасывания;
– достаточная продолжительность насыщающего курса терапии (не менее 1–1,5 мес);
– необходимость проведения поддерживающей терапии ПЖ в соответствующих ситуациях.
При выборе лекарственного ПЖ следует ориентироваться на содержание в нем двухвалентного железа, которое только и всасывается в кишечнике. Входящие в состав многих лекарственных форм ПЖ аскорбиновая кислота, цистеин, фруктоза усиливают всасывание железа. Назначение препаратов железа в высоких дозах (300 мг в сутки) не приводит к увеличению всасывания ионов железа, однако вызывает значительное увеличение числа побочных эффектов. С учетом этого комбинированные препараты, содержащие в своем составе фолиевую кислоту, как необходимый компонент для нормального синтеза и созревания эритроцитов, и цианокобаламин, необходимый для нормального обмена фолиевой кислоты, являющийся основным фактором образования из нее активной формы, приводят к значительному увеличению скорости синтеза гемоглобина и повышают эффективность терапии железодефицитной анемии. Всем этим критериям удовлетворяет комплексный антианемический препарат Ферро–фольгамма, содержащий в своем составе, кроме сульфата железа, 100 мг аскорбиновой кислоты, 10 мкг цианокобаламина, 5 мг фолиевой кислоты. Так, например, при назначении препарата с низким содержанием двухвалентного железа количество принимаемых таблеток должно быть не менее 8–10 в сутки, в то время как препараты с высоким содержанием двухвалентного железа (Ферро–фольгамма) можно принимать в количестве 1–2 таблеток в сутки. Необходимо учитывать, что всасывание железа может уменьшаться под влиянием некоторых содержащихся в пище веществ (фосфорная кислота, соли кальция и др.), а также при одновременном применении ряда медикаментов (тетрациклины, соли магния). Во избежание этого в препарате Ферро–фольгамма все активные компоненты находятся в специальной нейтральной оболочке, обеспечивающей их всасывание главным образом в верхнем отделе тонкой кишки. Отсутствие местного раздражающего действия на слизистую желудка способствует хорошей переносимости.
Среди побочных проявлений на фоне применения ПЖ внутрь наиболее часто возникают тошнота, анорексия, металлический привкус во рту, запоры, реже – поносы.
Показаниями для применения ПЖ парентерально могут быть следующие клинические ситуации:
– непереносимость ПЖ для приема внутрь, не позволяющая дальнейшее продолжение лечения;
– необходимость более быстрого насыщения организма железом, например, перед оперативным вмешательством (миома матки, геморрой и др.).
Алгоритм ведения больших ЖДА представлен на рисунке 2.
Рис. 2. Алгоритм ведения больных железодефицитной анемией
Существует группа гипохромных анемий, при которых содержание железа в организме и его запасы в депо находятся в пределах нормы или даже повышены, однако включение железа в молекулу гемоглобина (в силу различных причин) нарушено, в связи с чем железо не используется для синтеза гема. Такие анемии обозначаются, как сидероахрестические («ахрезия» – неиспользование). Их удельный вес в структуре гипохромных анемий невелик. Тем не менее верификация сидероахрестической («железонасыщенной») анемии и ее дифференциальная диагностика с ЖДА имеют важное практическое значение. Ошибочная диагностика ЖДА у больных с сидероахрестическими анемиями обычно влечет за собой неоправданное назначение препаратов железа, которые в данной ситуации не только не оказывают эффекта, но еще больше «перегружают» запасы железа в депо. Критериями сидероахрестических анемий являются следующие:
Существует группа гипохромных анемий, при которых содержание железа в организме и его запасы в депо находятся в пределах нормы или даже повышены, однако включение железа в молекулу гемоглобина (в силу различных причин) нарушено, в связи с чем железо не используется для синтеза гема. Такие анемии обозначаются, как сидероахрестические («ахрезия» – неиспользование). Их удельный вес в структуре гипохромных анемий невелик. Тем не менее верификация сидероахрестической («железонасыщенной») анемии и ее дифференциальная диагностика с ЖДА имеют важное практическое значение. Ошибочная диагностика ЖДА у больных с сидероахрестическими анемиями обычно влечет за собой неоправданное назначение препаратов железа, которые в данной ситуации не только не оказывают эффекта, но еще больше «перегружают» запасы железа в депо. следующие:
– низкий цветовой показатель;
– повышенное (реже нормальное) содержание железа в сыворотке;
– нормальная или сниженная железосвязывающая способность сыворотки;
– нормальное или повышенное содержание ферритина в сыворотке;
– повышенное количество сидеробластов в костном мозге;
– повышенная экскреция железа с мочой после введения десферала;
– отсутствие эффекта от препаратов железа.
Сидероахрестические анемии представляют собой гетерогенную группу и возникают в результате различных причин. Поэтому нозологический этап диагностического поиска при сидероахрестических анемиях должен проводиться с учетом как клинической ситуации, так и знания основных заболеваний и патологических процессов, сопровождающихся развитием данного анемического синдрома. Известны несколько форм сидероахрестических анемий:
– наследственные формы (аутосомные и рецессивные, чувствительные и рефрактерные к применению пиридоксина);
– связанные с дефицитом фермента гемсинтетазы (обеспечивающей включение железа в молекулу гема);
– связанные с нарушением синтеза гемоглобина из–за патологии его глобиновой части (талассемия). Это заболевание рассматривается обычно в группе гемолитических анемий;
– приобретенные формы (алкогольная интоксикация, хроническая свинцовая интоксикация, воздействие некоторых медикаментов, миелопролиферативные заболевания, кожная порфирия, идиопатические формы).
Клинические рекомендации ведения больных сидероахрестическими анемиями:
– коррекция основного патологического процесса (отмена подозреваемого медикамента, ЭДТА при свинцовой интоксикации и др.);
– назначение пиридоксина при некоторых формах (наследственных);
– назначение десфериоксиамина при высоком уровне сывороточного железа;
– трансфузии эритроцитов по строгим показаниям (выраженная анемия у больных с сопутствующей патологией);
– противопоказание к назначению препаратов железа.
Среди гипохромных анемий определенное место занимают анемии при различных воспалительных заболеваниях как инфекционного, так и неинфекционного происхождения. При всем многообразии патогенетических механизмов анемий в данных ситуациях одним из основных считается перераспределение железа в клетки макрофагальной системы, активирующейся при различных воспалительных (инфекционных и неинфекционных) или опухолевых процессах. Поскольку истинного дефицита железа при этих анемиях не наблюдается, более оправданно говорить о железоперераспределительных анемиях.
Критерии железоперераспределительных АН:
- умеренно гипохромный характер анемии;
- нормальное или умеренно сниженное содержание сывороточного железа;
- нормальная или сниженная железосвязывающая способность сыворотки;
- повышение содержания ферритина в сыворотке;
- повышение количества сидеробластов в костном мозге;
- клинико–лабораторные признаки активного процесса (воспалительного, опухолевого);
- отсутствие эффекта от препаратов железа.
Выделение данного патогенетического варианта и осведомленность о нем практических врачей имеет важное значение ввиду сходства железоперераспределительных анемий с ЖДА и некоторыми сидероахрестическими анемиями (табл. 2), хотя сущность и терапевтические подходы при этих анемиях различны.
Наиболее частыми инфекционно–воспалительными заболеваниями, при которых возникают железоперераспределительные анемии, являются активный туберкулез различной локализации, инфекционный эндокардит, нагноительные заболевания (абсцессы брюшной полости, легких, почек, эмпиема и др.), инфекции мочевыводящих путей, холангит. Среди неинфекционных заболеваний подобный вариант анемий может развиваться при ревматических заболеваниях (ревматоидный артрит и инфекционные артриты с высокой активностью), хронических гепатитах, опухолях различной локализации при отсутствии хронических и острых кровопотерь. Назначение препаратов железа, цианокобаламина в этих ситуациях обычно неэффективно и лишь затягивает своевременное выявление основной причины анемии и соответствующую терапию. Основным способом коррекции анемии у данной категории пациентов является лечение активного воспалительного процесса.
В12 – дефицитные и фолиеводефицитные анемии
В основе данного патогенетического варианта лежит дефицит витамина В12, реже – фолиевой кислоты, возникающий вследствие различных причин. В результате дефицита происходит нарушение синтеза ДНК в кроветворных клетках, развивается неэффективный мегалобластический эритропоэз (в норме существует только у плода) с продукцией нестойких мегалоцитов и макроцитов.
Критерии В12– дефицитной АН:
– высокий цветовой показатель;
– эритроциты с остатками ядер (тельца Жолли, кольца Кэбота);
– повышение содержания железа в сыворотке;
– мегалобластическое кроветворение в костном мозге;
– неврологические нарушения и психические расстройства.
На этапе синдромной диагностики основным методом является исследование костного мозга, при котором выявляется мегалобластический эритропоэз. Данное исследование должно проводиться до назначения цианокобаламина, который широко и часто необоснованно назначается по поводу неясных АН или различной неврологической симптоматики. При невозможности выполнить диагностическое исследование костного мозга (отказ больных и др.) допустимо пробное назначение цианокобаламина с последующим обязательным исследованием количества ретикулоцитов через 3–5 дней (не позже), приобретающим диагностическое значение. Если АН связана с дефицитом витамина В12, то под влиянием нескольких инъекций препарата происходит трансформация мегалобластического кроветворения в нормобластическое, что отражается в периферической крови значительным увеличением количества ретикулоцитов по сравнению с исходным (ретикулоцитарный криз).
Основными причинами развития В12–дефицитной анемии, на исключение которых должен ориентироваться врач на этапе нозологической диагностики, являются следующие:
– нарушение всасывания витамина В12 (атрофический гастрит, рак желудка, операция гастрэктомии, резекция тонкой кишки, наложение кишечных анастомозов с формированием «слепой петли», энтериты с нарушением всасывания, спру, целиакия, селективный дефект (аутосомно–рецессивный) всасывания в сочетании с протеинурией, проявляющийся в раннем детском возрасте (синдром Имерслунд);
– повышенная потребность в витамине В12 (инвазия широким лентецом, дивертикулез толстой кишки, дисбактериоз кишечника, быстрый рост у детей, гипертиреоз, хронические заболевания печени);
– нарушение транспорта витамина В12 (дефицит транскобаламина II (аутосомно–рециссивно наследуемый дефект, проявляющийся в раннем детском возрасте);
– нарушение использования при приеме некоторых медикаментов (ПАСК, неомицин, метформин);
– алиментарная недостаточность (редкая причина) главным образом в детском возрасте, при длительном парентеральном питании без дополнительного введения витаминов.
Фолиево–дефицитные АН по своим гематологическим признакам (макроцитоз, мегалобластический эритропоэз) напоминают В12– дефицитные АН, но встречаются значительно реже и имеют несколько иной спектр вызывающих эти АН заболеваний. Среди причин фолиеводефицитных анемий основными следует считать:
– алиментарную недостаточность (частая причина у пожилых);
– энтериты с нарушением всасывания;
– прием некоторых медикаментов, угнетающих синтез фолиевой кислоты (метотрексат, триамтерен, противосудорожные, барбитураты, метформин);
– хроническую алкогольную интоксикацию;
– повышенную потребность в фолиевой кислоте (злокачественные опухоли, гемолиз, эксфолиативный дерматит, беременность).
Алгоритм ведения больных с макроцитарной анемией неясного происхождения представлен на рисунке 3.
Рис. 3. Алгоритм ведения больных макроцитарной анемией неустановленной причины
Основным патогенетическим механизмом развития гемолитической АН (ГАН) является укорочение продолжительности жизни эритроцитов (в норме 100–120 дней) и их преждевременный распад под воздействием различных причин.
Основным патогенетическим механизмом развития гемолитической АН (ГАН) является укорочение продолжительности жизни эритроцитов (в норме 100–120 дней) и их преждевременный распад под воздействием различных причин.
Критериями ГАН являются следующие:
– нормальный цветовой показатель (низкий при талассемии);
– наличие в крови ядросодержащих эритроидных клеток (эритрокариоцитов);
– увеличение числа эритрокариоцитов в костном мозге (свыше 25%);
– повышение содержания непрямого билирубина в сыворотке с наличием желтухи или без таковой;
– повышение содержания железа в сыворотке;
– наличие в моче гемосидерина (при некоторых формах с внутрисосудистым гемолизом);
– повышение содержания свободного гемоглобина в плазме (при внутрисосудистом гемолизе);
– увеличение селезенки (при некоторых формах).
Большинство ГАН являются нормо– или гиперхромными за исключением ГАН, связанной с нарушением синтеза глобина (талассемия), которая является гипохромной.
Направление диагностического поиска на назологическом этапе определяется особенностями клинической ситуации (возраст больного, наличие и характер фоновой патологии, прием медикаментов, семейные случаи, острый или хронически протекающий гемолиз и т.д.). Следует различать наследственные и приобретенные ГАН.
Наследственные ГАН связаны с различными генетическими дефектами, в частности, с дефектом мембраны эритроцитов (наследственный микросфероцитоз, овалоцитоз), дефицитом некоторых ферментов в эритроцитах (глюкозо–6–фосфат–дегидрогеназа, пируваткиназа и др.), нарушением синтеза цепей глобина (талассемия), наличием нестабильных гемоглобинов.
Талассемию следует заподозрить у больных гипохромной анемией с нормальным или высоким содержанием сывороточного железа в сочетании с признаками гемолиза, а также при отсутствии эффекта от препаратов железа, нередко по ошибке назначаемых таким больным. Для подтверждения диагноза и определения формы талассемии необходимо электрофоретическое исследование гемоглобина.
Среди приобретенных ГАН наиболее распространенными являются аутоиммунные ГАН (симптоматические и идиопатические). Симптоматические аутоиммуные ГАН возникают на фоне лимфопролиферативных заболеваний (хронический лимфолейкоз, лимфогранулематоз и др.), системных васкулитов (системная красная волчанка, ревматоидный артрит), хронического активного гепатита, некоторых инфекций, в частности; вирусных, при приеме ряда медикаментов. Если причина аутоиммунного гемолиза не выявляется, то говорят об идиопатических ГАН. К приобретенным ГАН относятся болезнь Маркиафавы (перманентный внутрисосудистый гемолиз), микроангиопатические ГАН (гемолиз вследствие ДВС–синдрома на фоне различных заболеваний), механический гемолиз при протезированных сосудах и клапанах сердца, маршевой гемоглобинурии, ГАН при воздействии различных токсических веществ (уксусная кислота, мышьяк и др.).
Ведение больных аутоиммунными ГАН определяется вариантом ГАН (симптоматический или идиопатический) На рисунке 4 представлен алгоритм ведения больных аутоиммунной ГАН.
Рис. 4. Алгоритм лечения аутоиммунной гемолитической анемии
Анемии при костно–мозговой недостаточности
В основе данного патогенетического варианта АН лежит нарушение нормальной продукции эритроидных клеток в костном мозге. При этом часто одновременно с угнетением эритропоэза имеет место нарушение продукции клеток гранулоцитарного и тромбоцитарного ростков, что отражается на составе периферической крови (панцитопения) и служит ориентиром в распознавании возможного механизма развития АН.
В основе данного патогенетического варианта АН лежит нарушение нормальной продукции эритроидных клеток в костном мозге. При этом часто одновременно с угнетением эритропоэза имеет место нарушение продукции клеток гранулоцитарного и тромбоцитарного ростков, что отражается на составе периферической крови (панцитопения) и служит ориентиром в распознавании возможного механизма развития АН.
Критерии АН при костно–мозговой недостаточности:
– нормохромная (реже гиперхромная) АН;
– ретикулоцитопения (вплоть до полного отсутствия ретикулоцитов при некоторых формах);
– лейкопения за счет снижения содержания нейтрофильных гранулоцитов (гранулоцитопения);
– тромбоцитопения различной степени выраженности;
– лихорадка, инфекционные осложнения, язвенно–некротические поражения слизистых;
– изменения картины костно–мозгового кроветворения в соответствии с характером основного патологического процесса (замещение жировой тканью, инфильтрация бластными клетками и др.).
На рисунке 5. представлен диагностическаий алгоритм у больных с различными вариантами цитопенического синдрома (панцитопения, бицитопения). На рисунке 6 представлен алгоритм ведения больных с апластической анемией.
Рис. 5. Алгоритм диагностического поиска у больных панцитопенией
Рис. 6. Алгоритм ведения больных апластической анемией
Клинические рекомендации ведения больных апластической анемией:
- устранение выявленной причины (отмена лекарственного препарата, удаление тимомы, лечение вирусных инфекций и т.д.);
- HLA–типирование родных братьев и сестер больных с целью подбора донора костного мозга;
- трансфузии тромбоцитов при количестве тромбоцитов ниже 10х10 9 /л или при менее глубокой тромбоцитопении, но выраженном геморрагическом синдроме;
- трансфузии тромбоцитов от HLA–совместимых доноров при профузных кровотечениях;
- трансфузии эритроцитов при снижении Нв ниже 70 г/л или при менее глубокой анемии у пожилых и стариков;
- нецелесообразны трансфузии компонентов крови от родственников–потенциальных доноров костного мозга;
- эффективность антитимоцитарного глобулина и циклоспорина оценивается через 3–6 месяцев;
- назначение глюкокортикоидов в качестве монотерапии нецелесообразно;
- недоказанная эффективность рекомбинантных препаратов ростковых факторов (Г–КСФ, ГМ–КСФ, ИЛ–1, ИЛ–3);
- обеспечение условий, предупреждающих инфекционные осложнения.
Анемии с сочетанными патогенетическими механизмами
В клинической практике нередко встречаются АН, в развитии которых могут иметь значение два или более патогенетических механизма. Сочетанный патогенетический вариант может встречаться у больных пожилого и старческого возраста (например, железодефицитная анемия в сочетании с фолиеводефицитной анемией). В таких ситуациях оправдано назначение препаратов, содержащих железо и фолиевую кислоту.
источник
Источник: spk39.ru
 Атрофия желудка с нарушением образования внутреннего фактора Касла и развитием МА – болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла)
Атрофия желудка с нарушением образования внутреннего фактора Касла и развитием МА – болезнь Адиссона-Бирмера (пернициозная анемия, в 60% при ней обнаруживают АТ к париетальным клеткам желудка или к внутреннему фактору Касла)

